青年男性,腹泻便秘交替、双下肢无力2年:转甲状腺素相关的家族性淀粉样变性多神经病
2021-05-24王环洪道俊朱敏
王环 洪道俊 朱敏
1 临床资料
患者男,25岁,因“腹泻便秘交替、双下肢无力2年”于2020年9月17日就诊于南昌大学第一附属医院神经内科。
患者(III4)于2018年9月无明显诱因出现间断性大便次数增多,为稀水样便,无脓血、泡沫以及臭味,通常在服用辛辣、油腻及高蛋白时加重。开始时3~4次/d,之后逐渐发展为7~8次/d,每个月发生数次不等,持续数天到数周不等。另一方面,有时出现排便困难及大便干结,3~4 d排1次大便。曾多次前往消化内科行胃肠镜检查未见明显异常,给予对症治疗后症状改善不明显。几乎在发生消化道症状的同时,患者出现双下肢无力,并发现双下肢萎缩,无肢体麻木,双上肢无受累。2019年2月双下肢无力加重,踮脚困难,行走尚稳,并出现双下肢踝关节以下麻木、绷紧感,天冷时加重,有时头晕,与体位变化无关,无视物旋转。2020年5月出现行走不稳,蹲下站起困难,双下肢麻木发展至膝关水平。病程中无关节疼痛,无晨僵现象,无反复口腔溃疡,无出汗异常等症状。病程中患者饮食正常,小便排解正常,睡眠基本正常。
既往史及家族史:2017年11月患者出现视物黑点,刚开始2~3个点,之后黑点逐渐增。眼科医生诊断双玻璃体出血,双增生性玻璃体视网膜病,并发白内障,局麻下先后行双眼后入路玻璃体切割术+视网膜切除+视网膜激光术+白内障晶状体超声乳化吸出+人工晶体植入+玻璃体腔硅油充填术。否认高血压及糖尿病等慢性病史。自幼按计划进行免疫接种,无特殊药物史,无毒物接触史。祖父(I1)39岁死亡,有腹泻及消瘦史,具体死因不详;父亲(II3),有眼睛玻璃体浑浊,行手术治疗,后复发、失明,47岁时猝死;姑姑(II4),腹泻、消瘦以及心前区疼痛,37岁死亡(图 1)。
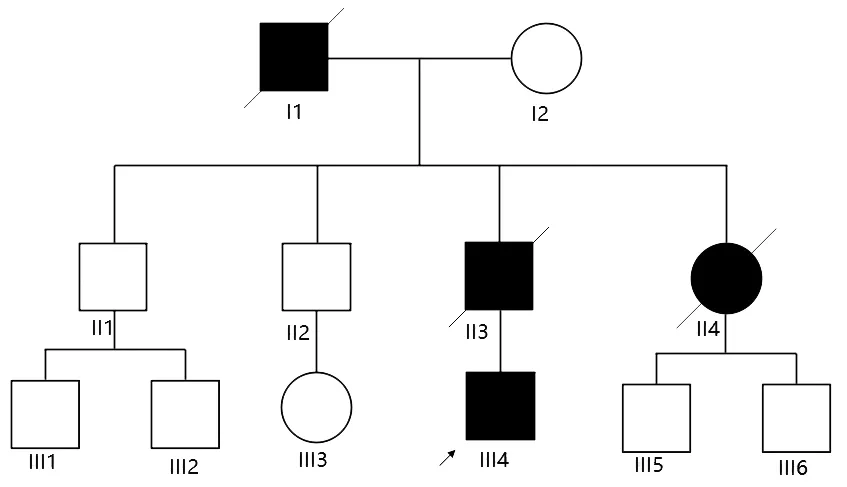
图1 家系图 箭头所示为先证者(III4),家系内祖父(I1)、父亲(II3)及姑姑(II4)有胃肠道紊乱病史,父亲还有玻璃体混浊史。
体格检查:体温 36.2℃,脉搏 96次/min,呼吸 20次/min,血压85 mmHg/50 mmHg。卧立位血压测定:平躺血压134mmHg/95mmHg,脉搏92次/min;站立1min血压60mmHg/40 mmHg,脉搏90次/min;站立 3 min 血压 67 mmHg/41 mmHg,脉搏 91次/min;站立 5 min血压89 mmHg/57 mmHg,脉搏92次/min,测量过程患者无头晕、胸闷、心悸、眼前发黑等症状。心律齐,叩诊心界不大,各瓣膜区听诊未闻及杂音。颈静脉无怒张,皮肤粗糙,皮肤营养状态稍差,双下肢无水肿。神志清楚,言语流利,高级皮层功能检查未见明显异常。双侧瞳孔术后改变,右侧直径3.5 mm,左侧直径2.0 mm,对光反射消失。双眼睑闭合力可,双侧眼球向各个方向运动正常,未及复视和眼球震颤。角膜反射正常,双侧面部痛温觉无减退。双侧颞肌、咀嚼肌对称有力,双侧额纹、鼻唇沟对称。悬雍垂居中,双侧软腭上抬有力,咽反射存在。双侧转颈、耸肩对称有力。伸舌居中,可见舌体肥大。双下肢膝关节以下肌肉萎缩,特别是足部肌肉萎缩明显。双上肢肌力5级,双下肢近端肌力4级,双踝背伸肌力3级左右,双踝趾屈肌力4级。双上肢深浅感觉检查正常,双下肢膝关节以远痛温觉减退,音叉震动觉减退。双上肢腱反射正常,膝反射和踝反射未引出。双侧指鼻试验正常,双上肢轮替运动正常,跟膝胫试验正常。双侧 Babinski’s征和Chaddock’s征均阴性。脑膜刺激征阴性。
辅助检查:血、尿、大便常规正常,肝肾功能、血糖、血脂、电解质、心肌酶谱、风湿四项、免疫固定蛋白电泳、肿瘤标记物、同型半胱氨酸均正常,梅毒抗体、抗HIV抗体阴性。24 h尿微量白蛋白 30.8 mg(正常值 20~30 mg)。心电图示:窦性心律,极度顺钟向转位。动态心电图:窦性心律,最小心率 68次/min,最大心率 103次/min,平均心率 84次/min,偶发房性早搏 6次/全程,偶发室性早搏10次/全程,检测中未见ST-T异常改变,极度顺钟向转位。眼底照相显示双眼视盘边界清,视网膜变薄透见脉络膜血管。双眼超声提示双眼玻璃体浑浊声像。心脏彩超示室间隔厚度15 mm(正常值 6~11 mm),左室壁厚度 15 mm(正常值 6~11 mm),提示左室壁弥漫性增厚,静息状态下室壁运动未见明显异常。心脏MRI示室间隔基底段、中段增厚(室间隔最厚约16~17 mm,前壁基底段约 7 mm,下壁基底段约 9 mm),余左室壁厚度正常:乳头肌增粗,左室侧壁及心尖部肌小梁粗重。考虑非梗阻性肥厚型心肌病,主要累及室间隔。头颅MRI平扫+增强未见明显异常。盆肌+大小腿肌肉MRI示双小腿肌肉萎缩,比目鱼肌脂肪浸润、水肿样改变。胸部CT示食管扩张,余未见明显异常。神经电图检查示双侧正中神经和尺神经运动波幅降低,双侧腓总神经和胫神经运动神经未引出,双侧正中神经、尺神经、腓浅神经感觉神经未引出。针刺肌电图示双侧拇短展肌、胫前肌、股四头肌、右侧肱二头肌呈神经源性损害,左侧肱二头肌未见异常。皮肤交感反射示双正中神经波幅明显降低,双侧胫神经未引出。
病理检查:为明确诊断行左侧腓肠神经活检,腓肠神经活检的苏木精-伊红(HE)染色显示神经外衣结构正常,个别血管壁局灶性增厚(图2A),未见坏死和炎细胞浸润,神经束衣内结构正常,未见水肿和吞噬现象。刚果红染色显示增厚血管壁可见刚果红染色阳性沉积(图2B)。髓鞘碱性蛋白(MBP)免疫组化染色显示有髓神经纤维密度重度下降。神经丝蛋白(NF)免疫组化显示神经纤维密度重度下降。甲苯胺蓝半薄染色显示神经束内神经纤维密度重度下降,仅残留个别有髓神经纤维,偶见小的神经再生簇(图2C),可见个别有髓神经纤维轴索变性形成的髓球样结构(图2D),未见有髓神经纤维洋葱球样结构,可见毛细血管基底膜增厚。

图2 左腓肠神经活检 HE染色显示神经外衣结构正常,血管壁局限性增厚,未见坏死和炎细胞浸润,神经束衣内结构正常,未见明显水肿和吞噬现象(A)。刚果红染色显示增厚血管壁可见刚果红染色阳性(B)。甲苯胺蓝半薄染色显示神经束内神经纤维密度重度下降,仅残留少量有髓神经纤维(C),可见个别有髓神经纤维轴索变性形成的髓球样结构(D)。
基因检查:患者血DNA标本二代测序显示TTR基因2号外显子存在一杂合突变c.157T>G (p.F53V),一代Sanger测序进一步证实了该位点的存在,该位点为文献已经报道的转甲状腺素相关的家族性淀粉样变性多神经病(Transthyretin-related familial amyloid polyneuropathy,TTR-FAP)相关突变[1-6]。
治疗:确诊后给予氯苯唑酸葡胺软胶囊20 mg,每日1次,目前已经服用3个月,患者诉腹泻症状有好转,体质量增加2.5 kg,肢体无力和麻木症状无明显改善,但亦无明显进展,其他身体状况未有明显不适。
2 讨论
TTR-FAP是由18号染色体长臂的转甲状腺素蛋白(transthyretin,TTR)基因突变导致的一种常染色体显性遗传性疾病,大约每10万人中就有1例[7],属于经典的神经系统罕见病。该病进行性发展,累及多个系统性,严重危及生命,自然病程约10年。其临床主要表现为长度依赖性轴索性感觉运动周围神经病、自主神经功能障碍、心肌病,以及眼部和肾脏病变。该患者为青年男性,表现为长度以来的感觉运动神经病、自主神经功能障碍、无症状心肌病,以及复杂眼病,符合TTR-FAP的临床表现。病理显示血管壁可见淀粉样物质沉积,TTR基因上发现经典的c.157T>G突变,尽管无法行家系验证,但结合临床、病理和基因结果可以诊断TTR-FAP。
研究显示TTR-FAR患者出现症状和体征的发病年龄因国家而异[8],在我国为(44.62±13.63)岁,早于美国的59.6岁和瑞典的(56.7±13.2)岁,而晚于葡萄牙的(42.8±15.0)岁,土耳其的(40.4±13.9)岁和巴西的 32.5 岁[9]。 因此国际上以50岁为界,分为晚发型和早发型,我国以早发型(60.4%)多见[9],本例患者神经系统就诊时间为 23岁,实际上22岁出现以眼部为首发症状,因此该例患者属于早发型 TTR-FAP。
TTR-FAP患者的神经系统症状主要包括感觉运动性周围神经病、腕管综合征、自主神经病、中枢神经系统淀粉样变性,而神经系统外病变常包括心肌病、胃肠道功能紊乱、肾病、玻璃体混浊、青光眼、听力下降等[5]。我国 TTRFAP的主要临床为轴索性感觉运动周围神经病变伴随自主神经功能障碍(84.6%),累及脏器包括心肌病(35.2%)、玻璃体混浊(25.3%)、肾功能衰竭(5.6%)和脑膜受累(2.5%)[9]。其中胃肠道功能紊乱被认为与自主神经病变密切相关,是TTR-FAP一种常见而严重的临床表现,56%~69%的患者报告了胃肠道功能紊乱,24.3%的患者表现为腹泻、便秘交替进行,其中早发型明显多于晚发型,严重影响患者正常生活,并且与患者死亡有很大关系[10]。胃肠道紊乱是很多TTR-FAP患者的首发症状,很多患者同该例患者一样因为胃肠道症状而反复至消化内科就诊,因临床医生对于该病认识不够而导致延误诊断,应提高医生对于该疾病的认识。
患者的临床表现与突变位点,以及基因修饰和环境等因素有关,如Val30Met主要表现为多发性神经病变,Val122Ile 主要表现晚发型心肌病[11],Leu58His、Ile84Ser和Tyr114His则表现为腕管综合征[12],而Ala97Ser表现为晚发型周围神经病和自主神经功能障碍,其中有接近一半以腕管为首发症状[13]。该例患者的基因突变已有报告,这报道患者以男性为主,发病年龄在47~64岁之间,平均55.2岁,其中除1例外,均为晚发型,临床均以多发性神经病,心脏病变和自主神经功能障碍[1-6],本例患者症状与文献报告一致,但发病年龄明显偏小,且发病的家系成员似乎也都属于早发型,提示该家系内存在疾病修饰基因或者家庭环境因素等影响。
周围神经神经病变主要表现为对称性双下肢肌无力、肌萎缩以及腱反射减退或者消失,主要与慢性格林巴利相鉴别[14]。电生理特点为波幅降低的轴索性改变,然而部分患者电生理表现为传导速度减慢和远端潜伏期延长,提示脱髓鞘,故脱髓鞘特点不能排除TTR-FAP[15]。日本学者以Val30Met突变点为主线进行总结,如进行性感觉运动多神经病变和≥1个红旗征和症状(如家族史、自主神经功能障碍、心脏受累、腕管综合征、胃肠道紊乱、原因不明的体重减轻、免疫治疗抵抗)提示TTR-FAP可能[16],需进一步行TTR基因检测。
TTR主要由肝脏产生,其次是脉络丛和视网膜色素上皮细胞,以同源四聚体的形式存在,主要参与甲状腺素和视黄醛的转运。TTR基因突变可导致TTR四聚体稳定性下降,形成错误的折叠单体,组装成β结构纤维,进而形成淀粉样蛋白沉积在全身的各个器官,导致全身器官功能障碍[17]。目前全世界范围内已经报告了120多个TTR突变,常见的突变类型有 Val30Met、Glu89Gln、Val122Ile, 其中Val30Met是最常见的突变类型,约占所有突变类型的73%[18-19]。突变的类型具有地域分布特点,如Val30Met主要分布在葡萄牙、瑞典和日本;Val122Ile主要在非洲裔美国人中;Thr60Ala在英国最常见[13];而在中国则是Ala97Ser最常见,其次为 Val30Met和 Val30Ala[9];而我们报告的Phe33Val则在波兰最常见[1]。
目前TTR-FAP的治疗方法有肝移植、TTR稳定剂(氯苯唑酸和二氟尼柳)、反义核苷酸(伊诺特森)、RNA干扰剂(帕西兰)和对症治疗。肝移植是治疗该疾病的最有效方法,特别是在Val30Met突变中[20],但由于肝源、感染和费用等限制,肝移植治疗该疾病在我国未被推广。而且肝移植后,不能阻止心脏、眼部和中枢神经系统病变的发展,如有心脏受累,一般不建议行肝移植[21]。目前应用较多是TTR稳定剂,二氟尼柳在我国未批准治疗TTR-FAP,国外部分国家已获批。本例患者在基因诊断后予以氯苯唑酸治疗,因心脏已有病变,未建议行肝移植治疗,随访患者症状未进一步恶化,需进一步观察疗效。伊诺特森和帕西兰用于1期和2期患者。对症治疗主要针对于胃肠道功能紊乱,治疗恶心、呕吐,可予以多巴胺受体拮抗剂如甲氧普胺和多潘立酮,胃受体激动剂(如红霉素、克拉霉素和阿奇霉素);治疗便秘可予以膳食纤维和聚乙二醇;腹泻与便秘可予以间断5~7 d的抗生素如环丙沙星、四环素、甲硝唑和利福昔明;持续性腹泻,可予以消胆胺、奥曲肽以及低脂饮食等[7]。
3 点评
TTR-FAP是多系统疾病,涉及神经内科、消化内科、眼科以及心内科等多个学科,它可以以任何一个系统的临床表现为首发而至相关科室就诊,如果该科室的医生对该疾病不认识,容易导致误诊及漏诊,而影响患者的治疗,各科室医生需提高对该疾病的认识,各科医生相互协作。
随着专科化程度越来越高,特别是专科亚专业的发展,很多临床医生对亚专业内的知识认识很深刻,但是常常漏诊其他系统疾病,也常常忽略患者就诊主诉和其他系统疾病之间是否存在内在联系。TTR-FAP就是一个非常经典例子,尽管几乎所有的患者最后都会出现“周围神经病、胃肠道功能紊乱、肥厚性心肌病”三联征,但是不同的个体在疾病的发生和发展过程中,存在显著的异质性。如果没有追根究底的精神,很多患者会被误诊和漏诊,导致错过最佳干预窗口。我们在前几期本刊报告的Fabry病和TTR-FAP存在很多的类似[22],Fabry病患者也可以表现为周围神经病、心肌病、肾脏病变、眼病、胃肠道功能紊乱等多系统受累,其致病机制也是因为异常物质沉积在各个组织器官,导致多系统病变。因此,作为一名合格的神经内科医生,时刻警惕并理清其他系统病变,既是对医生的基本要求,也是为一些疑难罕见病打开一扇窗户的契机。
