紫菜薹BrbHLH49基因克隆与功能分析
2021-05-24王建军徐园园刘同坤侯喜林
王建军,徐园园,刘同坤,侯喜林
(南京农业大学作物遗传与种质创新国家重点实验室/农业农村部华东地区园艺作物生物学与种质创制重点实验室/园艺学院,江苏 南京 210095)
紫菜薹(BrassicacompestrisL. var.purpureaBailey)是十字花科芸薹属白菜亚种中的一个变种[1]。紫菜薹是我国的特产蔬菜,目前全国各地均有种植,它色泽红艳、脆嫩味美、营养丰富,深受人们的喜爱,在蔬菜生产和消费中占有重要地位。
紫菜薹的薹和叶中的花色苷类物质具有抗氧化、抗癌、抗突变及抗病毒等生物活性[2-4],对植物的生长发育也发挥着重要作用[5]。花青素属于黄酮类物质,是一种水溶性的天然色素,自然状态下以花色苷的形式存在。花青素可为植物着色、保护植物免受紫外线伤害、增强植物对低温胁迫的抵抗力等[6-8]。花青素具有很强的抗氧化性,对心血管具有保护作用,因此可被用作保健品[9]。花青素生物合成的前体物质是苯丙氨酸,在杨树中,花青素合成是在查尔酮合酶(CHS)、查尔酮异构酶(CHI)、黄烷酮3-羟化酶(F3H)、黄烷酮3′-羟化酶(F3′H)、类黄酮3′5′-羟化酶(F3′5′H)、二氢黄酮醇4-还原酶(DFR)和花青素合酶(ANS)等一系列酶的催化下完成的[10-11]。花青素生物合成基因的表达受MBW复合体调控,MBW复合体由2种转录因子R2R3-MYB和碱性螺旋-环-螺旋结构(bHLH)以及WD40重复蛋白组成[12-13]。bHLH49属于bHLH家族,bHLH家族存在于多数植物体中,在拟南芥和水稻中分别有162、180个成员[14-15]。目前,在多种植物中已发现参与调控的bHLH转录因子,如拟南芥中EGL3、GL3、TT8[16],番茄中SlbHLH22[17],葡萄中VvMYCA1[18]以及烟草中NtAn1和NtAn2[19]等。
本研究从紫菜薹中获得BrbHLH49基因全长序列,对BrbHLH49进行亚细胞定位,分析BrbHLH49基因在紫菜薹和‘四九菜心’(‘CX-49’)不同组织中的表达模式,并转化拟南芥对其进行功能研究,旨在探讨BrbHLH49基因在花青素合成过程中的作用,为紫菜薹高花青素品质育种提供理论基础。
1 材料与方法
1.1 植物材料
供试材料为紫菜薹和不结球白菜品种‘四九菜心’(‘CX-49’),由南京农业大学园艺学院白菜系统生物学实验室提供。待植株长至第2片真叶完全展开时取样,液氮速冻后,于-80 ℃的超低温冰箱中保存,用于后续试验。
1.2 紫菜薹BrbHLH49基因的克隆
按照RNA Simple Total RNA Kit(TaKaRa)说明书提取紫菜薹RNA,用PrimeScriptTMⅡ 1stStrand cDNA Synthesis Kit(TaKaRa)将RNA反转录合成cDNA,作为克隆BrbHLH49基因的模板。参照文献[20]的BrbHLH49(Bra004348)基因序列,采用Primer Premier 5.0软件设计引物BrbHLH49-F/R,引物序列见表1。

表1 本研究所用的引物Table 1 Primers used in this study
1.3 BrbHLH49基因的氨基酸和系统进化树分析
用Bioxm 2.7软件分析基因序列的开放阅读框(ORF)。利用NCBI网站的BLAST对编码的蛋白进行同源检索,并下载甘蓝型油菜、野甘蓝(原变种)、萝卜、山萮菜、拟南芥、荠菜和醉蝶花的bHLH49氨基酸序列,利用DNAMAN 6.0软件进行氨基酸序列比对,用MEGA 7.0软件进行系统进化树分析。
1.4 Gateway技术构建载体
用Gateway技术构建BrbHLH49载体[21],利用同源重组的原理,按D-TOPO试剂盒(Invitrogen)中Gateway的说明方法,进行BP和LR反应,构建植物过表达载体。在正向引物的5′端加上CACC序列,设计Gateway引物gateway-BrbHLH49-F/R(表1)。使用PrimerSTAR Max高保真酶进行PCR扩增,反应程序为:96 ℃ 5 min;96 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,30个循环;4 ℃保存。用10 g·L-1琼脂糖凝胶电泳检测,胶回收目的片段。参照王惠玉等[22]的方法获得测序正确的表达载体pEarlyGate101-BrbHLH49-YFP。
1.5 BrbHLH49蛋白的亚细胞定位分析
采用冻融法将验证后的表达载体pEarlyGate101-BrbHLH49-YFP转入农杆菌GV3101菌株中,采用Zheng等[23]农杆菌介导侵染烟草的方法,用注射器将含有pEarlyGate101-BrbHLH49-YFP的重悬菌液[终浓度为10 mmol·L-1MgCl2、10 mmol·L-1MES(pH5.7)、150 μmol·L-1乙酰丁香酮]注射到1月龄的本氏烟草(Nicotianabenthamiana)叶片背面(避开烟草叶脉),置于人工气候室中培养2~3 d后,在激光共聚焦显微镜下观察YFP黄色荧光信号并拍照,分析BrbHLH49的亚细胞定位。
1.6 BrbHLH49转基因植株的筛选
将含有过表达载体pEarlyGate101-BrbHLH49-YFP的农杆菌接种于含卡那霉素的液体LB培养基中,28 ℃、200 r·min-1振荡培养18 h;将菌液移至含有相同抗生素的液体LB培养基中,28 ℃、200 r·min-1振荡培养至D600值为1.0;5 000 r·min-1离心5 min,收集菌体,用渗透缓冲液重悬菌体,使其D600值为0.8。用蘸花法侵染野生型拟南芥:将花序浸入渗透缓冲液,侵染1 min,每周侵染1次,共2~3次。被侵染植株收获的种子记为T0代。将消毒后的T0代种子播种于含有潮霉素(hygromycin B)和特美汀(termetin)的MS板上,筛选出35S∶BrbHLH49-YFP的阳性苗植株即为T1代,收种后继续筛选。
1.7 实时荧光定量PCR分析
待野生型和转基因拟南芥植株T2代长至15 d左右时,用RNA Simple Total RNA Kit提取叶片的总RNA,用PrimeScriptTMⅡ 1stStrand cDNA Synthesis Kit将提取的RNA反转录成cDNA,并用无菌水稀释5倍后作为RT-qPCR的模板。以PP2A为内参基因,采用RT-qPCR测定AtCHS、AtCHI、AtDFR和AtANR基因的相对表达量,以ACTIN作为内参基因,测定BrbHLH49的相对表达量(引物见表 1)。
以‘CX-49’作为对照,待其长至4叶期时,分别提取其叶片中的总RNA,并反转录成cDNA。以不结球白菜ACTIN作为内标基因,设计荧光定量PCR引物(引物序列见表1),进行RT-qPCR分析。反应体系:SYBRPremixExTaq10 μL,cDNA 1 μL,正、反引物各1 μL,ddH2O 7 μL。采用2-ΔΔCT法计算基因的相对表达量。
选取紫菜薹和‘CX-49’的根、薹、叶进行BrbHLH49基因定量分析,基因表达量的测定方法同上。
1.8 花青素含量的测定
参照王小青等[24]的方法,分别取野生型和过表达BrbHLH49植株(#1)叶片(不避开叶脉,茎和叶都取)各3份,每份约为0.2 g,剪碎后用冰盒保存并迅速送至实验室测定样品花色素含量。将样品分别用含有20 mL 0.1%(体积分数)盐酸甲醇溶液提取液于黑暗条件下浸泡24 h,期间定时摇晃,24 h后1 000 r·min-1离心10 min,取上清液,用分光光度计分别测定D530和D650值,计算花青素含量。
2 结果与分析
2.1 紫菜薹BrbHLH49基因的克隆
通过同源克隆的方法,从紫菜薹中克隆出BrbHLH49基因全长,序列分析表明,BrbHLH49基因含有1个长度为1 431 bp的开放阅读框(ORF),编码476个氨基酸,如图1所示。

图1 BrbHLH49基因的核苷酸序列及其编码的氨基酸序列Fig.1 Nucleotide sequence of BrbHLH49 gene and its encoded amino acid sequence*表示终止密码子。 * represents stop codon.
2.2 BrbHLH49氨基酸比对和系统进化树分析
将BrbHLH49蛋白与7个物种的bHLH49蛋白进行氨基酸序列比对,结果(图2-A)显示:BrbHLH49蛋白与甘蓝型油菜和野甘蓝(原变种)的同源性最高,分别为91.94%和91.74%。进化树分析结果(图2-B)表明,BrbHLH49蛋白与甘蓝型油菜和野甘蓝(原变种)聚为一组,亲缘关系最近。
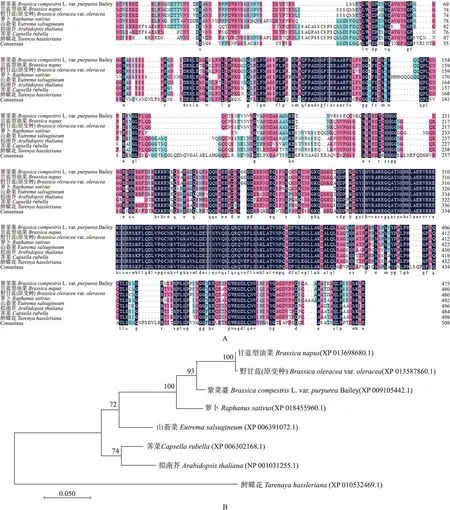
图2 紫菜薹与其他物种bHLH49同源氨基酸序列比对(A)及进化树分析(B)Fig.2 The alignment of amino acid of bHLH49 from purple tsai-tai and other plants(A) and phylogentic tree analysis(B)
2.3 BrbHLH49蛋白的亚细胞定位
亚细胞定位结果(图3)显示,BrbHLH49-YFP形成的融合蛋白与细胞核标记蛋白H2B-RFP重叠,表明BrbHLH49定位于细胞核上,说明其可能具有转录因子功能。

图3 BrbHLH49在本氏烟草叶片中的亚细胞定位Fig.3 Subcellular localization of BrbHLH49 in leaves of Nicotiana benthamianaH2B-RFP:核标记红色荧光信号The red fluorescence signals of H2B-RFP;YFP:BrbHLH49-YFP黄色荧光信号The yellow fluorescence signals of BrbHLH49-YFP.
2.4 不同组织中BrbHLH49基因的表达量分析
如图4所示:BrbHLH49基因在不结球白菜‘CX-49’的根、薹、叶中均有表达,而在紫菜薹的薹和叶中相对表达量均高于‘CX-49’,且差异极显著,说明BrbHLH49在紫菜薹的薹和叶中高表达,这与紫菜薹的薹和叶中花青素含量高相吻合。
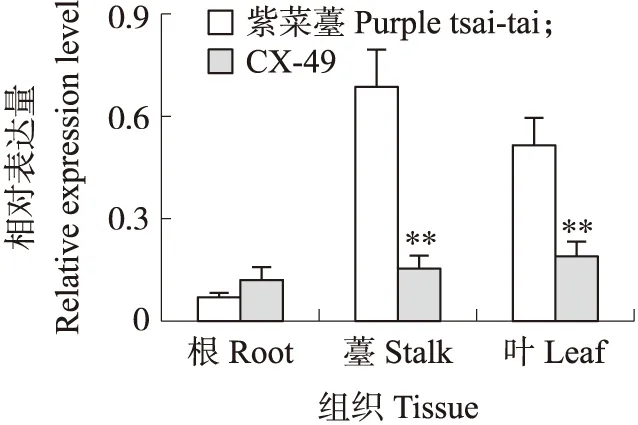
图4 不同组织中BrbHLH49基因的表达分析Fig.4 Expression analysis of BrbHLH49 gene in different tissues**P<0.01. The same as follows.
2.5 BrbHLH49转基因对拟南芥花青素含量的影响
将BrbHLH49转入野生型拟南芥,共得到7株阳性苗。如图5所示:与野生型拟南芥相比,35S∶BrbHLH49-YFP转基因植株的茎和叶呈明显的紫色,说明转基因植株中明显积累了花青素。选取紫色程度较深的#1植株T2代进行花青素合成相关基因定量分析,结果(图6)显示,BrbHLH49转基因植株(#1)中AtCHS、AtCHI、AtDFR和AtANR表达量均极显著高于野生型。此外,野生型和转基因植株(#1)叶片中花青素的含量分别为70和300 mg·g-1,且差异极显著,说明过表达植株中的花青素含量明显高于野生型植株。

图5 野生型和35S∶BrbHLH49-YFP转基因植株(#1、#2)表型Fig.5 Phenotypic of wild-type(WT)and 35S∶BrbHLH49- YFP(#1,#2)transgenic plants
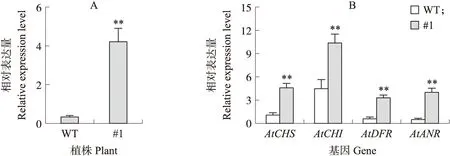
图6 野生型和35S∶BrbHLH49-YFP转基因植株(#1)中BrbHLH49(A) 以及与花青素合成相关基因(B)的相对表达量Fig.6 The relative expression level of BrbHLH49(A)and anthocyanin biosynthesis genes(B) in wild-type(WT)and 35S∶BrbHLH49-YFP transgenic plants(#1)
3 讨论
紫菜薹是最受人们欢迎的蔬菜之一,它的叶和茎中含有大量的花青素,因而呈紫色。结合本试验中BrbHLH49基因在紫菜薹茎和叶高表达的研究结果,说明BrbHLH49基因可能促进紫菜薹中花青素的合成。因此研究紫菜薹中花青素生物合成的分子机制对高花青素紫菜薹的培育具有重要意义。
花青素由一系列结构基因编码的酶催化合成,再经过各种修饰被转运至液泡等部位储存[25]。相关基因主要被3类转录因子调控:MYB、bHLH和WDR(WD-repeat),它们主要通过形成MBW复合体来调控花青素的生物合成[26-27]。植物的bHLH转录因子参与调控多种生理途径,例如光合作用[28]、气孔开关[29]和激素应答[30]等。研究表明,bHLH转录因子可以调节多种植物花青素的合成过程,除了能正向调节花青素合成相关基因的表达外,还起负调控作用[15]。研究表明,苹果中MdbHLH5和MdbHLH155能促进花青素合成相关基因(AtF3H、AtCHS、AtCHI和AtDFR)的上调表达,在花青素合成过程中起正调控作用[31];而Zhao等[32]发现CpbHLH1转录因子和 NtAN2、AtPAP1相互作用,在转基因模式植物中表达会抑制其花色素的积累。BrbHLH49属于bHLH家族,Li等[20]的研究发现‘向红苔01’中花青素生物合成的调控可能是由于BrbHLH49基因的高表达所致,推测7号染色体上的BrbHLH49是紫色茎中花青素合成的最佳候选基因。本研究利用同源克隆的方法在紫菜薹中克隆出BrbHLH49基因,通过构建过表达载体,亚细胞定位结果分析表明BrbHLH49定位在细胞核上,说明其可能具有转录因子的功能,参与调控花青素生物合成过程,与Li等[20]的研究结果相一致。
本研究发现与花青素合成相关的基因AtCHS、AtCHI、AtDFR和AtANR在BrbHLH49转基因植株中的表达量均显著高于野生型,说明紫菜薹中的BrbHLH49基因能够促进花青素合成相关基因表达,从而促进花青素的合成,但上调的花青素合成基因是否为BrbHLH49基因的互作靶基因仍需进一步深入研究。
