观赏向日葵不同花色物质组成的靶标代谢组学分析
2021-05-24赵君徐剑文刘剑光陈涛施洋戚永奎肖松华
赵君,徐剑文,刘剑光,陈涛,施洋,戚永奎*,肖松华*
(1.江苏省农业科学院经济作物研究所/农业农村部长江下游棉花和油菜重点实验室,江苏 南京 210014;2.江苏沿海地区农业科学研究所,江苏 盐城 224002)
向日葵(Helianthusannuus)根据用途可划分为磕食型、油用型和观赏型[1-2]。观赏型葵花因其花色鲜艳多样,广泛用于切花、盆花、染色花、庭院美化及花境营造等领域[3]。植物花色的形成是多种因子协同作用的结果,涉及多种代谢物质,其中最主要的是色素。色素有许多种类,主要包括类胡萝卜素、类黄酮和生物碱等三大类[4-6]。不同颜色的植物组织中包含的色素种类或含量不同[5],其中紫色花形成的主要色素是花青苷[6]。花青苷的生物合成是由多个酶催化完成的,编码这些酶的几乎所有基因均已分离,这些基因可以分成结构基因和调节基因,如苯丙氨酸解氨酶、查尔酮合酶、MYC(myelocytomatosis)和MYB(myeloblastosis)类转录因子基因等[7]。钟培星[8]研究表明,芍药花瓣中类黄酮的组成和含量在品种间差异明显,尤其在不同色系之间,但差异主要是由花青苷含量导致的。白色和黄色品种不含花青苷或含有微量的花青苷;红紫色的品种一般含有5~8种花青苷;查尔酮是组织呈现黄色的重要色素。张剑亮等[9]利用质谱分析方法分析观赏向日葵花瓣色素的主要组分,结果表明花色素苷类化合物天竺葵色素、锦葵色素和矢车菊素及其他苷类物质可能是花瓣呈现紫红色和红褐色的主要原因,红花苷可能是决定观赏向口葵花瓣呈现黄色或浅黄色的关键物质。利用现代生物技术手段,定量分析不同颜色向日葵花器官中的代谢物质差异,可以为今后培育不同种类观赏向日葵提供一定指导,为解析向日葵花色形成的分子机制提供基础。
代谢组学主要分为非靶标代谢组学和靶标代谢组学[10-11]。目前非靶标代谢组学的应用比较普遍,可以全面分析生物体内代谢物种类,但是其存在准确度不够、特异性缺乏等缺点。靶标代谢组学利用前期建立的各种代谢物数据库,结合多种代谢通路,对目标代谢物进行定量分析,准确度高,特异性强,弥补非靶标代谢组学的不足[12-14]。在本研究中,以2种不同花色的葵花为材料,利用靶标代谢组学定量分析不同花色葵花中代谢物差异,并对差异代谢通路进行富集,为不同花色葵花品种选育及葵花花色形成的分子机制解析提供一定的理论指导。
1 材料与方法
1.1 植物材料
‘盐葵4号’和‘盐葵5号’是江苏沿海地区农业科学研究所自主选育的观赏葵花品种,‘盐葵5号’是‘盐葵4号’种植过程中选育的自然突变株系。‘盐葵4号’舌状花为纯橙黄色,管状花、雌蕊以及萼片顶端为紫色,下胚轴为紫色。‘盐葵5号’舌状花为乳白色,管状花、雌蕊以及萼片顶端为淡黄色(图1)。以‘盐葵4号’和‘盐葵5号’子叶展平后地上部长度为2 cm的下胚轴(在文中紫色下胚轴被称为紫茎,简写为ZJ;白色下胚轴被称为白茎,简写为BJ)以及管状花、雌蕊和萼片的顶端颜色存在显著差异的部位(在文中紫色花组织被称为紫花,简写为ZH;白色花组织被称为白花,简写为BH)为材料。每个样品分别取10株混合,放入液氮速冻后-80 ℃保存,用于代谢组分析。每个材料3次重复。
1.2 仪器及试剂
主要试剂包括甲醇(67-56-1,LC-MS级,Honeywell)、甲酸(64-18-6,98%,SIGMA)、乙腈(75-05-8,LC-MS级,Honeywell);主要仪器包括超高效液相色谱仪(1290 UHPLC,Agilent;XCIEX AD,AB Sciex)、高分辨质谱仪(Q-Tof,AB Sciex)、高灵敏度质谱仪(Q-Trap 6500,AB Sciex)、纯水仪(明澈D24 UV,Merck Millipore)。其中超高效液相色谱仪使用的色谱柱为Waters公司生产的T3色谱柱(ACQUITY UPLC HSS T3 1.8 μm×2.1 mm×100 mm)。
1.3 代谢物提取方法
首先将样品冷冻干燥,利用JXFSTPRP-24研磨仪进行研磨(60 Hz,2 min);取100 mg样品加入到 2 mL 离心管中,加入1.5 mL提取液(甲醇、水体积比为3∶1),涡旋30 s后冰水浴超声15 min,混匀仪上 4 ℃ 过夜后,4 ℃、12 000 r·min-1离心15 min;小心吸取上清液置于2 mL进样瓶。每个样品取等体积混合成QC(quality control)样品,用于上机检测[14]。
1.4 上机检测及相关参数设置
使用Waters 的UPLC HSS T3 色谱柱(1.8 μm×2.1mm×100 mm),柱温箱温度设为40 ℃,自动进样器温度设为4 ℃,进样体积为2 μL。流动相A为体积分数为0.1%的甲酸水溶液,流动相B为体积分数0.1%的甲酸乙腈溶液。色谱梯度见表1。
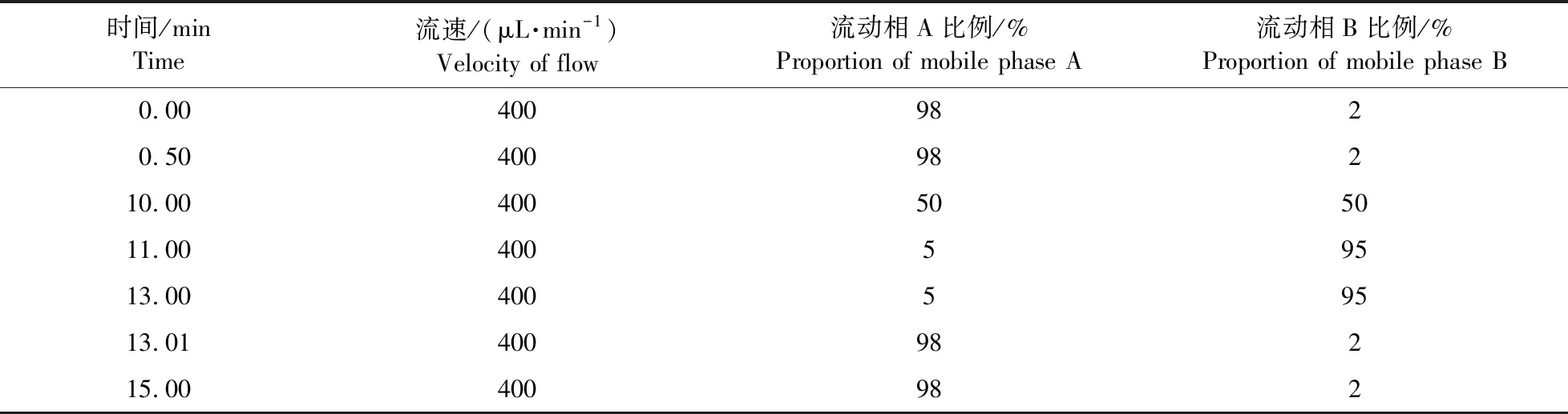
表1 液相色谱洗脱时流动相条件Table 1 The conditions of mobile phase in HPLC elution
使用Q-Tof高分辨质谱仪获得二级谱数据,构建多反应监测(MRM)库(母离子与二级谱中子离子组合成的离子对),再使用Q-Trap高灵敏质谱仪以MRM模式进行质谱分析得到检测的原始数据。将采集获得的数据用本实验室自建的数据库及MAPS软件进行数据分析。
Q-Tof 5600+质谱仪参数设置如下:使用Q-Tof高分辨质谱,通过IDA(information-dependent acquisition)模式进行高分辨质谱数据采集。数据采集软件(Analyst)依据一级质谱数据和预先设定的标准,自动选择离子并采集其二级质谱数据。每个循环选取12个强度大于100的离子。离子源参数如下:离子喷射电压+5 500/-4 500 V,帘气压力35 psi,离子源温度600 ℃,离子源气压60 psi,去簇电压±100 V。数据采集时按如下mass range进行分段:100~300、300~450、450~600、600~750、750~1 200。Q-Trap 6500质谱仪器参数设置与Q-Tof 5600+质谱仪参数设置相同。
1.5 代谢物鉴定
首先用高分辨质谱仪对样品进行超高覆盖率的二级质谱扫描,以获取所有代谢物的二级谱图(MS2),然后从中提取MRM离子对信息,对样本进行特异性建库,再利用三重四极杆质谱MRM技术进行精确定量[15]。
1.6 数据分析
本研究分析时用到的数据是由原始数据矩阵处理而来。计算及数据处理方法如下:对原始数据中的缺失值进行模拟(missing value recoding),数值模拟方法为最小值二分之一法,并利用每个样本的总离子流(total ion current,TIC)进行归一化处理。
用ProteoWizard软件将高分辨质谱原始数据转成mzXML格式,再使用MAPS软件(XCMS内核)进行保留时间矫正、峰识别、峰提取、峰积分、峰对齐等工作。使用自撰写R程序包和自建二级质谱数据库对峰进行物质鉴定。使用Skyline软件对MRM数据进行处理[16]。将数据矩阵导入SIMCA软件包,并进行无监督的主成分分析(principal component analysis,PCA)和有监督的(正交)偏最小二乘法(orthogonal partial least squares-discriminant analysis,OPLS-DA)分析。依据OPLS-DA模型第一主成分变量的重要性投影(variable importance in the projection,VIP)值>1.0且t测验的P<0.05来筛选组间的差异代谢物[17-18]。利用KEGG(http://www.genome.jp/KEGG/pathway.html)对差异代谢物进行注释,通过差异代谢物对KEGG、PubChem等权威代谢物数据库进行映射,在取得差异代谢物的匹配信息后,对通路数据库进行搜索和代谢通路分析[19-20]。
2 结果与分析
2.1 质谱分析体系建立
为保证检测过程中的仪器稳定性,在试验中以QC样品进行质控检测。结果显示,空白样品无显著峰,说明物质残留和样品间的交叉污染在可控范围内(图2-A),QC 样本TIC出峰保留时间和峰面积重叠很好,说明仪器稳定性很好(图2-B)。不同样品正反离子流图如图2-C所示,每个不同颜色的质谱峰代表检测到1个代谢物。采用无监督的主成分分析方法,得到不同颜色葵花样品的PCA得分图。4组样品的数据在PC1 维上可以明显区分(图2-D),3 次生物学重复数据能够较好地集中在一起,特别是茎部组织的样品,数据点几乎重合,表明在试验过程中数据的重现性较好,其中紫茎和白茎位于同一象限,紫花和白花位于不同象限中。OPLS-DA得分(图2-E)显示,紫茎和白茎数据点几乎重合,紫花和白花分别位于不同象限中,因此不同颜色的茎部组织比不同颜色的花组织差异小。
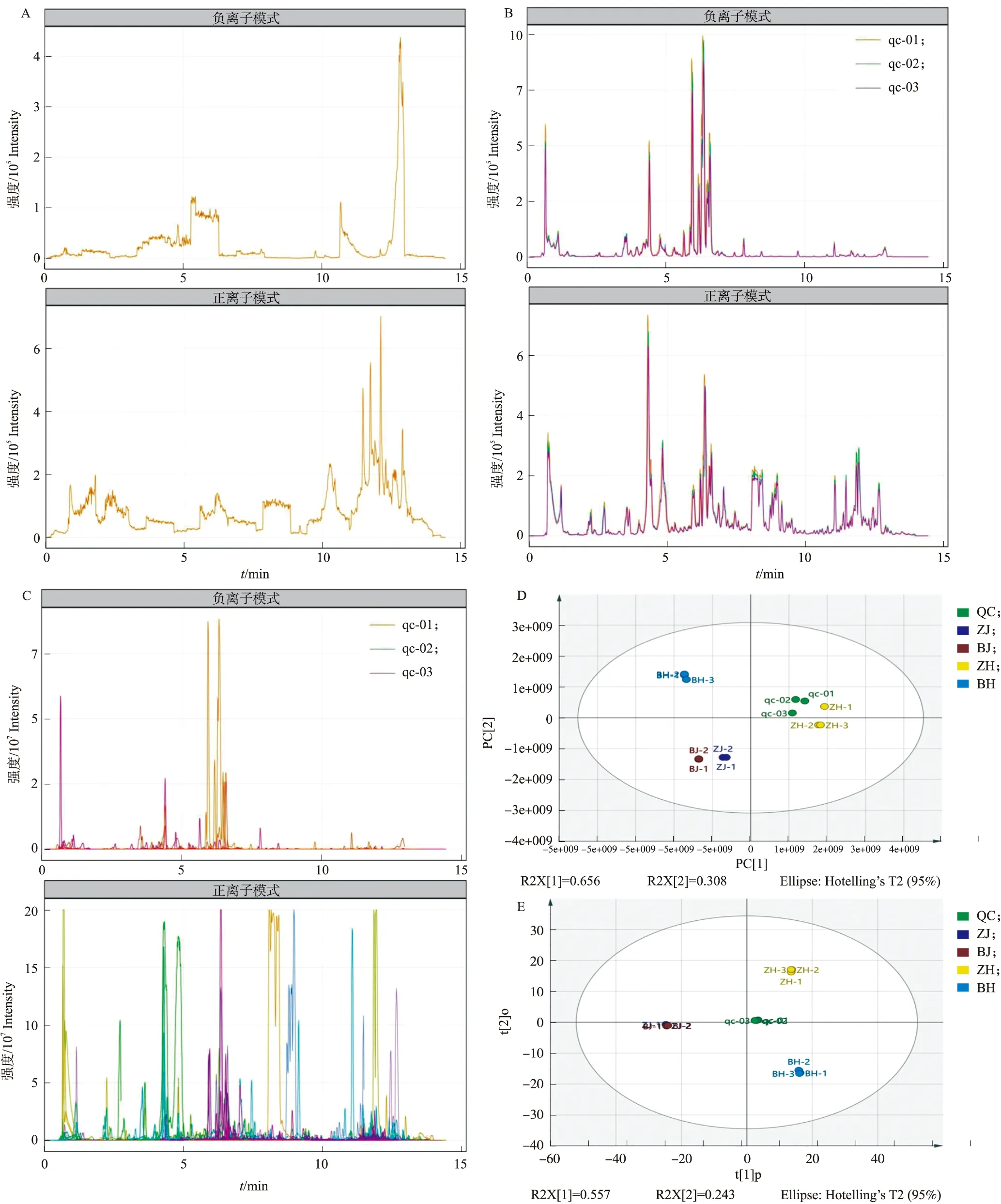
图2 葵花不同组织的总离子流图以及PCA和OPLS-DA得分图Fig.2 Total ion current chromatograms in negative and positive ion model,and PCA and OPLS-DA score plots for the different tissues of ornamental sunflowerA. 空白样品离子流图;B. 质控样品离子流图;C. 观赏葵花不同样品总离子流图;D和E分别表示观赏葵花不同组织PCA和OPLS-DA得分图。A. Ion current chromatograms of the blank control sample;B. Ion current chromatograms of the quality control sample;C. Total ion current chromatograms of the different tissues of ornamental sunflower;D and E show PCA and OPLS-DA scores of different tissues of ornamental sunflower,respectively.QC:质控Quality control;qc-01、qc-02、qc-03代表1个样品进行3次测定qc-01,qc-02,qc-03 represent three determinations of the same sample.
2.2 差异代谢物筛选
以‘盐葵4号’的紫色花和紫色茎组织及‘盐葵5号’的白色花和白色茎组织为材料,进行靶向代谢组分析,共检测到647种代谢物,根据OPLS-DA生成的VIP值以及t测验的P值来筛选组间的差异代谢物(VIP>1,且P<0.05)。紫色花显著高于白色花的代谢物有140种,差异倍数超过5的有23种物质,其中,差异倍数最高的是山奈酚-3-O-戊糖苷,其在紫色花中含量是白色花中的3 499倍(表2)。紫色花显著低于白色花的代谢物有224种,其中,差异倍数最高的是尿囊酸,其在白色花中尿囊酸含量是紫色花中的42 670倍。紫色茎显著高于白色茎的代谢物有48种,其中,差异倍数最高的是5-苯基-1-戊醇,其在紫色茎中含量是白色茎中的454倍。紫色茎显著低于白色茎的代谢物有104种,其中,差异倍数最高的是尿囊酸,其在白色茎中尿囊酸含量是紫色茎中的6 218倍。2组样品的差异物质在紫色茎和紫色花中同时上调的共有17种物质(表3),在紫色茎和紫色花中同时下调的共有47种物质。本研究重点关注紫色花形成的物质代谢机制,所以对紫色花特异差异物质进行了进一步分析,结果表明,在紫色花中特异上调的物质共有123种,紫茎中特异上调的物质只有31种。

表2 紫色花(ZH)中代谢物含量高于白色花(BH)的种类Table 2 Metabolite species with higher content in purple flowers(ZH)than in white flowers(BH)

表3 紫色花(ZH)和紫色茎(ZJ)中代谢物含量同时上调的种类Table 3 Significantly up-regulated metabolite species in purple flower(ZH)and purple stem(ZJ)

续表3 Table 3 continued
2.3 差异代谢物的代谢通路分析
将筛选出的差异代谢物映射到KEGG通路上,并标记在KEGG通路图上。分析结果显示,ZH_vs_BH差异物质共映射到112条代谢通路,ZJ_vs_BJ差异物质共映射到74条通路。对ZH_vs_BH上调物质进行富集分析,富集程度最显著的途径为丙氨酸、天冬氨酸和谷氨酸代谢途径,苯丙酸类化合物合成途径,中心碳代谢,花青素合成等途径(图3-a);ZJ_vs_BJ上调物质富集最显著的途径为花青素合成途径、嘌呤代谢途径、玉米素合成等途径(图3-b)。将紫色茎和紫色花中同时上调的17种物质进行富集分析,结果显示富集程度最显著的途径为花青素合成途径、恰加斯病途径以及苯丙酸类化合物合成途径(图3-c)。
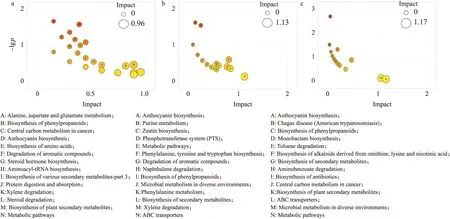
图3 差异代谢物通路聚类分析Fig.3 Cluster analysis of differential metabolite pathwaya. ZH_vs_BH 上调差异代谢物通路分析;b. ZJ_vs_BJ 上调差异代谢物通路分析;c. ZH_vs_BH 和ZJ_vs_BJ共同上调差异代谢物通路分析。a. Cluster analysis of up-regulated differential metabolite pathway for group ZH_vs_BH;b. Cluster analysis of up-regulated differential metabolite pathway for group ZJ_vs_BJ;c. Cluster analysis of common up-regulated differential metabolite pathway for group ZH_vs_BH and ZJ_vs_BJ.
本研究主要是分析紫色花向日葵形成的相关代谢物质,而已有研究表明,紫色花形成的主要花色素是花青素[6],所以重点对花青素合成途径进行分析。在本研究中,差异代谢物中参与花青素合成途径的有矢车菊素(cyanidin)、矢车菊素-3-O-葡萄糖苷(cyanidin 3-glucoside)和飞燕草素-3-O-3′,6″-O-二甲酰葡萄糖苷(delphinidin 3-O-3′,6″-O-dimalonylglucoside);本研究还分析了参与其他颜色呈色的黄酮和黄酮醇生物合成途径中的物质,其中参与其他黄酮和黄酮醇生物合成途径且存在差异的物质共有5种,分别是槲皮素(quercetin)、黄芪碱(astragalin)、异槲皮素(isoquercitrin)、杨梅素(myricetin)以及芦丁(rutin),这 5种物质在紫花中的含量相比白花显著下降(表4)。
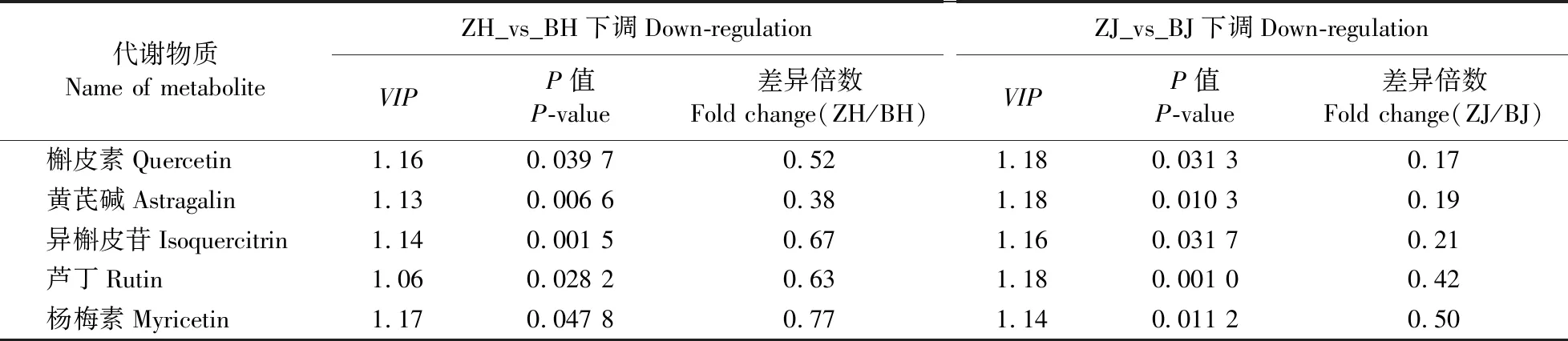
表4 黄酮和黄酮醇生物合成途径中下调代谢物质Table 4 Down-regulated metabolites in the flavone and flavonol biosynthesis
将以上相关物质对应到黄酮类物质以及花青素合成代谢通路中,结果表明部分黄酮类物质的合成下调,花青素类物质合成上调可能是紫花花色形成的主要物质基础(图 4)。
3 讨论
广泛靶向代谢组学是结合非靶向代谢组学和靶向代谢组学的优点,该方法基于广泛靶向代谢组数据库,利用多反应监测(multiple reaction monitoring,MRM)模型,定性、定量检测样本中代谢物含量,具有高效、高灵敏、高覆盖的特点[13-14]。因此,利用广泛靶向代谢组学对植物中花色素相关代谢产物进行鉴定与分析,可以深入解析植物不同花色形成的物质基础。
本研究中,不同颜色花组织中差异代谢物数量显著多于不同颜色的茎组织,但是紫色组织共同上调的代谢物只有17种,这可能存在以下几方面原因:1)不同植物组织之间代谢物含量存在较大差异。本研究的花组织样品包括颜色存在显著差异的管状花、雌蕊以及萼片的顶端,是3个不同部位的混合样品;而茎只是不同颜色的单一组织。2)不同品种间存在差异。连续多年种植结果表明‘盐葵4号’在长势、抗病性方面显著优于‘盐葵5号’,但熟性显著晚于‘盐葵5号’。尿囊酸是植物氮素主要利用和储存形态[21]。本研究结果显示尿囊素含量在2个品种中存在极显著差异,这表明,‘盐葵5号’的氮素吸收效率要高于‘盐葵4号’,在生长过程中植物体内物质的代谢速度显著高于‘盐葵4号’。3)花部组织颜色较茎部组织的颜色深,花部组织和茎部组织中与颜色相关代谢物质的数量和含量存在较大差异。在比较不同差异代谢物在花和茎组织中的差异倍数时,大部分差异代谢物在不同颜色的花组织中差异倍数都显著高于不同颜色的茎组织,这表明不同颜色花组织在颜色形成过程中参与的代谢物质数量及峰度都显著高于茎部组织,这从矢车菊素在花部组织差异倍数显著高于茎部组织这一结果得到验证。
类黄酮是控制花色的主要色素之一,其中花青苷是类黄酮的重要组成成分[8]。矢车菊素是花青苷中的主要成员,是花色素中呈现紫色的主要色素之一,而白色花呈色的主要色素则为“黄酮类或/和其他苷”[5]。在本研究中,紫色花和紫色茎中矢车菊素含量显著高于白色花和白色茎中的含量,而且紫色较深的‘盐葵4号’花组织矢车菊素含量显著高于颜色较浅的茎部组织,而紫色花和紫色茎中部分黄酮类物质含量显著低于白色花和白色茎中的含量。该结果暗示‘盐葵4号’紫色组织呈色过程中,花青素合成途径扮演关键角色,矢车菊素是‘盐葵4号’紫色组织呈色的主要物质。山奈酚及山奈酚衍生物属于类黄酮类物质,在植物不同组织的颜色形成过程中具有重要作用。乔雨等[22]以不同颜色的蒙农红豆草为材料,对不同颜色花瓣色素种类及含量进行综合分析,结果表明芦丁、山奈酚-3-芸香苷-5-鼠李糖苷和山奈酚-3-p-香豆酰葡萄糖苷为影响蒙农红豆草花色变化的主要成分。钟培星等[23]以开花不同时间段花色存在显著变化的野生芍药为材料,定性定量分析其花色素组分,共监测到47种类黄酮成分,其中有12种山奈酚衍生物。在本研究中,检测到3种山奈酚类差异代谢物,分别是山奈酚-3-O-戊糖苷(kaempferol-3-O-pentoside)、山奈酚-3-O-阿拉伯吡喃糖苷(kaempferol-3-O-arabinopyranoside)、山奈酚-7-O-葡萄糖苷(kaempferol-7-O-glucoside)。这3种山奈酚类代谢物含量在不同颜色的组织中差异非常大,表明山奈酚类物质可能在‘盐葵4号’紫色组织形成过程中扮演重要角色,但是,目前山奈酚衍生物参与植物组织颜色形成还没有详细和确切的报道,因此进一步分析山奈酚衍生物在参与植物组织颜色形成过程中的作用将是本研究今后的重点工作。
本研究通过代谢组学解析观赏葵花不同组织呈色的代谢物组成差异,但是并没有分析差异代谢物的遗传机制。在下一步研究中,将结合转录组分析,进一步分析代谢物组成差异及花色形成的分子基础,为通过分子手段改良植物花色提供理论支持。
