假体周围感染三种样本处理病原体检测效能比较
2021-05-23葛无非张贤祚
葛无非,张贤祚,朱 晨
(安徽医科大学附属安徽省立医院,安徽合肥230722)
人工关节置换术已成为关节终末期疾病治疗的主流手段[1]。然而,人工关节置换术后假体周围感染(periprosthetic joint infection,PJI)是这一手术面临的重大挑战,也给社会经济和患者家庭带来巨大的负担[2]。PJI的诊断有赖于致病微生物的检测和识别,通常采取关节液培养等方法进行致病微生物的检测。然而,临床实践发现常规方法的PJI总体检出率较低,在高达30%的病例中产生了假阴性结果[3]。研究发现,一方面PJI的致病微生物谱与骨骼肌肉常见感染相异,另一方面预防和治疗性的使用抗生素降低了致病微生物的检出率,但部分微生物仍通过形成生物膜依附在人工关节表面,造成长期慢性感染,给PJI的诊断和治疗造成困难[4,5]。目前,已有研究采用新的技术手段提高PJI诊断的效能(如高通量测序、病原微生物芯片等),但致病微生物培养仍然是PJI诊断的金标准,同时进一步的药物敏感试验仍然是指导后续抗生素治疗必不可少的环节[6]。研究显示,破坏微生物生物膜释放内藏其中的微生物是提高PJI致病微生物检出率的有效方法。基于前期经验,本院自2018年以来对人工关节PJI患者的致病微生物检测培养手段进行了改进。本研究回顾分析了既往送检标本的病例资料,事实证明这一方法有效提高了致病微生物的检出效能,现报道如下。
1 资料与方法
1.1 纳入与排除标准
纳入标准:(1)诊断为人工髋(膝)关节置换术后感染;(2)诊断为人工髋(膝)关节置换术后假体松动;(3)诊断为人工关节置换术后疼痛的住院病例;(4)初次手术和翻修手术均在本院实施。
排除标准:(1)保留假体清创的病例;(2)合并全身或其他组织感染性病变的病例;(3)不是下述三种方法送检标本培养的病例;(4)标本超过6 h未送检或有明确污染可能的病例。
1.2 一般资料
2018年12月~2020年1月,共有254例患者因各种原因进行了人工髋膝关节翻修手术,按照纳入和排除标准,共有231例符合上述标准纳入本研究。患者均采用3种方法进行了样本的处理和培养,包括关节液、组织匀浆和超声震荡液。其中男94例,女137例,平均年龄(63.96±11.08)岁;行髋关节翻修154例、膝关节77例;158例患者接受了一期翻修治疗,73例患者接受了二期翻修治疗。根据MSIS指南,87例确定为PJI患者,144例确定为非感染性原因的翻修。本研究经本院伦理委员会审批,所有患者均知情同意。
1.3 标本采集与处理
所有标本均采自深部组织,采集工作均在术中完成。所有标本均在6 h内经微生物实验室进行处理。
关节液:将关节液收集在无菌离心管中,经旋涡混匀、沉淀重悬等步骤后,分别接种于血琼脂平板、麦康凯琼脂平板、巧克力琼脂平板和罗氏培养基,在35℃、5% CO2环境中培养14 d。另取血琼脂平板接种,置于厌氧袋中,35℃环境中培养14 d。将0.1 ml液体接种于沙保弱琼脂平板,35℃环境中培养7 d。取余液进行革兰氏染色和抗酸染色。如果平板/培养基无微生物生长,革兰氏染色和抗酸染色均无微生物形态,则最终结果记录为阴性。使用VITEK MS全自动快速微生物质谱检测系统(法国梅里埃)和VI⁃TEK-2 COMPACT全自动微生物鉴定及药敏分析系统(法国梅里埃)进行细菌菌种鉴定和抗生素药敏试验。
组织匀浆:手术刀切取炎性改变最明显的假体周围组织进行微生物培养。将组织剪碎,与5颗不锈钢研磨珠一起放入无菌研磨管中,并加入1 ml硫乙醇酸盐肉汤浸没标本。用组织匀浆机(武汉塞维尔)以(60±5)kHz频率匀浆处理120 s(中间间歇10 s)。参照关节液培养的方法,将获得的组织匀浆接种到培养基和平板上并进行结果的判定。微生物鉴定和抗生素药敏试验方法同前述。
超声震荡液:拆除的假体(包括金属、聚乙烯和骨水泥部件)放置在无菌、宽口且气密性良好的容器中,参照 Trampuz[7]和 Rothenberg[8]介绍的方法进行超声震荡处理。在容器中加入林格液,并进行涡旋(涡旋仪GL-88B,海口其林贝尔)及超声震荡(CQ-200B-DST;上海跃进医用光学器材厂)。涡旋30 s后立即超声震荡。震荡频率为(28±2)kHz,持续10 min。静置容器1 min,以便气溶胶沉降,随后再次涡旋30 s。将处理后的超声震荡液用移液器转移至无菌离心管中。3 500 r/min离心10 min后弃去试管中上清液,加入生理盐水定容至10 ml,将试管旋涡混匀,使沉淀重悬。同法再次离心浓缩定容至2 ml,重悬沉淀并接种至培养基或平板上,余液进行革兰染色和抗酸染色。微生物鉴定和抗生素药敏试验标准同关节液培养。
1.4 评价指标
采用美国骨骼肌肉感染学会(Musculoskeletal In⁃fection Society,MSIS)2018年更新的PJI诊断标准对回溯病例再次进行诊断,满足任意主要条件或次要条件评分≥6分的可以确诊感染[9]。采用病原体检出率作为评价培养方法的指标,并计算每种方法的敏感性、特异性、阳性预测值和阴性预测值。分别计算使用抗生素组和未使用抗生素组的检出指标,判断抗生素使用对不同方法的诊断效能影响。
1.5 统计学方法
采用SPSS 20.0统计学分析软件进行统计分析,非PJI组与PJI组基线特征比较使用t检验或卡方检验。同一培养方法在抗生素组和非抗生素组对比及同一组内不同方法对比采用Pearson卡方检验。P<0.05为差异有统计学意义。
2 结果
2.1 是否PJI两组患者的比较
是否PJI两组患者一般资料与比较见表1。两组患者在年龄和性别构成的差异无统计学意义(P>0.05),PJI组的膝关节比例显著高于非PJI组(P<0.05),PJI组一期翻修率显著低于非PJI组(P<0.05)。PJI组的术前抗生素使用率高于非PJI组(P<0.05)。
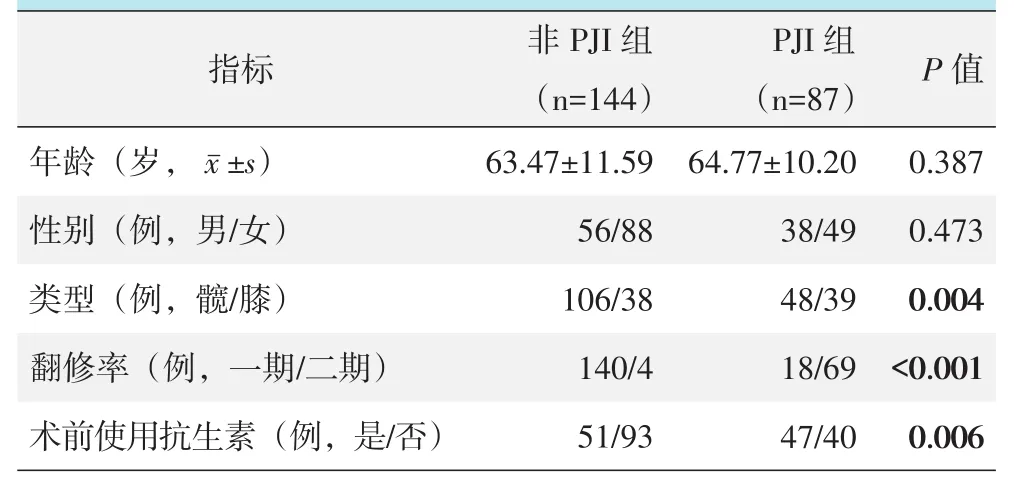
表1 两组患者一般资料与比较
2.2 三种样本处理方法的检出效能比较
231例患者中,关节液共检出微生物33例,匀浆和超声震荡液分别检出64例和83例。应用MSIS标准对PJI进行回顾性诊断和判定,本组病例中共有87例PJI患者。三种样本处理的检出效能见表2,检出敏感性由高至低依次为:超声震荡液>组织匀浆>关节液,三者间差异有统计学意义(P<0.05),但三者间的特异性、阳性预测值和阴性预测值的差异均无统计学意义(P>0.05)。
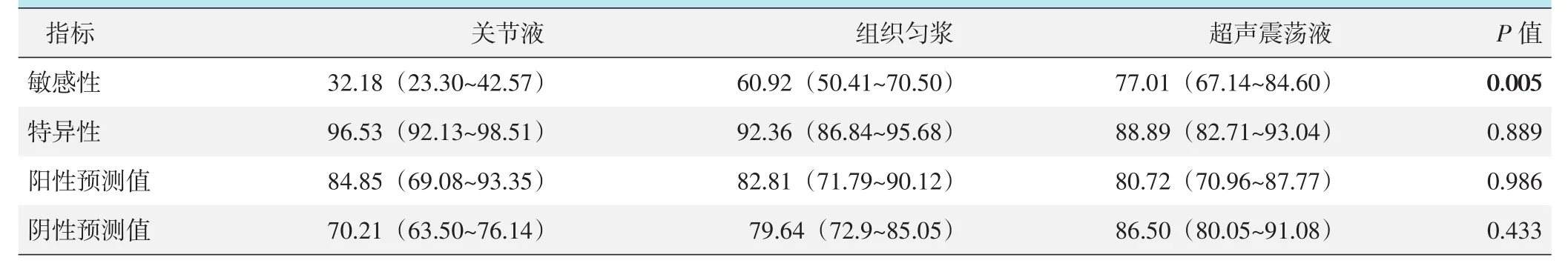
表2 87例PJI患者三种样本处理检出效能与比较[%(95%CI)]
2.3 抗生素对检出率的影响
87例PJI患者中,47例患者在标本采集前的2周内使用了抗生素,40例患者未使用抗生素。使用抗生素组的关节液和组织匀浆的检出敏感性较未使用抗生素组显著降低(P<0.05),但是否使用抗生素对超声震荡液的检出敏感性无显著影响(P>0.05);使用抗生素组的关节液、组织匀浆和超声震荡液的特异性均较未使用抗生素组显著降低(P<0.05);使用抗生素组的关节液和组织匀浆的阳性预测值较未使用抗生素组显著降低(P<0.05),但是否使用抗生素对超声震荡液的阳性预测值无显著影响(P>0.05)。使用抗生素组的关节液和超声震荡液的阴性预测值显著降低(P<0.05),但是否使用抗生素对组织匀浆阴性预测值无显著影响(P>0.05)。使用抗生素三种培养方法的敏感性由高至低依次为:超声震荡液>组织匀浆>关节液,三者间差异有统计学意义(P<0.05);未使用抗生素三种培养方法的敏感性差异无统计学意义(P>0.05),是否使用抗生素三种培养方法间的特异性、阳性预测值、阴性预测值差异均无统计学意义(P>0.05)。
2.4 细菌鉴定结果
本研究所有送检标本共检出148株微生物,其中检出量较多的有:金黄色葡萄球菌(57株)、表皮葡萄球菌(44株)、其他凝固酶阴性葡萄球菌(13株)。在使用抗生素和未使用抗生素的病例中,检出的微生物谱相似:检出最多的微生物及占比分别为金黄色葡萄球菌(38.36% vs 38.67%,P=0.432)、表皮葡萄球菌(30.14% vs 29.33%,P=0.331)、其他凝固酶阴性葡萄球菌(9.59% vs 8.00%,P=0.141)。三种取材方法培养获得的主要微生物谱亦未见明显差别。关节液组、匀浆组和超声组检出的主要微生物占比依次为:金黄色葡萄球菌(42.86% vs 41.51% vs 34.33%,P=0.094);表皮葡萄球菌(32.14% vs 30.19% vs 28.36%,P=0.107);其他凝固酶阴性葡萄球菌(10.71% vs 9.43% vs 7.46%,P=0.078)。相比较于关节液组培养较为单一的微生物谱,匀浆组和超声组检出少量少见致病微生物和混合微生物感染,如匀浆组和超声组分别各检出3例白色念珠菌感染、1例和2例绿脓杆菌感染;超声组还检出1例恶臭假单胞菌和3例表皮葡萄球菌+粪肠球菌的混合感染。
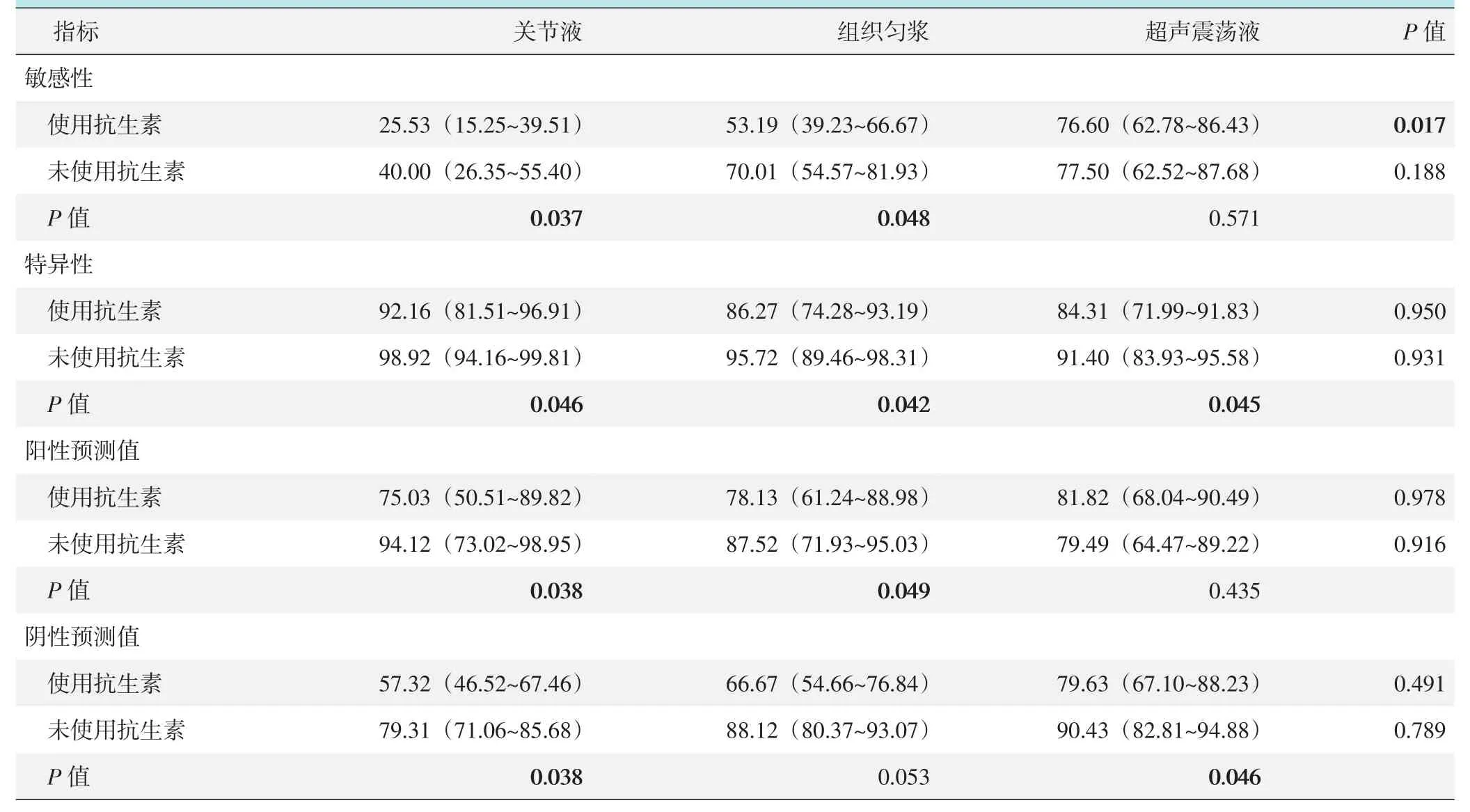
表3 使用抗生素对不同培养方法诊断PJI的影响[%(95%CI)]
3 讨论
本研究回顾性分析了本院近年来进行下肢关节置换翻修中病原体培养的三种不同方法,发现组织匀浆法和超声震荡法均能够有效提高PJI致病微生物的检出能力。在本研究所纳入的病例中,有87例患者最终被诊断为PJI,占总病例数的37.66%,这与文献所报道的翻修原因大致符合。
研究发现,匀浆组和超声组均能提高感染诊断的敏感性。在特异性上,三种方法均显示出了较好的特异性。考虑到术前使用抗生素的原因,将数据进行分层分析,发现在使用抗生素的病例中,关节液组、匀浆组的敏感性低于未使用抗生素的病例(25.53% vs 40.00%;53.19% vs 70.01%);而超声组的检验敏感性未见明显下降(76.60% vs 77.50%),这可能是因为应用抗生素抑制了微生物生长,使其进入生物膜对抗外界压力,导致在关节液中较难培养出活体微生物的缘故。因此,在术前使用抗生素的病例,采取超声震荡法更具有优势。
导致PJI的致病微生物多种多样,充分了解致病微生物,并相应地选择合适的培养基有助于培养出存在的病原体。本研究中培养出的致病微生物谱与文献报道的相一致[10,11]。作者推荐采用血琼脂平板、麦康凯琼脂平板、巧克力琼脂平板和罗氏培养基的混合培养基系统,能够最大程度确保多种可能潜在的致病微生物获得生长。Shen等[12]建议采用Bactec血培养瓶对关节液进行培养,可以提高某一种或几种微生物的培养鉴定敏感性。在本研究中,使用抗生素与否并未显著影响检出致病微生物的菌谱。使用组织匀浆法和超声震荡法检出了少量少见微生物种类,超声震荡法还检出了混合感染的样本。但这一现象需要谨慎解读,排除标本污染等情况的干扰。
本研究仍然具有一定的局限性:(1)本研究为回顾性研究,对于资料的收集、干预过程中的干扰因素控制难以做到完全一致;(2)由于样本量的限制,一些数据统计难以表现出显著性差异;(3)PJI的致病因素不仅仅限于某种或某几种微生物,能否应用统一的培养方法分离和鉴别所有的感染因素尚无定论。
随着新的分子标志物和生物靶标的出现,以及测序技术的兴起和普及,PJI的诊断有了新的工具和手段[13]。但无论如何,有效的培养方法是鉴定PJI和正确地分离致病微生物必不可少的一环。假体周围组织匀浆培养和假体超声震荡液培养对于临床鉴定病原微生物能够产生有效帮助。包含更多处理条件、综合各种术前指标的个性化培养方法具有广阔的前景,其后续研究对临床工作具有重大意义。
