不同蛋白源饲料中添加限制性氨基酸对红鲫Carassius auratus 生长、消化及免疫能力的影响
2021-05-22石立冬卫力博翟浩杰牟玉双侯仁爽任同军韩雨哲
石立冬,卫力博,翟浩杰,牟玉双,侯仁爽,任同军,韩雨哲,2
(1.大连海洋大学水产与生命学院,辽宁 大连 116023;2.大连海洋大学,辽宁省北方鱼类应用生物学与增养殖重点实验室,辽宁 大连 116023)
肉粉蛋白质含量高,碳水化合物含量低,维生素和矿物质丰富[1],水产动物饲料中常见的蛋白源,但消化率低、质量不稳定,制约了其在水产饲料中的发展[2];玉米蛋白粉为常见的植物性蛋白源之一,其蛋氨酸和赖氨酸含量较低[3-5],同样存在肉粉的限制性因素。通常认为,蛋氨酸和赖氨酸是第一、二限制性氨基酸;饲料中缺乏必需氨基酸时,大西洋鲑Salmo salar[6]、尖吻鲈Lates calcarifer[7]和凡纳滨对虾Penaeus vannamei[8]的摄食量和生长性能降低,罗非鱼Oreochromis niloticus[9]、淡水鲶Mystus nemurus[10]的饲料效率降低,蛋白质沉积率降低。Gaylord 等[11]及黎慧等[12]研究表明,补充限制性氨基酸可提高蛋白源利用率。限制性氨基酸在水产动物的肠道发育、消化代谢、免疫能力和抗氧化能力等方面具有一定的调节作用[13-16]。红鲫Carassius auratus 属鲤科鲤亚科鲫属,以繁殖速度快、繁殖能力强、肉质鲜美、营养丰富而著名,是我国重要的淡水养殖经济种类,具有较高的经济价值。目前,在水产养殖研究中针对肉粉和玉米蛋白粉替代鱼粉的研究常见报道,但对肉粉和玉米蛋白粉两种蛋白源的作用效果比较却鲜有报道。本实验以肉粉和玉米蛋白粉为主要的蛋白源,添加蛋氨酸和赖氨酸两种限制性氨基酸,配制成不同蛋白源和限制性氨基酸饲料,旨在探讨肉粉和玉米蛋白粉蛋白源饲料以及限制性氨基酸对红鲫的作用,并为促进肉粉和玉米蛋白粉在红鲫饲料中的应用开发及进一步降低饲料成本提供理论参考。
1 材料与方法
1.1 材料
225 尾实验鱼购自大连市香炉礁,在200 L 聚乙烯水槽中暂养1 周。暂养期间饲喂对照组饲料,待实验鱼适应养殖环境后开始实验。
实验饲料配方、饲料蛋氨酸、赖氨酸含量实测值及红鲫实际需求量[17]见表1(饲料中肉粉和玉米蛋白粉的比例设计依据目前养殖生产中红鲫常用饲料配比),对照组饲喂MM组饲料,饲料中肉粉比例为7%,实验组饲料分为3 种,CGM组用玉米蛋白粉完全替代肉粉,饲料中玉米蛋白粉比例为8%,MM+CAA 组和CGM+CAA 组分别在MM 组和CGM组中添加0.1%的晶体蛋氨酸和赖氨酸(由宜兴市天石饲料有限公司提供)。饲料原料过80 目筛,逐级混匀,混合后的粉状饲料经制粒机制成直径为2 mm的颗粒饲料,然后放入烘箱(DK-S26,上海森信实验仪器有限公司)中42℃烘干至水分含量为10%,于-20℃冰箱中保存。
1.2 实验设计和管理
实验鱼驯养7 d 后,选取大小一致、活力较好,初始体质量为(3.37±0.03)g 的红鲫180 尾,随机分为4 组,每组设3 个重复,每个重复15 尾鱼,以曝气24 h 以上的自来水作为实验用水,采用气石24 h充气,每日8:00 和16:00 投喂两次,表观饱食,每日吸底1 次、换水1 次,换水量约为1/2,实验期间水温为(23±1)℃,溶氧为(5±0.5)mg/L,pH 为(7.3±0.5),养殖周期为56 d。
1.3 样品采集及指标测定方法
取样前,实验鱼停食24 h,放入冰水中,用浓度为100 mg/L 的MS-222 进行麻醉处理,称重测量体长,计算其生长指标;称重后,于冰上进行无菌解剖,每个重复15 尾鱼全部取肝脏、肠道及背部肌肉,同组混样装入样品管。肌肉样品于-80℃冰箱中保存,用于测定肌肉中蛋氨酸(methionine,Met)、赖氨酸(lysine,Lys)、总必需氨基酸(total indispensable amino acid,∑IDAA)和总氨基酸(total amino acid,∑AA)含量;肠道和肝脏样品分别注入质量体积比为1∶9 的生理盐水,经4℃、4000 r/min、10 min 高速离心后,取上清液,4℃保存,用于测定肠道脂肪酶(lipase,LPS)、淀粉酶(amylase,AMS)、蛋白酶(protease,PRO)和肝脏酸性磷酸酶(acid phosphatase,ACP)、碱性磷酸酶(alkaline phosphatase,AKP)、过氧化氢酶(catalase from micrococcus lysodeikticu,CAT)和总超氧化物歧化酶(superoxide dismutase,SOD)活力及丙二醛(malondialdehyde,MDA)含量,上述酶活指标均利用南京建成生物工程研究所试剂盒进行测定。
实验饲料和肌肉样品氨基酸测定前处理参考国标法(GB 5009.124 2016),使用全自动氨基酸分析仪(L-8900 型,日立制作所)测得。
1.4 计算公式与数据处理
特定生长率(specific growth rates,SGR,%/d)=100×(ln 终末体质量-ln 初始体质量)/饲养天数;增重率(weight gain rate,WGR,%)=100×(平均终末体质量-平均初始体质量)/平均初始体质量;饲料系数(food conversion ratio,FCR)=平均饲料摄入量/(终末平均体质量-初始平均体质量);肥满度(condition factor,CF)=100×终末体质量×体长-3;摄食率(food intake,FI,%)=100×摄入饲料干重/[饲养天数×(初始体质量+终末体质量)/2]。

表1 实验饲料组成及营养水平(风干基础)Tab.1 Ingredients and nutrient levels of experimental diets(air-dry basis)/%
实验数据用平均值±标准误(mean±standard error,SE)表示,用SPSS 17.0 软件(IBM,USA)进行双因素方差分析(two-way ANOVA)分析。当蛋白源和晶体氨基酸之间存在显著交互作用时,再对所有数据进行一次单因素方差分析(one-way ANOVA),并采用Duncan’s 进行多重比较来分析各处理组间的显著性,设置P<0.05 为差异显著。
2 结果与分析
2.1 饲料蛋白源和两种限制性氨基酸对红鲫生长性能的影响
饲料蛋白源和氨基酸对红鲫的SGR、WGR、CF和FCR 存在显著交互作用(P<0.05)。MM组与CGM组相比,WGR、CF 显著提高(P<0.05),FCR 显著下降(P<0.05);MM+CAA 组与MM组相比,SGR、WGR、CF 显著提高(P<0.05);CGM+CAA 组与CGM 组相比,FCR 显著下降(P<0.05),但SGR、WGR 和CF 无显著变化(P>0.05);且MM+CAA 组的SGR、WGR、CF 显著高于其余各组(P<0.05)组,MM组FCR 最低,但MM+CAA 组与MM 组无显著差异(P>0.05)(表2)。
2.2 饲料蛋白源和两种限制性氨基酸对红鲫肌肉Met、Lys、∑IDAA 和∑AA 的影响
饲料蛋白源和氨基酸对红鲫肌肉Met 和Lys 含量存在显著交互作用(P<0.05),但对∑IDAA 和∑AA 无显著交互作用(P>0.05)。MM组与CGM组相比,肌肉Met 和Lys 含量显著升高(P<0.05);MM+CAA组与MM 组相比,肌肉Met 和Lys 含量显著升高(P<0.05);CGM+CAA 组与CGM组相比,肌肉Met、Lys 含量显著升高(P<0.05);且肌肉Met 和Lys 含量在MM+CAA 组显著高于其余各组(P<0.05)(表3)。
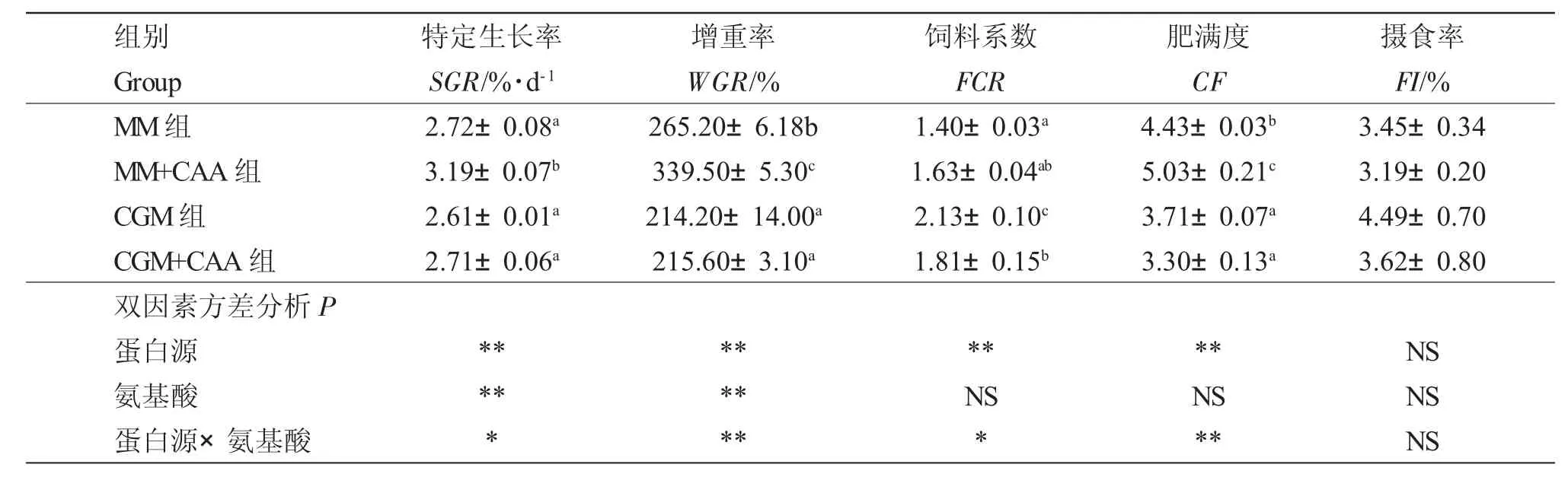
表2 饲料蛋白源和两种限制性氨基酸对红鲫生长性能的影响Tab.2 Effect of feed protein source and two kinds of limited amino acids on growth performance of red crucian carp Carassius auratus
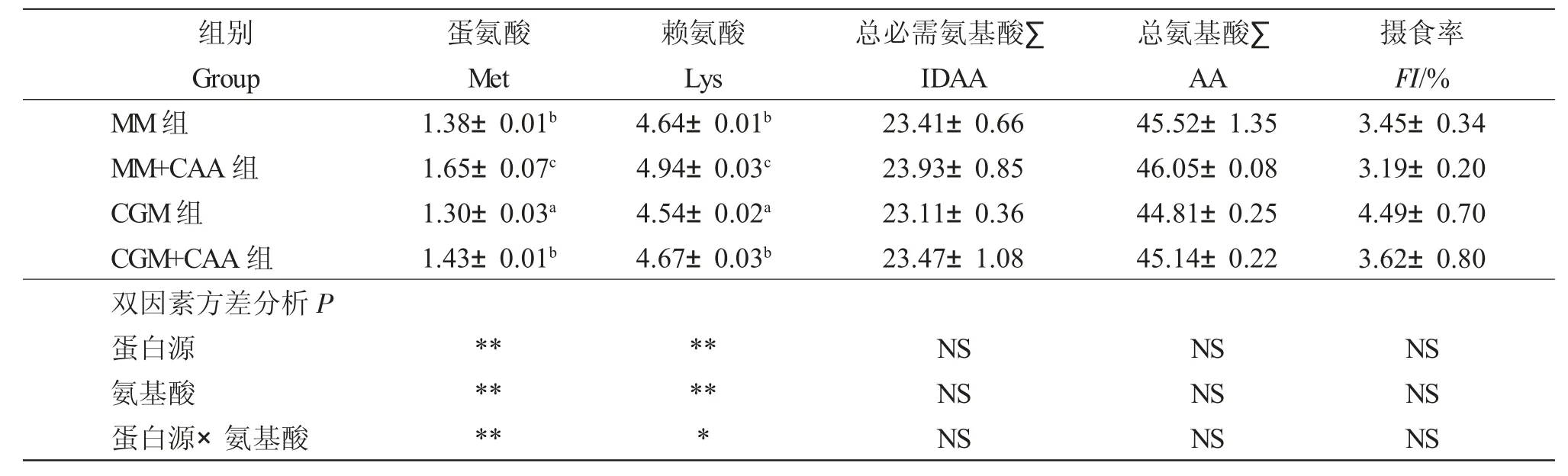
表3 饲料蛋白源和两种限制性氨基酸对红鲫肌肉Met、Lys、∑IDAA 和∑AA 的影响Tab.3 Effect of feed protein source and two kinds of limited amino acids on Met,Lys,∑IDAA,and ∑AA contents in muscle of red crucian carp Carassius auratus
2.3 饲料蛋白源和两种限制性氨基酸对红鲫肠道消化能力的影响
由表4 可知,饲料蛋白源和氨基酸对LPS 和PRO 活力的交互作用显著(P<0.05),但对AMS 活力无显著交互作用(P>0.05);MM+CAA 组与MM 组相比,LPS 和PRO 活力显著提高(P<0.05);CGM+CAA组与CGM 组相比,LPS 和PRO 活力显著提高(P<0.05);且LPS 和PRO 活力均在MM+CAA 组显著高于其余各组(P<0.05)。
2.4 饲料蛋白源和两种限制性氨基酸对红鲫肝脏免疫能力的影响
饲料蛋白源和氨基酸对红鲫的ACP、AKP、CAT、SOD 活力和MDA 含量有显著交互作用(P<0.05)。MM组与CGM组相比,ACP、CAT 和SOD活力显著提高(P<0.05),MDA 含量显著下降(P<0.05),AKP 活力无显著变化(P>0.05);MM+CAA 组与MM组相比,ACP、AKP、CAT 和SOD 活力显著提高(P<0.05),MDA 含量显著下降(P<0.05);CGM+CAA 组与CGM 组相比,ACP、AKP、CAT 和SOD 活力显著提高(P<0.05),MDA 含量无显著变化(P>0.05);MM+CAA 组的ACP、AKP、CAT 和SOD 活力显著高于其余各组(P<0.05),MM+CAA 组中MDA含量显著低于其余各组(P<0.05)(表5)。
3 讨论
3.1 饲料蛋白源和两种限制性氨基酸对红鲫生长性能的影响
通常认为,赖氨酸和蛋氨酸是鱼类的第一和第二限制性氨基酸,对维持生物正常的生长发育具有重要作用[18-21]。已有研究表明,饲料中添加Met 可以不同程度地提高草鱼Ctenopharyngodon idella[22]、南亚野鲮Labeo rohit H.[23]、细鳞巨脂鲤Piaractus mesopotamicus[24]和松浦镜鲤Cyprinus carpio L.[25]的增重率、特定生长率及蛋白质效率;可以提高虹鳟Oncorhynchus mykiss[26]、斑点叉尾鮰Ictalurus punc-tatus[27]和建鲤Cyprinus carpio var.Jian[28]的相关生长基因的表达量。与此类似,饲料中添加Lys,可以提高勃氏雅罗鱼Leuciscus brandti[29]和团头鲂Megalobrama amblycephala[30]的生长性能。特定生长率、增重率和肥满度等指标通常是鱼类营养学研究中用来评价鱼类机体生长速率和体质量增长幅度的指标,饲料系数(FCR)等指标通常是用来评价饲料利用率的指标[31,32]。本研究结果表明,肉粉蛋白源饲料与玉米蛋白粉蛋白源饲料相比,显著提高了红鲫的WGR 和SGR,显著降低了FCR,说明在未添加限制性氨基酸时,肉粉蛋白源饲料更有利于红鲫生长;添加限制性氨基酸后,肉粉蛋白源饲料添加组与未添加组相比,红鲫生长指标得到了显著改善,而玉米蛋白粉蛋白源饲料添加组与未添加组相比,红鲫的生长指标没有显著变化,说明肉粉蛋白源饲料中限制性氨基酸的添加促进了红鲫的生长,但玉米蛋白粉蛋白源饲料与限制性氨基酸之间可能存在某种拮抗机制,导致限制性氨基酸并未发挥促进作用,但目前对于这种拮抗机制的具体作用方式尚不明确,仍有待进一步研究。肉粉蛋白源饲料中添加限制性氨基酸后,红鲫的SGR、WGR 和CF 与其余各组相比显著提高,FCR 显著低于玉米蛋白粉蛋白源无添加组,说明肉粉蛋白源饲料中添加0.1%的两种限制性氨基酸更适合红鲫的生长需求。
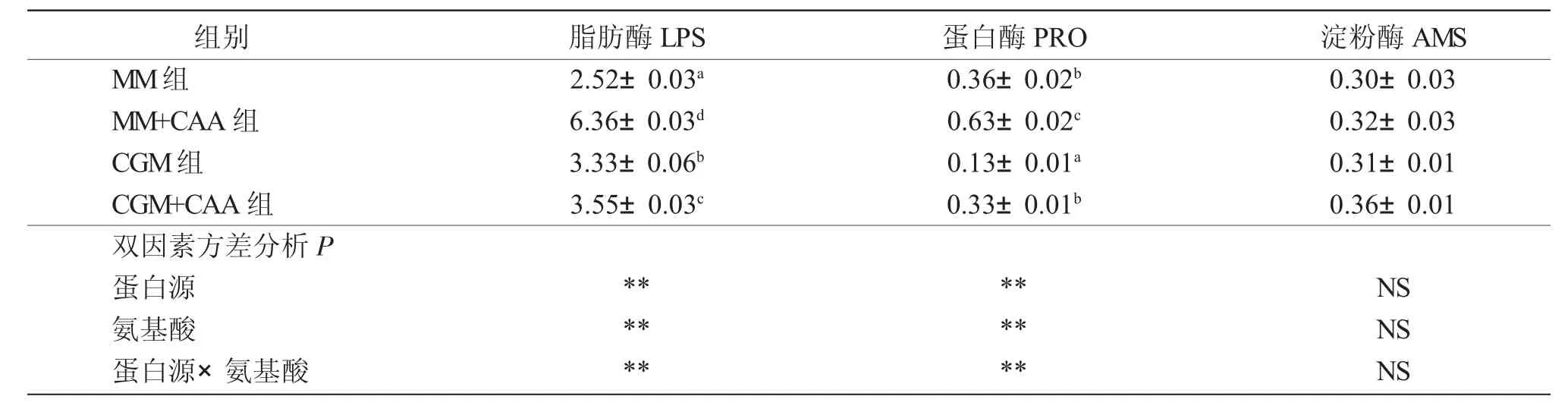
表4 饲料蛋白源和两种限制性氨基酸对红鲫肠道消化能力的影响Tab.4 Effect of feed protein source and two kinds of limited amino acids on intestinal digestive capacity of red crucian carp Carassius auratus /U·mg prot-1
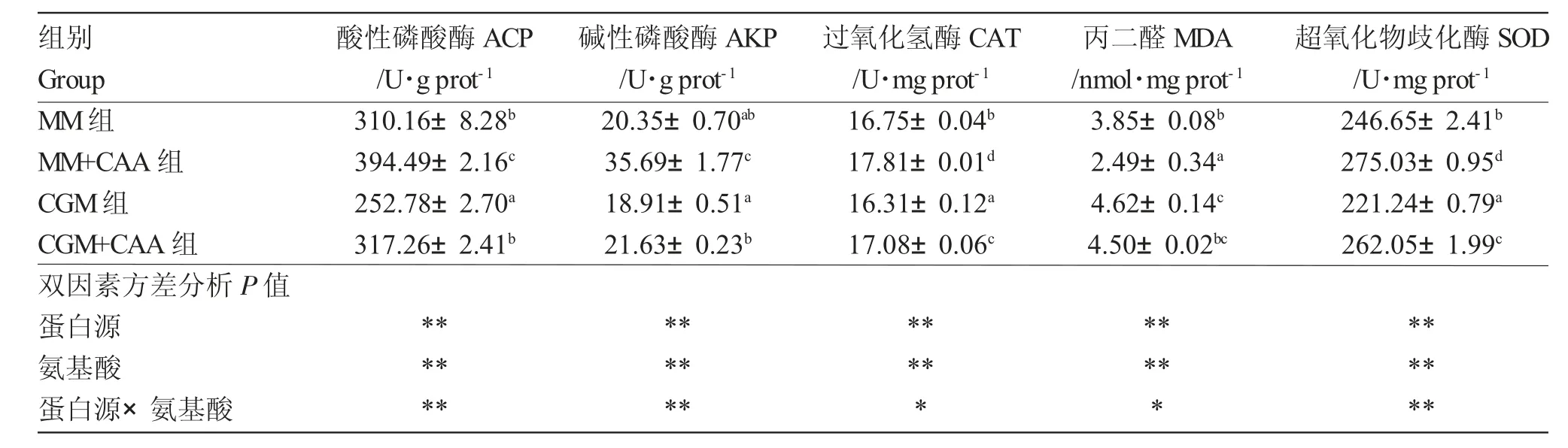
表5 饲料蛋白源和两种限制性氨基酸对红鲫免疫能力的影响Tab.5 Effect of feed protein source and two limited amino acids on liver Immunity of red crucian carp Carassius auratus
3.2 饲料蛋白源和两种限制性氨基酸对红鲫肌肉Met、Lys、∑IDAA 和∑AA 的影响
饲料中氨基酸含量与鱼类肌肉氨基酸含量密切相关。研究表明,饲料中缺乏蛋氨酸时,黑鲷Sparus macrocephalus[33]、大黄鱼Pseudosciaena crocea[34]和胭脂鱼Myxocyprinus asiaticus[35]肌肉中的总必需氨基酸含量降低,且随着饲料中蛋氨酸浓度增加,肌肉中蛋氨酸的含量也升高,说明日粮中蛋氨酸缺乏会降低组织中蛋氨酸的含量[34];随着饲料中赖氨酸含量的升高,黑鲷[36]、黄颡鱼Pelteobagrus fulvidraco[21]和军曹鱼Rachycentron canadum 幼鱼[37]肌肉赖氨酸和蛋氨酸含量升高,说明饲料中蛋氨酸、赖氨酸含量与鱼体肌肉组织中蛋氨酸、赖氨酸和含量存在一定的正相关。本研究中,肉粉蛋白源饲料与玉米蛋白粉蛋白源饲料相比,显著提高了肌肉Met 和Lys含量,说明肉粉蛋白源饲料对改善红鲫肌肉蛋氨酸和赖氨酸组成的效果更显著;在不同蛋白源饲料中添加0.1%的两种限制性氨基酸后,与未添加限制性氨基酸组相比,红鲫肌肉Met 和Lys 含量显著提高,与上述研究结果相符,说明饲料中蛋氨酸和赖氨酸含量的升高可以导致肌肉蛋氨酸和赖氨酸含量的升高,且在本实验条件下,肉粉蛋白源饲料中添加限制性氨基酸后,红鲫肌肉的Met 和Lys 含量显著高于其余各组,说明在肉粉蛋白源饲料中添加限制性氨基酸改善红鲫肌肉蛋氨酸和赖氨酸含量的效果显著优于其余各组饲料。
3.3 饲料蛋白源和两种限制性氨基酸对红鲫肠道消化能力的影响
肠道是动物消化吸收的主要场所,鱼类主要依靠肠道中的消化酶进行化学性消化,因此,肠道消化酶活性在一定程度上可以反映鱼类对饲料原料和营养成分的消化吸收能力[38]。鄢华[39]在探究赖氨酸缺乏对幼建鲤Cyprinus carpiovar Jian 的影响中发现,赖氨酸缺乏可极显著降低蛋白酶活性,但对淀粉酶活性的影响不显著;彭艳等[40]在蛋氨酸对幼建鲤的生长影响的研究中发现,适量的蛋氨酸可以显著提高蛋白酶的活性;帅柯[41]研究表明,饲料蛋氨酸水平对脂肪酶和蛋白酶活力存在显著影响,适量的蛋氨酸水平可以显著提高脂肪酶和蛋白酶的活性。本实验条件下,在不同蛋白源饲料中添加0.1%的两种限制性氨基酸,红鲫肠道的LPS 和PRO 活性显著提高,说明在肉粉蛋白源和玉米蛋白粉蛋白源饲料中添加限制性氨基酸能够改善红鲫肠道的消化能力,且添加限制性氨基酸后,LPS 和PRO 活性在肉粉蛋白源饲料组显著高于其余各组,说明肉粉蛋白源饲料中添加限制性氨基酸后对肠道消化酶活力的改善效果显著优于其余各组饲料。这些消化酶活性的显著提高可以相对解释肉粉蛋白源饲料中添加0.1%两种限制性氨基酸条件下的高生长性能。
3.4 饲料蛋白源和两种限制性氨基酸对红鲫肝脏免疫能力的影响
鲤科鱼类的免疫系统包括非特异性免疫和特异性免疫系统[42]。Salinas 等[43]认为,鱼类等低等脊椎动物机体的防御主要靠非特异性免疫系统,因此,ACP、AKP 等重要的非特异性免疫因子[44-46]的活性在一定程度上可以反映机体的免疫能力。孙崇岩等[47]和帅柯[41]发现,在饲料中添加适量的晶体蛋氨酸可以显著提高建鲤的特异性和非特异性免疫能力。Ruchimat 等[48]发现,随着饲料中赖氨酸含量的增加,黄尾鰤Seriola lalandi 的免疫能力也呈现增强的趋势。本实验中,未添加限制性氨基酸时,肉粉蛋白源饲料与玉米蛋白粉蛋白源饲料相比显著提高了红鲫肝脏ACP 活力,在不同蛋白源饲料中添加0.1%的两种限制性氨基酸,红鲫肝脏的ACP 和AKP 活力均显著提高,且添加限制性氨基酸后,肉粉蛋白源饲料对肝脏ACP、AKP 活力的改善效果显著优于其余各组饲料。
SOD 和CAT 是生物防御体系中的关键酶[49]。SOD 为清除体内自由基的活性氧清除剂,对增强整个机体的抗氧化能力具有重要作用[50]。CAT 与SOD具有协同作用,可以清除机体内产生的超氧阴离子(O2-)和H2O2等自由基[51]。MDA 为机体内脂肪过氧化的终产物,其含量可以反映机体中脂肪过氧化程度及集体损伤程度[52]。研究表明,蛋氨酸可显著降低鲈Lateolabrax japonicus 肝脏中的脂质过氧化水平和GSH 含量[53,54]。廖英杰[55]发现,团头鲂血清超氧化物歧化酶活力与饲料中赖氨酸的含量呈正相关;本实验条件下,未添加限制性氨基酸时,肉粉蛋白源饲料与玉米蛋白粉蛋白源饲料相比显著提高了红鲫肝脏CAT 和SOD 活力,显著降低了肝脏MDA 含量,在不同蛋白源饲料中添加0.1%的两种限制性氨基酸,红鲫肝脏的CAT 和SOD 活力均显著提高,且添加限制性氨基酸后,肉粉蛋白源饲料组红鲫肝脏CAT 和SOD 活力显著高于其余各组饲料,肝脏MDA 含量显著低于其余各组。综上所述,肉粉蛋白源和玉米蛋白粉蛋白源饲料中添加两种限制性氨基酸可以在一定程度上提高鱼类的肝脏免疫能力,改善抗氧化能力,其改善效果以肉粉蛋白源饲料添加限制性氨基酸更显著。
3.5 结论
本实验中,在以肉粉为主要蛋白源的饲料中添加蛋氨酸和赖氨酸两种限制性氨基酸后,红鲫的特定生长率、增重率、肥满度、饲料系数,肌肉蛋氨酸、赖氨酸含量,肠道消化酶活力,肝脏免疫酶活力及抗氧化酶活力均显著提高,且蛋白源和氨基酸对上述指标存在一定的交互作用,但其交互作用机制尚不明确。综上所述,初始体质量为(3.37±0.03)g 红鲫的饲料中,以肉粉为主要蛋白源时添加赖氨酸和蛋氨酸可以显著改善其生长、消化、免疫、抗氧化性能及肌肉中蛋氨酸、赖氨酸含量,提高饲料利用率,降低成本。
