磁共振弥散加权成像在宫颈癌放化疗疗效早期评估中的应用价值
2021-05-21陈志深范娇娇王琢欧健王艳梅赵康康王蕴龙申延男赵继红孙宝胜
陈志深 范娇娇 王琢 欧健 王艳梅 赵康康 王蕴龙 申延男 赵继红 孙宝胜
(吉林省肿瘤医院 1放疗四科,吉林 长春 130021;2放疗二科;3放疗研究室;4吉林大学公共卫生学院放射生物实验室;5吉林省肿瘤医院放射线科)
宫颈癌好发于中老年女性,常见症状包括阴道不规则出血、下腹痛及腰骶部疼痛等。磁共振成像(MRI)具有较高的软组织分辨率,在宫颈癌的诊断和分期等方面具有很高的敏感性和特异性,显著优于CT和超声等检查。磁共振弥散加权成像(DWI)是唯一通过检测活体水分子微观运动进而成像的影像学方法,可提供形态学以外的功能生物学信息,从而对常规MRI的不足起到弥补作用〔1〕。近年,DWI在盆腔疾病诊断中的作用逐渐得到肯定。放化疗是宫颈癌有效的治疗手段,而个体放化疗敏感性的差异与治疗后的疗效存在一定关系。如果能早期预测治疗疗效,及时调整治疗方案并提供个体化的治疗,将会取得最大的临床获益。本研究观察DWI影像学技术在宫颈癌治疗早期预测放化疗疗效的临床应用价值。
1 材料与方法
1.1一般材料 回顾性分析2018年6月至2019年12月吉林省肿瘤医院88例宫颈癌患者,中位年龄55(39~81)岁;鳞癌78例(88.64%),腺癌10例(11.36%);放化疗前临床分期ⅠB期2例(2.27%),ⅡA期4例(4.55%),ⅡB期48例(54.55%),ⅢB期34例(38.64%)。其中完全缓解(CR)者70例,部分缓解(PR)者18例。纳入标准:①经临床诊断的宫颈癌患者且计划行同步放化疗治疗者;②在同步放化疗前1 w内、腔内近距离放疗前及放化疗结束后1个月进行MRI检查者。排除标准:①治疗中断者;②图像伪影较大者;③MRI禁忌证者(体内有心脏起搏器、金属植入物及幽闭恐惧症等)。
1.2方法 患者均进行根治性同步放化疗+腔内近距离放疗。外照射放疗采取调强/适型放疗,5次/w,全盆腔总剂量45~50 Gy/25~28次,1.8~2.0 Gy/次,在外照射放疗后期,所有患者进行CT引导的高剂量率腔内近距离放疗,2次/w,腔内近距离放疗剂量达到28~36 Gy/4~6次,6.0~7.0 Gy/次,放疗期间每周进行铂类单药同步化疗。采用3.0T磁共振扫描仪进行检查,患者于扫描前适度充盈膀胱,采取仰卧位体位进行扫描,扫描范围从腰4椎体水平至耻骨联合下缘。由2名具有丰富工作经验的放射科医师独立阅片并测量肿瘤组织表观扩散系数(ADC)值,通过轴位T2WI图像和DWI观察病变的范围及大小,避开病变边缘、血管和囊变坏死区,选取肿瘤最大层面,手动勾画兴趣区(ROI)。记录放化疗前、腔内近距离放疗前及放化疗结束后1个月的肿瘤ADC值。计算治疗前后ADC值的变化率,ADC变化率=(治疗后ADC值-治疗前ADC值)/治疗前ADC值×100%。
1.3治疗疗效评估 评估患者放化疗疗效依据于世界卫生组织(WHO)制定的实体瘤疗效评估标准(RECIST)1.1,分为CR(肿瘤病灶完全消失,无新病灶出现)、PR(肿瘤病灶最大直径减小≥30%,至少维持4 w)、疾病稳定(SD,肿瘤病灶最大直径减小<30%或肿瘤病灶最大直径增大<20%)、疾病进展(PD,肿瘤病灶最大直径增大≥20%)。
1.4统计学方法 采用SPSS21.0软件进行秩和检验、独立样本t检验。
2 结 果
2.1治疗过程中肿瘤ADC值比较 入组患者放化疗前肿瘤ADC平均值为0.837×10-3mm2/s,腔内近距离放疗前肿瘤ADC平均值为1.328×10-3mm2/s,放化疗结束后1个月肿瘤ADC平均值为1.498×10-3mm2/s,两两比较具有统计学差异(H=210.11,P<0.001)。
2.2治疗过程中两组肿瘤ADC值比较 CR组、PR组放化疗前、腔内近距离放疗前、放化疗结束后1个月肿瘤ADC平均值组内两两比较具有统计学差异(P<0.001)。CR组放化疗前肿瘤ADC平均值显著低于PR组(P=0.009),腔内近距离放疗前肿瘤ADC平均值显著高于PR组(P=0.020),而放化疗结束后1个月肿瘤ADC平均值显高于PR组,但差异无统计学意义(P=0.063)。见表1。CR组放化疗前和腔内近距离放疗前肿瘤ADC平均值值变化率平均值(63.57%)显著高于PR组(41.50%)(t=7.173,P=0.008);CR组放化疗前和放化疗结束后1个月ADC值变化率平均值(84.97%)显著高于PR组(60.70%)(t=5.370,P=0.022)。

表1 两组各检查节点肿瘤ADC平均值比较(×10-3mm2/s)
2.3ADC值变化率在预测宫颈癌放化疗疗效的效能和应用价值 受试者工作特征(ROC)曲线分析结果显示放化疗前和腔内近距离放疗前ADC值变化率界值为48.15%时,预测CR的敏感度为88.6%,特异性为88.9%,ROC曲线下面积(AUC)为0.949。见图1。
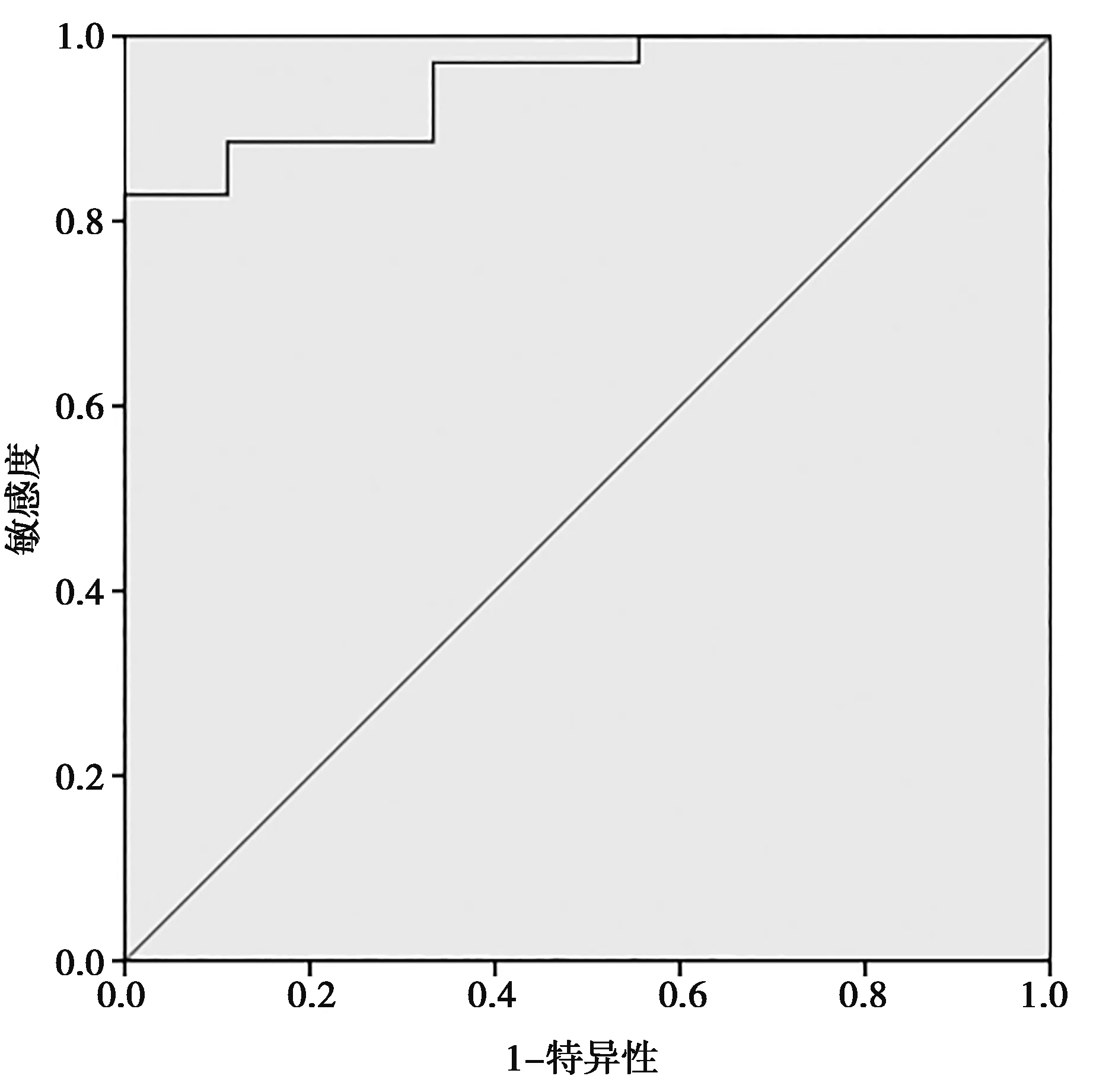
图1 两组放化疗前和腔内近距离放疗前ADC值变化率ROC曲线
3 讨 论
放化疗作为局部晚期宫颈癌首选的治疗方法被广泛应用于临床。临床上主要通过妇科检查来判断肿块的位置、形态、大小,评价宫颈癌放化疗后的疗效,影像学检查主要依靠MRI进一步评价宫颈癌放化疗的疗效。宫颈癌放化疗疗效存在一定个体性差异,因此在放化疗早期对宫颈癌敏感性进行预测,具有十分重要的临床意义。DWI可弥补常规MRI的不足。组织ADC用于描述 DWI 中不同方向分子扩散运动的速度和范围,该量化指标在区分良恶性病变及判断治疗效果上具有重要意义。本研究重点观察宫颈癌放化疗后早期及治疗过程中肿瘤ADC值变化情况,并通过该量化指标判断放化疗敏感性,针对不同的敏感性制定个体化的治疗方案。
有研究表明,宫颈癌组织比正常宫颈组织具有较低的ADC值。郭润财等〔2〕测得宫颈癌病灶平均ADC值为(0.827 1±0.148 6)×10-3mm2/s,正常宫颈内膜平均ADC值为(1.526 4±0.068 7)×10-3mm2/s,宫颈癌病灶ADC值明显低于正常宫颈内膜ADC值,Park等〔3〕所测的宫颈癌组织平均ADC值为(0.89±0.10)×10-3mm2/s,陈小莉等〔4〕所测得宫颈癌组织平均ADC值为0.869×10-3mm2/s。本研究所测得治疗前宫颈癌组织平均ADC值与上述研究结果相似。
治疗过程中肿瘤ADC值存在一定变化,如Park等〔3〕所测的宫颈癌治疗前、治疗开始后4 w及治疗结束后1个月ADC值分别为(0.89 ± 0.10)×10-3、(1.36 ± 0.19)×10-3和(1.57± 0.24)×10-3mm2/s。Liu等〔5〕所测的宫颈癌CR组治疗前、治疗开始后1个月及治疗开始后2个月ADC值分别为(0.810 ± 0.015)×10-3、(1.379 ± 0.132)×10-3及(1.507± 0.132)×10-3mm2/s,PR组治疗前、治疗开始后1个月及治疗开始后2个月ADC值分别为(0.863 ± 0.088)×10-3、(1.283 ± 0.141×10)-3及(1.425± 0.140)×10-3mm2/s。李建生等〔6〕测得的同步放化疗前、外照射治疗结束时、后装内照射治疗3次时及同步放化疗治疗结束时宫颈癌组织ADC值分别为(0.86 ±0.04)×10-3、(1.14±0.09)×10-3、(1.30±0.10)×10-3、(1.37±0.09)×10-3mm2/s,且呈上升趋势。本研究病灶均达到CR或PR,且治疗后ADC值较治疗前均有不同程度提高。因患者接受治疗后,导致大量肿瘤细胞出现坏死,降低了细胞密度,增大细胞外间隙,进而增加水分子扩散速度,使ADC值明显升高,表明病灶对治疗较为敏感,预示具有较好的治疗效果。但治疗后ADC值存在一定差异,可能与放疗分割方式、化疗药物应用及测量时间节点不同有关。
既往一些研究证实治疗前低ADC值患者比高ADC值患者显示出更好的治疗效果〔7~9〕。本研究发现,治疗之前CR组ADC值显著低于PR组,可能与肿瘤细胞坏死有关。肿瘤细胞坏死后细胞膜破裂,出现水分子自由扩散加强,导致ADC值升高,而肿瘤细胞坏死与乏氧、低灌注有关,这些因素常导致肿瘤细胞对放化疗等治疗敏感性降低〔10〕。本文发现部分病例即使是低ADC值,但其治疗效果仍不理想,这可能与这部分病例虽然存在肿瘤细胞坏死,但没有发生液化,从而导致ADC值不高,因此单纯根据治疗前肿瘤ADC值预测治疗效果存在不确切性。
因肿瘤细胞存在异质性,提示不能应用单一指标进行临床疗效评估。基于既往研究和上述假设,本文说明ADC值变化率与治疗效果具有相关性,与既往研究结果一致〔4〕。由此可见,可利用ADC值变化率评价宫颈癌放化疗疗效的特异性和敏感性。Liu等〔5〕通过分析33例宫颈癌患者治疗过程中ADC值变化情况发现,ADC值变化率界值为35.4%时,预测CR的敏感性为100%,特异性为73.1%。可看出通过ADC值变化率预测治疗效果及判断治疗敏感性均有较高的效能,但仍存在一定差异,可能与入组病例数、分析时间节点及治疗方式不同有关,有待大型前瞻性实验进一步验证。本研究为单中心研究且样本量相对较小,需扩大样本量进一步研究;部分患者MRI检查前进行了病理活检,尚难以预测活检对ADC值可能造成的影响;本研究尚缺乏长期随访数据,可继续随访,通过ADC值对放化疗后纤维化与病灶残留进行鉴别诊断及预测复发等。
综上,DWI定量参数及其变化率可在治疗前预测及在治疗过程中动态评估宫颈癌放化疗效果。
