孟鲁司特钠联合喜炎平注射液治疗小儿呼吸道合胞病毒感染的应用研究
2021-05-21闫树学邢玲玲马晓花
闫树学, 邢玲玲,马晓花,张 环
呼吸道合胞病毒是一种RNA病毒,经空气飞沫、密切接触传播,多发生于新生儿及6月龄以下婴儿,潜伏期为3~7 d[1-2]。既往研究表明,婴幼儿呼吸道合胞病毒感染症状较重,可伴有高热、鼻炎及咽炎等,严重者将会表现为细支气管炎、肺炎[3]。临床研究表明,呼吸道合胞病毒是引起小儿病毒性肺炎常见的病原体,能引起间质性肺炎、毛细支气管炎,是婴幼儿呼吸道感染死亡的重要原因[4-5]。因此,加强呼吸道合胞病毒感染患儿治疗有助于挽救其生命,降低临床病死率。孟鲁司特钠能抑制支气管平滑肌细胞的复制与增生,阻断白三烯受体的合成或阻断白三烯受体与其受体的结合,有助于控制气道内炎性反应,从而能减轻、消除气道黏液对呼吸道黏膜的刺激,有助于改善患儿预后[6]。喜炎平注射液属于临床常用的中成药物,具有清热解毒、抗菌消炎功能,有助于促进机体免疫功能,增强肾上腺皮质功能,提高中性粒细胞、巨噬细胞吞噬能力。同时,该药物能增加溶酶菌含量,降低、杀灭流感病毒活性,并抑制多种细菌[7-8]。本研究以我院小儿呼吸道合胞病毒感染者为研究对象,探讨孟鲁司特钠联合喜炎平注射液在治疗小儿呼吸道合胞病毒感染中的临床效果,现报道如下。
1 对象与方法
1.1 对象 收集2017年3月—2020年5月东营市东营区人民医院收治的小儿呼吸道合胞病毒感染者122例为研究对象。纳入标准:①符合《儿科学(第8版)》[9]中呼吸道合胞病毒感染诊断标准;②呼吸道合胞病毒抗原检测呈阳性,均无孟鲁司特钠/喜炎平注射液药物过敏史;③患儿家属知情同意并能够完成随访。排除标准:①合并先天性心脏病者;②具有支气管哮喘史或近期使用其他药物治疗者。本研究经我院伦理委员会审批同意。
采用随机数字表法将122例患儿随机分为对照组和观察组,每组61例。对照组年龄6个月~3岁,平均(1.32±0.51)岁,病程2~7 d,平均(3.79±0.73) d;观察组年龄5个月~4岁,平均(1.39±0.54)岁,病程1~8 d,平均(3.83±0.74) d。2组一般资料比较,差异均无统计学意义(P均>0.05),具有可比性,详见表1。
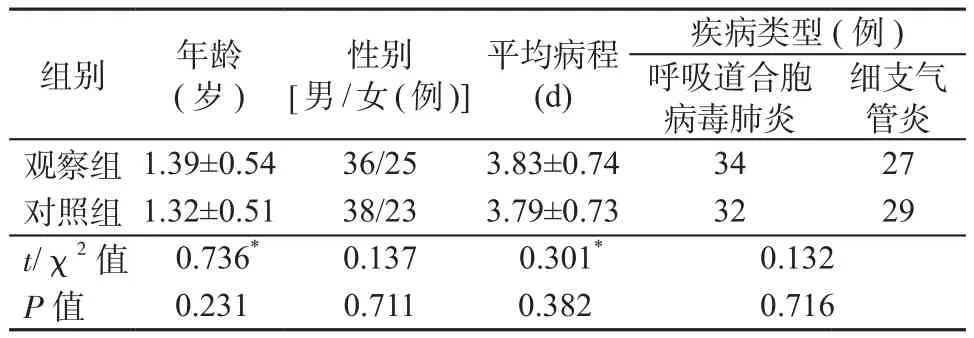
表1 2组一般资料比较Table 1 Comparison of general data between 2 groups
1.2 方法 对照组给予孟鲁司特钠治疗。根据患儿体质量每次取孟鲁司特钠咀嚼片(鲁南贝特制药有限公司,国药准字H20083330,规格5 mg)5~10 mg(体质量<24 kg,1片/次;体质量≥24 kg, 2片/次),1次/d,口服。观察组在对照组基础上联合喜炎平注射液治疗。每次取喜炎平注射液(江西青峰药业有限公司,国药准字Z20026249,规格:每支装2 ml∶50 mg;5 ml∶125 mg;10 ml∶250 mg)5 ~ 10 mg/(kg·d)混合100 ml生理盐水中,1次/d,静脉滴注。另外,2组患儿均予吸氧、吸痰、平喘解痉等对症支持治疗,并雾化吸入布地奈德混悬液[10]。2组患儿均连续治疗2周,2周后评估治疗效果并进行6个月随访[11]。
1.3 观察指标 主要结局:症状消失时间、安全性及复发率。记录2组患儿用药期间呼吸困难、咳嗽、哮鸣音、啰音消失时间及住院时间;记录2组患儿用药过程中恶心呕吐、腹泻便秘、头晕嗜睡发生率;记录2组患儿随访1、3、6个月的复发率。复发:随访期间,出现呼吸道感染症状,经检查符合《儿科学(第8版)》[9]中呼吸道合胞病毒感染诊断标准,呼吸道合胞病毒抗原检测呈阳性。
次要结局:细胞间粘附分子、炎性因子水平。2组分别于治疗前、治疗2周后次日空腹取外周血3 ml,离心后采用电化学发光免疫法测定患儿IL-4、IL-10、IL-2及IFN-γ水平;采用酶联免疫吸附试验测定患儿细胞间粘附分子-1(intercellular adhesion molecule,ICAM-1)水平。
1.4 统计学处理 采用SPSS18.0软件处理数据,计量资料符合正态分布,用±s表示,2组间比较采用成组t检验,治疗前后比较用自身配对t检验。计数资料采用例(%)表示,2组间比较用四格表χ2检验。 P<0.05表示差异有统计学意义。
2 结 果
2.1 症状消失时间比较 观察组用药后呼吸困难、咳嗽、哮鸣音及啰音消失时间,住院时间均短于对照组(P均<0.05),详见表2。
表2 2组症状消失时间比较(±s,d)Table 2 Comparison of symptom disappearance time between 2 groups(±s,d)
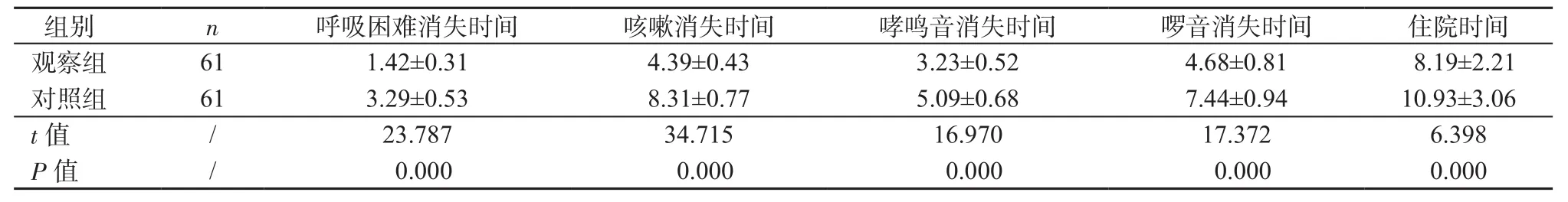
表2 2组症状消失时间比较(±s,d)Table 2 Comparison of symptom disappearance time between 2 groups(±s,d)
组别 n 呼吸困难消失时间 咳嗽消失时间 哮鸣音消失时间 啰音消失时间 住院时间观察组 61 1.42±0.31 4.39±0.43 3.23±0.52 4.68±0.81 8.19±2.21对照组 61 3.29±0.53 8.31±0.77 5.09±0.68 7.44±0.94 10.93±3.06 t值 / 23.787 34.715 16.970 17.372 6.398 P值 / 0.000 0.000 0.000 0.000 0.000
2.2 ICAM-1、炎性因子水平比较 2组患儿治疗前ICAM-1、炎性因子水平之间差异均无统计意义(P均>0.05)。治疗2周后2组患儿ICAM-1、IL-4、IL-10水平均低于治疗前,IL-12及IFN-γ水平均高于治疗前(P均<0.05);观察组ICAM-1、IL-4、IL-10水平下降幅度均低于对照组,IL-12及IFN-γ水平上升幅度均高于对照组(P均<0.05),详见表3~4。
表3 2组治疗前后ICAM-1、炎性因子水平比较(±s)Table 3 Comparison of the levels of ICAM-1 and inflammatory factors before and after treatment between 2 groups(±s)
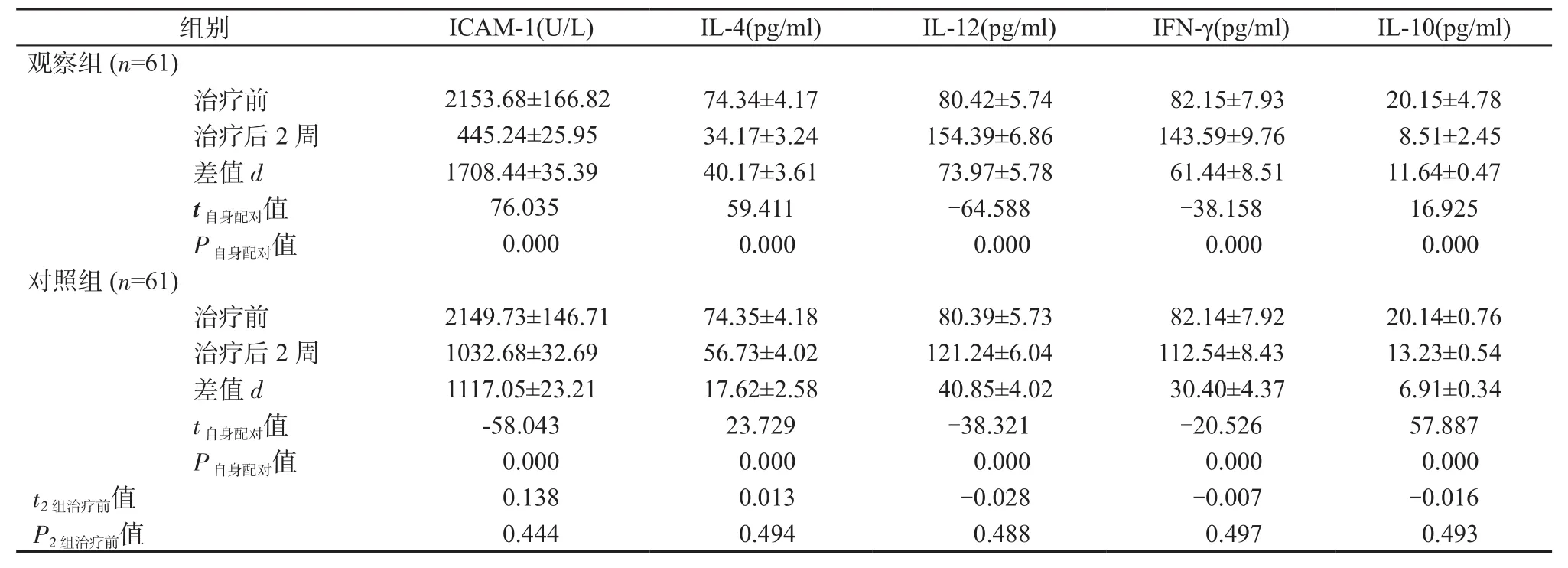
表3 2组治疗前后ICAM-1、炎性因子水平比较(±s)Table 3 Comparison of the levels of ICAM-1 and inflammatory factors before and after treatment between 2 groups(±s)
ICAM-1(U/L) IL-4(pg/ml) IL-12(pg/ml) IFN-γ(pg/ml) IL-10(pg/ml)治疗前 2153.68±166.82 74.34±4.17 80.42±5.74 82.15±7.93 20.15±4.78治疗后 2 周 445.24±25.95 34.17±3.24 154.39±6.86 143.59±9.76 8.51±2.45差值 d 1708.44±35.39 40.17±3.61 73.97±5.78 61.44±8.51 11.64±0.47 t自身配对值 76.035 59.411 -64.588 -38.158 16.925 P自身配对值 0.000 0.000 0.000 0.000 0.000对照组(n=61)治疗前 2149.73±146.71 74.35±4.18 80.39±5.73 82.14±7.92 20.14±0.76治疗后 2 周 1032.68±32.69 56.73±4.02 121.24±6.04 112.54±8.43 13.23±0.54差值 d 1117.05±23.21 17.62±2.58 40.85±4.02 30.40±4.37 6.91±0.34 t自身配对值 -58.043 23.729 -38.321 -20.526 57.887 P自身配对值 0.000 0.000 0.000 0.000 0.000 t2组治疗前值 0.138 0.013 -0.028 -0.007 -0.016 P2组治疗前值 0.444 0.494 0.488 0.497 0.493
表4 2组治疗前后ICAM-1、炎性因子水平差值比较(±s)Table 4 Comparison of differences in levels of ICAM-1 and inflammatory factors between 2 groups before and after treatment(±s)
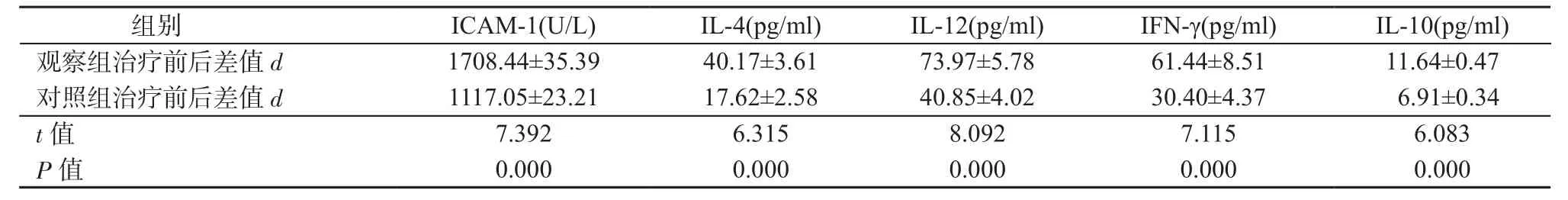
表4 2组治疗前后ICAM-1、炎性因子水平差值比较(±s)Table 4 Comparison of differences in levels of ICAM-1 and inflammatory factors between 2 groups before and after treatment(±s)
组别 ICAM-1(U/L) IL-4(pg/ml) IL-12(pg/ml) IFN-γ(pg/ml) IL-10(pg/ml)观察组治疗前后差值 d 1708.44±35.39 40.17±3.61 73.97±5.78 61.44±8.51 11.64±0.47对照组治疗前后差值 d 1117.05±23.21 17.62±2.58 40.85±4.02 30.40±4.37 6.91±0.34 t值 7.392 6.315 8.092 7.115 6.083 P值 0.000 0.000 0.000 0.000 0.000
2.3 安全性及复发率比较 2组患儿均已完成研究,无失访患儿。2组患儿用药过程中恶心呕吐、腹泻便秘、头晕嗜睡发生率及疗程后1、3个月复发率差异均无统计学意义(P均>0.05);观察组随访6个月复发率低于对照组(P<0.05),详见表5,复发率生存曲线见图1。
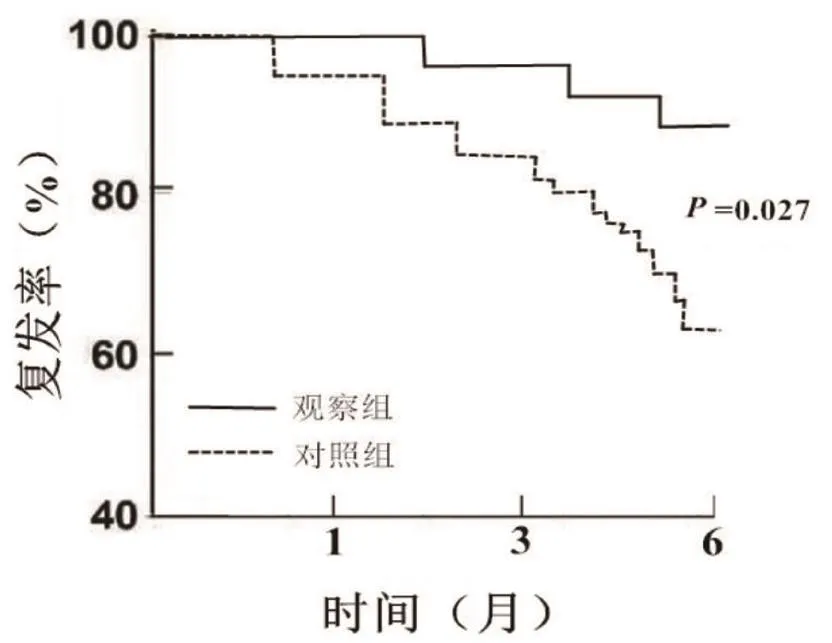
图1 2组复发率比较Figure 1 Comparison of recurrence rates between 2 groups
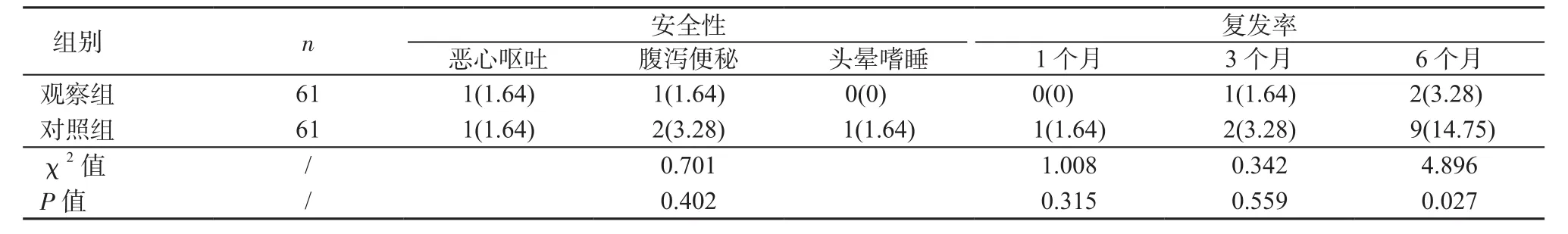
表5 2组安全性及复发率比较[例(%)]Table 5 Comparison of safety and recurrence rate between 2 groups[cases(%)]
3 讨 论
呼吸道合胞病毒感染好发于小儿,一年四季均可发病,且男性发病率略高于女性,临床以咳嗽、喘憋及呼吸困难为主,影响患儿健康生活。近年来,孟鲁司特钠联合喜炎平注射液在治疗小儿呼吸道合胞病毒感染中得到应用,且效果理想[12-13]。本研究中,观察组用药后呼吸困难、咳嗽、哮鸣音、啰音消失时间及住院时间均短于对照组(P均<0.05),提示孟鲁司特钠联合喜炎平注射液能缩短患儿临床症状消失时间,利于患儿恢复。孟鲁司特钠是一种半胱氨酰白三烯受体拮抗剂,是治疗小儿呼吸道合胞病毒感染一线药物,不仅能抑制白三烯对嗜酸粒细胞、单核细胞、中性粒细胞功能的发挥,亦可应用于治疗病毒性毛细支气管炎等急性呼吸道感染疾病[14]。现代药理结果表明:孟鲁司特钠能降低血清白三烯类物质的释放,有助于增强Th1介导的细胞免疫,可抑制Th2过度激活,纠正Th1/Th2失衡[15]。喜炎平注射液属于临床常用的中药注射液,主要由穿心莲内酯磺化物组成,具有清热解毒、止咳平喘功效。现代药理结果表明:喜炎平注射液能提高血清IL水平,增强白细胞作用,发挥杀菌作用,药物安全性较高,能提高患儿治疗耐受性、依从性[16]。本研究中,2组患儿在用药过程中恶心呕吐、腹泻便秘、头晕嗜睡发生率及疗程后1、3个月复发率之间差异均无统计学意义(P均>0.05);观察组疗程后6个月复发率低于对照组(P<0.05),提示孟鲁司特钠联合喜炎平注射液治疗小儿呼吸道合胞病毒感染患儿安全性较高,能降低远期复发率。
ICAM-1是一种穿膜分子,属于蛋白质免疫球蛋白超家族成员,能直接参与重要的生物过程,如:白细胞内皮细胞迁移、细胞信号转导及组织稳定性等。因此,ICAM-1及其可溶性部分在炎性、慢性疾病中呈高表达[17]。既往研究表明,ICAM-1在高血压脑出血患者中呈高表达,其表达水平能反映患者疾病严重程度,可指导临床治疗[18]。国内学者研究表明,Th1/Th2免疫应答失衡在小儿呼吸道合胞病毒感染中发挥关键作用,Th1和Th2细胞相互制约、相互调节,当Th1/Th2失衡则会引起机体免疫功能紊乱,风邪趁虚而入[19]。IFN-γ是Th1细胞的代表性细胞因子,能促进T淋巴细胞分化、成熟,发挥抗菌、抗病毒作用;IL-4、IL-10是Th2细胞代表性细胞因子,能刺激B细胞分泌IgE,抑制IFN-γ的产生,激发呼吸道黏膜肥大细胞脱颗粒,可引起多种炎性递质释放,引起呼吸道损伤。本研究中,观察组治疗2周后ICAM-1、IL-4、IL-10水平下降幅度均低于对照组(P均<0.05);IL-12及IFN-γ水平上升幅度均高于对照组(P均<0.05),提示孟鲁司特钠联合喜炎平注射液能改善机体免疫,减少炎性因子释放,利于患儿恢复。临床上,将孟鲁司特钠联合喜炎平注射液在小儿呼吸道合胞病毒感染治疗中能发挥不同治疗优势,能降低炎性因子水平,从根本上控制疾病发生、发展[20]。
综上所述,孟鲁司特钠联合喜炎平注射液用于治疗小儿呼吸道合胞病毒感染中能缩短症状消失时间,有助于降低ICAM-1及炎性因子水平,药物安全性较高,能降低远期复发率,值得推广应用。但本研究纳入的患儿例数相对较少,研究结果的广泛适应性不够,在后续的研究中,应继续加大样本量,减小误差值,使之更具代表性。
