西多福韦治疗新型冠状病毒肺炎的组学预测分析
2021-05-21张皓旻王毅兴迟小华陈浩然陈熙勐张钧栋李卓阳刘格良卢学春
智 鹏,张皓旻,王毅兴,迟小华,陈浩然,陈熙勐,张钧栋,李卓阳,刘格良,杨 波,叶 芳,卢学春
新型冠状病毒肺炎(coronavirus disease 2019,COVID-19)疫情仍未结束,全球多个国家均出现了确诊和疑似病例[1]。COVID-19患者病情进展快,预后差,病死率高,给患者临床诊疗带来巨大挑战[2]。研究表明,严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)与严重急性呼吸综合征冠状病毒-2(severe acute respiratory syndrome coronavirus-2,SARS-CoV-2)序列高度同源且体内结合位点一致[3]。生物信息学分析与药物预测发现,西多福韦对严重急性呼吸综合征(severe acute respiratory syndrome,SARS)具有潜在治疗作用,且治疗靶点与mTOR、IL-17等信号通路有关[4-5]。据此推测西多福韦对SARS-CoV-2可能具有类似作用。为探明西多福韦治疗COVID-19的潜在分子机制,本研究采用生物信息学方法,筛选关键治疗信号分子及通路进行研究,以期为COVID-19临床治疗药物选择提供指导。
1 资料与方法
1.1 数据筛选与提取 本研究以“cidofovir”为关键词,在基因表达数据库(gene expression omnibus,GEO)中检索,筛选至少包含3个生物学重复且物种为人或小鼠的数据,将西多福韦治疗组设为实验组,未治疗组设为对照组。
1.2 差异表达基因识别 在bioconductor网站(http//:www.bioconductor.org)下载R语言程序,利用 Impute 程序包对已获取的基因表达谱进行归一化处理。利用注释包对数据注释,将探针对应到基因上进行匹配(若多个探针对应一个基因,则取多个探针表达量的平均值作为该基因的表达量)。利用Impute 程序包将基因注释结果与表达量整合,得到2组数据集的基因表达谱,用于后续分析;利用 Limma 程序包,以|logFC|>1,FDR<0.05作为阈值,筛选实验组与对照组的差异表达基因。
1.3 富集分析 采用基因本体论 (gene ontology,GO)和京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)对差异表达基因进行富集分析。采用Fisher确切概率法,以FDR<0.05,P<0.05作为筛选条件,获得差异表达基因GO富集的生物学进程(biological processes,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)和KEGG富集的通路。
1.4 构建蛋白互作网络 使用STRING开源数据库对前述差异表达基因构建蛋白互作(proteinprotein interaction,PPI)网络,以可靠性阈值>0.4作为截断值下载数据,随后将数据导入Cytoscape可视化分析软件,使用CytoHubba 插件对PPI网络中基因节点进行得分计算,以Degree≥6 作为阈值,选取Degree 值前10位基因作为核心基因。
1.5 EpiMed关联分析 利用课题组前期自主研发的临床生物信息学表观精准治疗预测平台(epigenomic precision medicine prediction platform,EpiMed)筛选与西多福韦关联的疾病和药物,关联强度为正值即为正相关,负值即为负相关[6-7]。
2 结 果
2.1 数据选择 共检索到4篇“cidofovir”相关文章[8-11],涉及4组数据,120个样本,最终选择GSE39293数据集中西多福韦作用于原发性人角质化细胞的数据,见表1。

表1 数据基本情况Table 1 Basic information of data
2.2 差异表达基因识别 归一化后数据差异表达基因筛选中,共发现585 个差异表达基因,其中上调差异表达基因494个,下调差异表达基因91个,见图1。
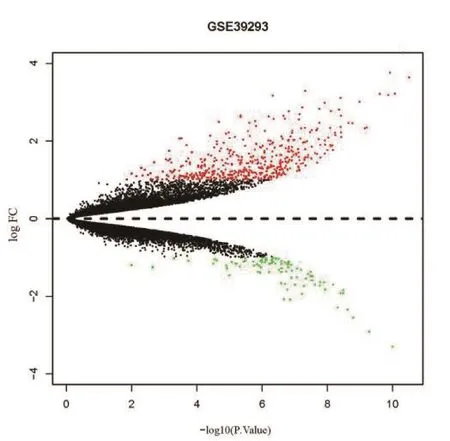
图1 差异表达基因分析红色为上调差异表达基因,绿色为下调差异表达基因,黑色为未达到筛选阈值的基因Figure 1 Analysis of differentially expressed genes
2.3 富集分析
2.3.1 GO 富集分析 GO 富集分析结果显示,富集BP 42条,CC 11条,MF 0条。相关基因有IFIT3、OAS1、ISG15、IFIT1、IFIT2、Mx2 等。BP方面主要富集条目为干扰病毒复制、I型干扰素作用、免疫调节等;CC方面主要富集条目为核小体组装、DNA复合物、有丝分裂纺锤体中央区等,见图2。
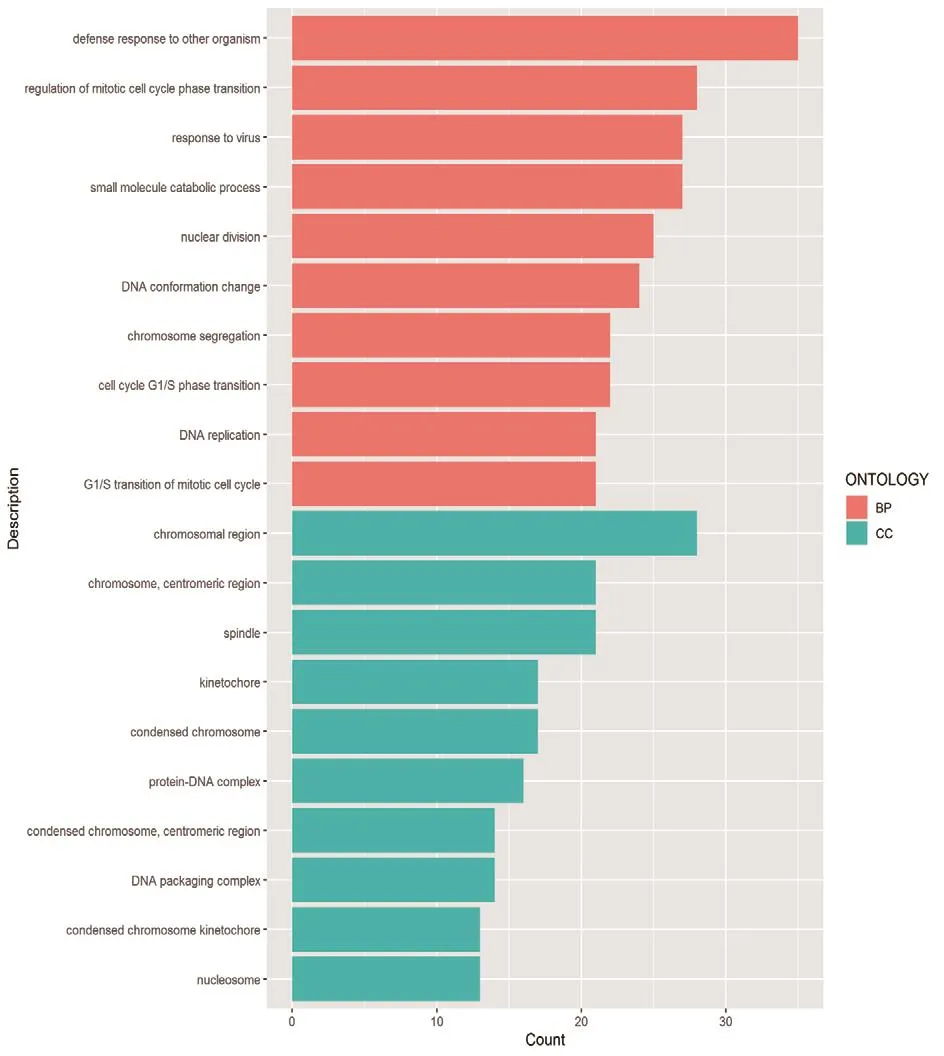
图2 GO富集分析选择富集基因数量排名前10的进行展示;橙色代表BP,蓝色代表CC,横坐标为富集的基因数量,纵坐标为GO富集条目Figure 2 GO enrichment analysis
2.3.2 KEGG富集分析 富集KEGG通路共244条,主要富集条目为抗病毒、抗凋亡、免疫调节,凝血系统相关信号通路等。相关基因有CXCL8、CCL20、MMP1、SLC7A5、EIF4EBP1 、SESN2、CFHR1、CFH、PLAT等。抗病毒相关信号通路包括HIV-1感染信号通路、碱基切除修复、DNA复制等,其中HIV-1感染信号通路见图3;抗凋亡相关信号通路包括p53、铁死亡、JAK-STAT等,其中JAK-STAT通路见图4;免疫调节相关信号通路包括类风湿性关节炎、IL-17、mTOR等,其中IL-17信号通路见图5;凝血系统相关信号通路包括叶酸生物合成、补体与凝血系统等,其中补体与凝血系统信号通路见图6。
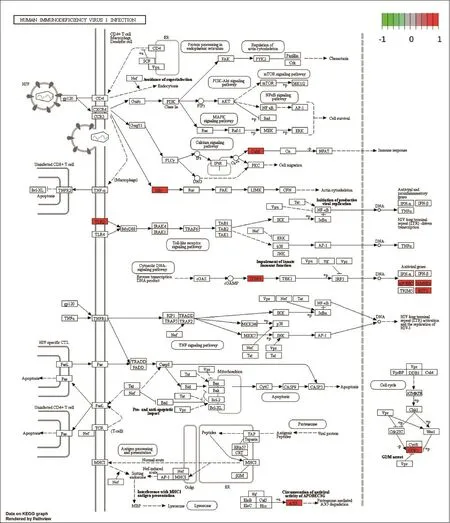
图3 抗病毒相关信号通路红色表示差异表达基因上调,绿色表示差异表达基因下调Figure 3 Anti virus related signaling pathway
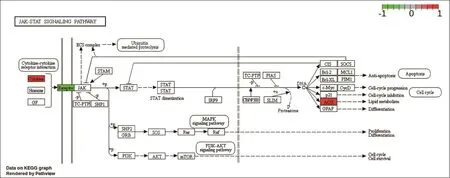
图4 抗凋亡相关信号通路红色表示差异表达基因上调,绿色表示差异表达基因下调Figure 4 Anti-apoptosis related signaling pathway
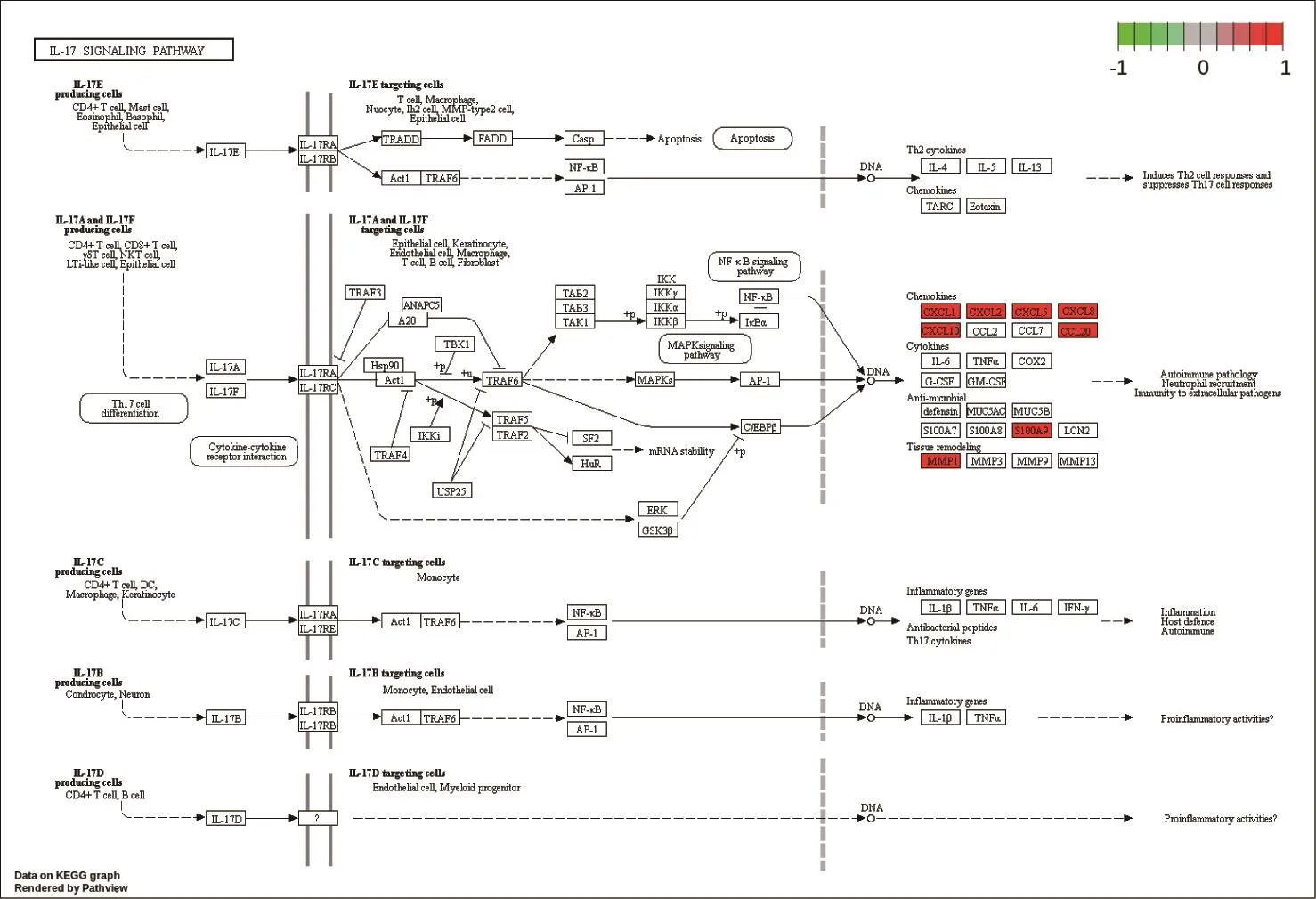
图5 免疫调节相关信号通路红色表示差异表达基因上调,绿色表示差异表达基因下调Figure 5 Immunomodulatory signaling pathway
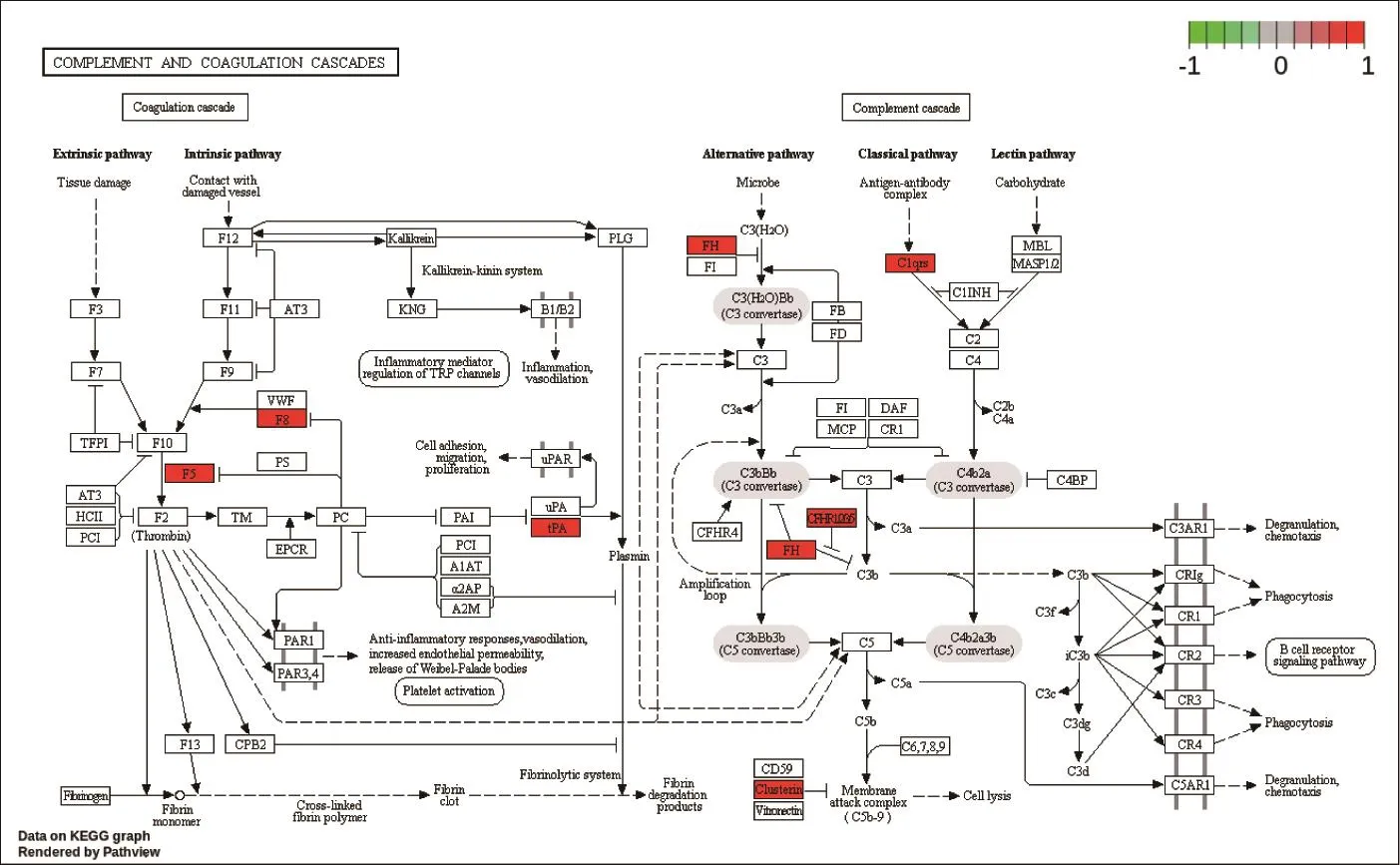
图6 凝血系统相关信号通路红色表示差异表达基因上调,绿色表示差异表达基因下调Figure 6 Coagulation system related signaling pathway
2.4 PPI网络分析及核心基因筛选 PPI网络分析结果显示,共得到514个蛋白,715条相互关系,平均点度2.78。对核心基因进行筛选,排名前10位核心基因分别为CDK1、CCNA2、CDC6、KIF11、MAD2L1、NDC80、RRM2、ASPM、NCAPG、CENPU,见图7。
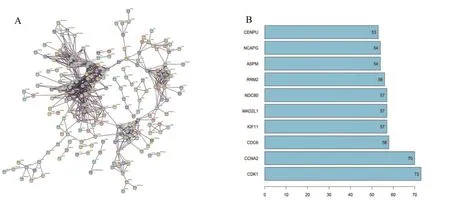
图7 关键基因PPI 网络及核心基因统计图A.PPI网络;B.排名前10位的核心基因Figure 7 Key gene in PPI network and statistical chart of hub genes
2.5 EpiMed关联分析 EpiMed预测结果显示,西多福韦与SARS、肺炎等疾病呈负相关,与利巴韦林、α-干扰素等药物呈正相关,与诺氟沙星、衣霉素等抗生素呈负相关,见表2。

表2 EpiMed关联分析结果Table 2.Results of EpiMed correlation analysis
3 讨 论
本研究以西多福韦相关全基因组表达谱数据为研究对象,经临床生物信息学分析,发现西多福韦可对大量基因表达模式产生影响,尤其以CDK1等细胞周期相关分子最为显著,与以往研究结果一致[12-14]。此外,富集分析结果显示,上述分子表达水平变化可能与抗病毒、抗凋亡、免疫调节和凝血系统相关信号通路有关,针对以上信号通路开展研究有望揭示西多福韦治疗COVID-19的组学机制。
既往研究表明,包括SARS-CoV、SARSCoV-2等在内的RNA病毒可通过干扰宿主组蛋白修饰、染色质重塑机制或编码与宿主组蛋白直接相互作用的病毒蛋白,进而干扰和拮抗宿主先天免疫反应[15]。本研究GO富集分析发现,西多福韦调控基因中有大量与干扰病毒复制、I型干扰素作用、免疫调节等作用相关的分子,例如IFIT3、OAS1、ISG15等。Carey等[16]发现,OAS1结合入侵病毒双链RNA,可产生2'-5'连接的寡聚腺苷酸,以激活核糖核酸酶,裂解RNA,抑制病毒复制。同时 OAS1还可以通过宿主RNA进行自动激活,从而发挥抗病毒作用;除此之外,本研究发现大量西多福韦调控基因富集于I型干扰素作用的BP中,例如 IFIT1、IFIT2、Mx2等。Zhao等[17]发现IFIT1、IFIT2等产生后,可通过干扰病毒包膜与宿主膜融合,直接发挥抑制病毒作用;Haller与Fuchs等[18-19]发现,Mx2等Mx家族蛋白可作为干扰素诱导产生ISG家族的激动剂,对多数RNA和DNA病毒初期复制具有广泛抑制作用。因此,本研究推测西多福韦可以通过上述分子调控的BP发挥抗SARS-CoV-2的作用。
此外,西多福韦影响的信号通路主要与抗病毒、抗凋亡、免疫调节及凝血系统相关。以往研究发现,西多福韦可通过诱导病毒感染相关肿瘤细胞的凋亡发挥治疗作用[20-21]。本研究发现大量基因富集于p53、铁死亡、JAK-STAT等抗凋亡相关信号通路,推测西多福韦可通过上述信号通路诱导感染SARS-CoV-2的细胞凋亡,进而发挥抗病毒作用。现已证实,冠状病毒感染人体后可通过IL-17、mTOR等免疫调节相关信号通路诱导促炎因子释放,同时影响CD8+T细胞、CD4+T细胞功能进而发生异常凋亡、分化及迁移[22-24]。本研究发现,西多福韦可通过mTOR、IL-17信号通路发挥免疫调节作用。在IL-17信号通路中,CXCL8、CCL20、MMP1是西多福韦的主要作用对象,推测西多福韦可通过这些分子影响IL-17信号通路进而抑制促炎因子的释放,改善SARS-CoV-2感染导致的相关免疫失调问题。同时,西多福韦可通过SLC7A5、EIF4EBP1 、SESN2等分子对mTOR信号通路产生影响,推测与COVID-19患者体内的免疫细胞迁移密切相关。临床研究发现,COVID-19重症患者常出现脓毒症休克及凝血功能异常,其潜在机制除与体内病毒大量复制及免疫反应有关外,可能还与凝血系统相关信号通路的功能异常密切相关[25]。本研究发现,西多福韦可对叶酸生物合成、补体与凝血系统等凝血系统相关信号通路产生影响,CFHR1、CFH、PLAT等分子可作为西多福韦调控凝血功能的主要分子,与既往研究结果一致[26]。基于上述结果,推测西多福韦对重型COVID-19患者的免疫失调、凝血功能异常等症状具有潜在治疗作用。
再者,基于EpiMed开展的疾病和药物关联分析发现,与疾病呈负相关表示该药物可能对某疾病发挥治疗作用;与药物呈正相关表示该药物具有与西多福韦类似的作用,且联合用药可发挥协同作用。与抗生素呈负相关表示该药物与西多福韦联合使用可能会加重病情[6-7]。在疾病关联分析方面,西多福韦与肺炎、SARS等疾病呈负相关,提示西多福韦可能对上述疾病具有治疗作用,因SARS-CoV与SARS-CoV-2序列高度同源,推测西多福韦对COVID-19具有类似治疗作用。在药物关联分析方面,西多福韦与氟伐他汀、利巴韦林、α-干扰素、柴胡、黄芪等药物呈正相关,推测可能与西多福韦作用类似且可与西多福韦联合用药。国家卫生健康委员会发布的《新型冠状病毒肺炎诊疗方案(试行第八版)》[27]中亦包含上述药物。同时,Reiner等[28]发现包括氟伐他汀在内的他汀类药物可能是SARS-CoV-2高效的抑制剂,与本研究结果一致。此外本研究发现,西多福韦与衣霉素、诺氟沙星等抗生素呈负相关。Becattini等[29]发现,抗生素会破坏共生种群之间的平衡,导致人类肠道菌群和下层黏膜物质之间的交换减少;也可能会产生过敏、代谢综合征、药物疗效降低等多种后果。以上都说明衣霉素、诺氟沙星等抗生素不仅不能与西多福韦联合应用,而且不建议用于COVID-19的治疗。
本研究不足之处在于未能开展临床试验和直接获取SARS-CoV-2感染的开源数据,未来如能开展基础及临床试验,有望为COVID-19治疗药物与临床方案的选择及优化提供指导。
综上所述,西多福韦能够对机体全基因组产生影响,可能通过诱导感染细胞凋亡降低体内SARS-CoV-2数量;通过免疫调节、凝血系统相关信号通路等对机体免疫失调及重型患者出现的凝血功能异常进行调节,达到治疗COVID-19的作用。
