超声波辅助酶解法提取北虫草菌素及其降血糖活性研究
2021-05-21符群郐滨钟明旭吴小杰
符群,郐滨,钟明旭,吴小杰
1(东北林业大学 林学院,黑龙江 哈尔滨,150040)2(黑龙江省森林食品资源利用重点实验室(东北林业大学),黑龙江 哈尔滨,150040)
北虫草(Cordycepsmilitaris,Link)又名北冬虫夏草、蛹虫草,与冬虫夏草属于同属真菌,是一种常见的药食同源真菌[1]。北虫草营养丰富,与冬虫夏草的化学成分与药用功能相似[2],特别是虫草素含量是野生冬虫夏草的数倍。冬虫夏草培养条件复杂,价格高昂,无法实现商业化培育,而北虫草人工培养技术成熟,现已实现人工大规模生产,因此,北虫草作为冬虫夏草替代品的研究开发具有重要现实意义[3-4]。虫草素即3’-脱氧腺苷(3’-deoxyadenosine),是一种核苷类似物[5],也是北虫草中重要的活性成分,具有抗菌、抗肿瘤、调节免疫、降血糖等多种药理作用,及治疗代谢紊乱、氧化损伤等多种疾病的潜能[6-8]。
胰岛素抵抗(insulin resistance,IR)是指某些因素诱使胰岛素促进葡萄糖摄取和利用率降低,使机体大量分泌胰岛素以维持血糖的稳定,从而产生高胰岛素血症。目前认为,IR产生的主要部位是肝脏及外周组织,可诱发多种代谢相关疾病,更是Ⅱ型糖尿病的发病基础[9]。HepG2细胞是一种表型与肝细胞极为相似的肝胚胎瘤细胞株,胰岛素水平和刺激持续的时间与HepG2细胞表面胰岛素受体数目有关,因此构建胰岛素抵抗HepG2细胞模型是对IR相关疾病研究的重要途径[10]。
近年来,随着分离技术水平的提高,国内外学者对北虫草菌素的研究渐多[11],虫草素的提取目前多采用单一的方式,如热回流法、超高压法、超声提取法、微波提取法等[12-15],其提取效率偏低,能耗大且费时。而对于北虫草中降糖活性成分的研究主要集中在虫草多糖,虫草素的降糖作用少有报道。与其他研究文献提取虫草素方法不同,本研究采用超声-酶解联合法提取,纤维素酶可去除部分初生胞壁和表面杂质,降解胞间链接物,使胞内物质溶出[16],联合超声波特有的空化作用、机械效应及热效应可加快提取物的溶解[17-19]。建立IR模型,考察虫草素对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响,以评价其降血糖活性,为北虫草资源的深入研究及产业化推进提供参考,对治疗糖尿病药物的研发具有探索意义。
1 材料与方法
1.1 材料与仪器
北虫草花,沈阳新民市种植基地,2019年;人肝癌细胞系(HepG2),中科院上海细胞库提供。
试剂:虫草素标品(≥98%),上海源叶生物科技有限公司;纤维素酶(≥100 U/mg),上海蓝季生物有限公司;甲醇(色谱纯),天津星马克科技发展有限公司;牛胰岛素、DMEM培养基(含双抗)、胎牛血清、胰蛋白酶,美国Solarbio公司;噻唑兰(thiazolyl blue tetrazolium bromide,MTT),美国Amresco公司;二甲基亚砜(dimethyl sulfoxide,DMSO),美国Sigma公司;葡萄糖测定试剂盒,南京建成生物公司。
仪器:AL—1041C分析天平,METTLER TOLEDO公司;1260 Infinity I液相色谱仪,美国安捷伦科技有限公司;JY96-IIN超声波破碎仪,宁波新芝生物科技股份有限公司;EPOCH12酶标分析仪,BioTek Instruments,Inc.;CKX41倒置显微镜,OLYMPUS;T6紫外可见分光光度计,北京普析通用仪器有限责任公司。
1.2 实验方法
1.2.1 虫草素标准曲线的绘制
准确称取2.00 mg虫草素标准品于10 mL容量瓶中,超纯水定容至刻度,摇匀,配制质量浓度为0.2 g/L的虫草素标准品储备液。分别量取1、2、4、6、8 mL储备液于10 mL容量瓶中,超纯水定容至刻度,摇匀,0.22 μm微孔滤膜过滤,得到质量浓度为0.02、0.04、0.06、0.08、0.10 g/L的虫草素标准液。
色谱柱Kromasil C18(4.6 mm ×150 mm,3 μm);柱温:35 ℃;检测器:紫外检测器;检测波长:260 nm;流动相:V(甲醇)∶V(水)=15∶85,等度洗脱;进样量:10 μL;流速:1 mL/min。
在此条件下,取上述不同质量浓度虫草素标准液进行测定。以虫草素标准溶液质量浓度(g/L)为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线,得到线性回归方程:Y=25.415X+0.662 7,R2=0.999 1,结果表明,虫草素标准溶液质量浓度在0.02~0.10 g/L范围内与峰面积呈良好线性关系。
1.2.2 虫草素含量测定及得率计算
准确量取适量北虫草提取液,过0.22 μm微孔滤膜,按照1.2.1小节中高效液相色谱(high performance liquid chromatography,HPLC)方法检测,峰面积带入线性回归方程,求出样品溶液中虫草素质量浓度,按公式(1)计算虫草素得率:
(1)
式中:ω,虫草素得率,mg/g;ρ,提取液的质量浓度,g/L;V,提取液的体积,mL;m,北虫草的质量,g。
1.2.3 超声波辅助酶解法优化试验
北虫草花去杂,50 ℃烘干,粉碎后过100目筛,称取2.00 g北虫草花粉末于三角瓶中,分别加入40 mL柠檬酸-柠檬酸钠缓冲液。在前期预实验基础上,选取对提取得率影响显著的因素进行单因素试验,固定料液比为1∶20(g∶mL),超声功率为400 W。分别选取pH值(4.0、4.5、5.0、5.5、6.0)、纤维素酶添加量(1.0%、1.5%、2.0%、2.5%、3.0%,质量分数)、酶解时间(30、45、60、75、90 min)、超声温度(30、40、50、60、70 ℃)进行提取,每个因素水平条件平行3次,灭酶活力后减压抽滤,得到北虫草提取液,优选各因素最优水平。在单因素试验的基础上,采用中心组合Box-Behnken Design优化设计方案,建立回归模型,得到最佳虫草素提取工艺。
虫草素提取物经D101大孔树脂纯化后收集洗脱液,洗脱液经真空浓缩冻干后备用,采用HPLC法按照1.2.1小节色谱条件对虫草素进行纯度鉴定。
1.3 虫草素对HepG2细胞胰岛素抵抗的改善作用
1.3.1 细胞培养
用DMEM高糖培养基与胎牛血清以体积比为9∶1的比例配制的完全培养基,在37 ℃,体积分数5%CO2条件下培养第2代HepG2细胞,待细胞长满培养瓶瓶底后,经胰蛋白酶消化制成单细胞悬液,细胞计数108个/mL,按1∶2传代,取第5代细胞进行后续实验[20]。
1.3.2 细胞活性测定
将HepG2细胞制成单细胞悬液,每孔按3×104个细胞接种于96孔细胞板内,待细胞完全贴壁后弃去培养液,PBS溶液清洗2次,分别加入含有0.01、0.05、0.10、0.50、1.00、1.50和2.50 g/L虫草素提取物的培养液100 μL,同时设定空白对照组(正常培养细胞),每组5个复孔,于37 ℃培养24 h后,每孔加入10 μL 5 g/L MTT溶液,继续培养4 h后,吸出上清液,每孔加入100 μL DMSO,使紫色甲瓒结晶充分溶解,采用酶标仪于490 nm处测定吸光值,按公式(2)计算细胞存活率,以确定安全给药范围:

(2)
1.3.3 IR模型的建立
将HepG2细胞制成单细胞悬液,每孔按3×104个细胞接种于96孔细胞板内,待细胞完全贴壁后弃去培养液,用PBS溶液清洗2次,分别加入新鲜配制含有102、10、1、10-1、10-2和10-3μmol/L的胰岛素培养液100 μL,同时设定对照组(正常培养细胞)和空白组(不含细胞只含培养液),分别培养12、24、36、48 h,每组5个复孔,依据葡萄糖测定试剂盒的说明测定各组细胞上清液中葡萄糖的含量,按公式(3)计算葡萄糖消耗量[21]:
葡萄糖消耗量/(mmol·L-1)=空白组葡萄糖含量-样品组葡萄糖含量
(3)
1.3.4 虫草素对IR-HepG2细胞葡萄糖消耗量及细胞活性的影响
采用1.3.3小节中建立的IR模型作为模型组,同时设定空白对照组(正常培养细胞)、样品组(0.01、0.05、0.10、0.50、0.75 g/L虫草素)、阳性对照组(0.05 g/L二甲双胍),每组5个复孔,分别培养12、24、36 h,测定虫草素干预后不同时间各组IR-HepG2细胞上清液中葡萄糖的含量,计算各组细胞存活率及葡萄糖消耗量,评价虫草素改善胰岛素抵抗能力。
1.4 统计学分析
2 结果与分析
2.1 单因素提取工艺实验结果
由图1可知,纤维素酶最适pH值为5.5;当酶添加量为1.5%(质量分数)时,虫草素得率达到最大值,底物得到最大程度分解;随着酶解时间的延长,虫草菌素溶出量逐渐增加,当酶解时间达到60 min时,得率为初始条件下的1.13倍,而后虫草素得率开始下降,分析原因可能是长时间的超声波效应联合酶解作用,有效促进提取的同时,也使北虫草细胞中可溶物与不溶物进入提取液,影响虫草素的溶出,因此,超声时间选择60 min;随着超声温度的升高,分子运动逐渐加快,虫草素溶出更彻底,但长时间的高温可能导致纤维素酶失活,或虫草素结构被部分破坏,因此,超声温度选择50 ℃。
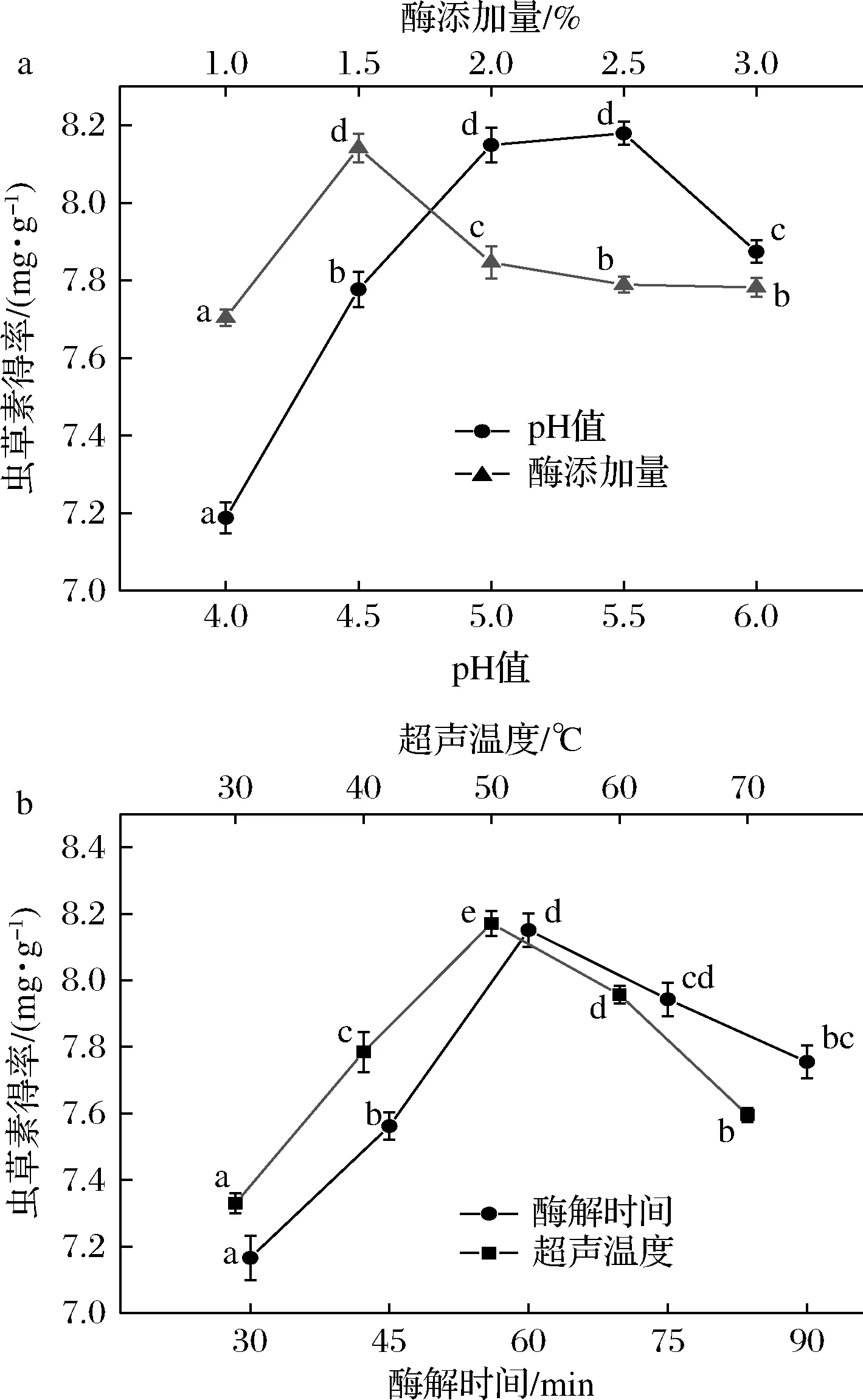
a-pH值及酶添加量对虫草素得率的影响;b-酶解时间及超声温度对虫草素得率的影响图1 各因素对虫草素得率的影响Fig.1 Effects of various factors on the yield of cordycepin注:不同字母表示差异显著(P<0.05)(下同)
2.2 响应面分析优化工艺
2.2.1 响应面设计及结果分析
根据单因素试验结果,运用Design-Expert 8.0.6软件程序根据Box-Behnken中心组合试验设计原理,以虫草素得率为响应值,设计pH值(A),酶添加量(B),酶解时间(C),超声温度(D)四因素三水平试验,试验设计水平与结果见表1。
利用Design-Expert软件进行优化,pH值(A)、酶添加量(B)、酶解时间(C)、超声温度(D)二次多项式回归拟合,得到虫草素得率对4个因素的回归方程为:
Y=8.15-0.094A+0.024B+0.075C+0.18D+0.11AB+0.081AC+0.079AD+0.10BC+0.011BD-0.12CD-0.28A2-0.20B2-0.21C2-0.20D2
续表1

2.2.2 响应面和等高曲线分析图
由图2可知,pH值和酶解时间、pH值和超声温度、酶添加量和超声温度的等高线较密集,响应面坡度较陡峭,说明交互作用显著,与方差分析的结果基本吻合。

表2 回归模型方差分析Table 2 Analysis of variance in regression model
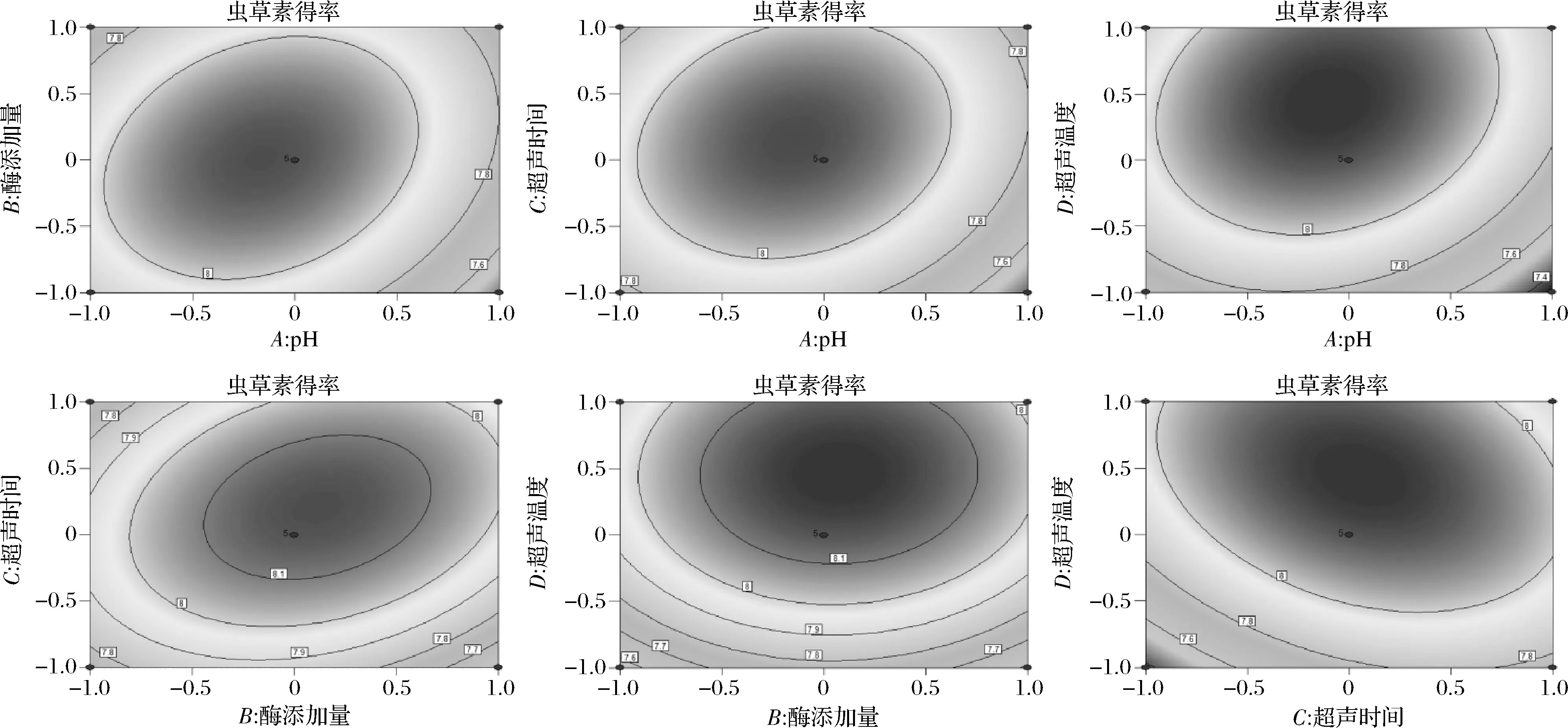
图2 各因素交互作用对虫草素得率影响的等高线图Fig.2 Contour map of the influence of interaction of various factors on the yield of cordycepin
2.3 最佳条件确定和回归模型验证试验结果
通过响应面分析得到超声波辅助酶解法提取北虫草菌素最佳工艺条件为:pH值为5.31,酶添加量质量分数为1.56%,酶解时间为60.03 min,超声波功率400 W,超声波温度为54.4 ℃。在此条件下虫草素得率为(8.192±0.033)mg/g。
为更便于产业化控制,调整最佳工艺为:pH值为5.30,酶添加量质量分数为1.60%,酶解时间为60 min,超声功率为400 W,超声温度为55 ℃。在此条件下进行结果验证,计算得出得率为(8.097±0.028)mg/g,与理论值接近。
2.4 对比不同提取方法的虫草素得率
根据优化结果,分别使用单一酶解法,按照pH值5.30,纤维素酶酶添加量1.60%(质量分数),酶解时间60 min,酶解温度55 ℃条件进行提取;单一超声法按照超声时间60 min,超声温度55 ℃,超声功率400 W条件进行提取。实验平行3次,计算2组虫草素得率。结果如图3所示,采用超声波辅助酶解法提取虫草素得率有显著提升(P<0.01),较单一超声法提高15.85%,较单一酶解法提高72.35%。不同提取方法提取虫草素得率的大小为:超声辅助酶解法>单一超声法>单一酶解法。

图3 三种提取方式的虫草素得率比较Fig.3 Comparison of cordycepin yield of three extraction methods
2.5 虫草素纯度鉴定
图4为虫草菌素及北虫草提取物纯化前后的HPLC图。其中图谱a显示,虫草素在当前液相色谱条件下,保留时间为8.02 min。图谱b及图谱c分别为相同条件下北虫草提取物及纯化物的HPLC谱,图中虫草素成分峰的峰型稳定,分离度高,与虫草素标准品的保留时间基本一致。通过纯化前后的两图对比可知,成分种类及构成无显著变化,经面积归一法计算,虫草素的纯度由(17.80±1.12)%提高至(34.89±1.09)%。

a-虫草素标准品;b-北虫草提取物;c-北虫草纯化物图4 北虫草提取物纯化前后对比的HPLC图谱Fig.4 Comparison of HPLC profiles of Cordyceps militaris extract before and after purification
2.6 虫草素质量浓度对细胞活性的影响
由表3 可知,与空白对照组相比,当虫草素质量浓度在0.01~0.50 g/L时,细胞存活率均大于80%,随着虫草素质量浓度的继续增加,对细胞活性影响极显著(P<0.01),当虫草素质量浓度在0.75~2.50 g/L 时,细胞存活率开始骤降,当虫草素质量浓度大于1.50 g/L时,细胞存活率均低于50 %,故低质量浓度的虫草素对细胞生长繁殖基本无影响,因此选择0.01~0.75 g/L虫草素进行后续研究。

表3 虫草素浓度对HepG2细胞活性的影响Table 3 Effect of cordycepin concentration on HepG2 cell survival rate
2.7 胰岛素抵抗细胞模型(IR-HepG2)的建立
由图5可知,胰岛素浓度相同时,随着诱导时间的延长,细胞葡萄糖消耗量逐渐增加,诱导时间为12 h时葡萄糖消耗量最低,48 h时葡萄糖消耗量最高。当胰岛素浓度在10~100 μmol/L范围时,诱导24、36 h,葡萄糖消耗量与空白对照组相比无显著性差异,诱导12、48 h时,葡萄糖消耗量与空白对照组相比呈显著上升趋势(P<0.05)。当胰岛素浓度为1.0 μmol/L时,不同诱导时间下的萄萄糖消耗量均为最低值,与相同诱导时间下的空白对照组相比均有显著性差异(P<0.05)。随着胰岛素浓度的继续降低,不同诱导时间下的葡萄糖消耗量整体呈大幅上升而后下降趋势。分析原因可能是低浓度的胰岛素对HepG2细胞的糖代谢有促进作用,无法诱导HepG2细胞产生胰岛素抵抗,而高浓度的胰岛素则可诱导HepG2细胞出现胰岛素抵抗状态,随着胰岛素作用于HepG2细胞时间的延长,细胞减少了对胰岛素底物的降解作用,代谢葡萄糖能力下降,导致葡萄糖消耗量开始回升[22]。因此确定1.0 μmol/L胰岛素诱导HepG2细胞12 h为最佳胰IR模型。

图5 胰岛素对HepG2细胞葡萄糖消耗量的影响Fig.5 Effects of the insulin to the glucose consumption of HepG2 cells
2.8 虫草素对IR-HepG2细胞葡萄糖消耗量及细胞活性的影响
2.8.1 虫草素对IR-HepG2细胞葡萄糖消耗量的影响
由图6可知,模型组IR-HepG2细胞葡萄糖的消耗量明显低于正常组细胞,模型组IR-HepG2细胞在加入不同质量浓度的虫草素干预后,葡萄糖消耗能力均有一定程度的提高,说明对胰岛素抵抗状态有所改善。葡萄糖消耗量随着虫草素质量浓度的增加而增加,当虫草素质量浓度超过0.25 g/L时,萄萄糖消耗量趋于平缓。药物作用于细胞24 h时,葡萄糖消耗量整体最高。当虫草素质量浓度在0.10~0.75 g/L范围内时,葡萄糖消耗量显著高于模型组(P<0.05),虫草素质量浓度为0.25 g/L,作用24 h时葡萄糖消耗量最高为(4.554±0.008)mmol/L,消耗率可达 22.75%,可见虫草素能够改善胰岛素抵抗状态。
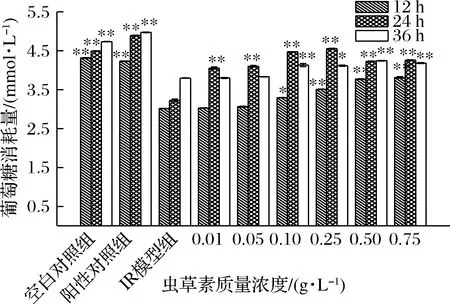
图6 虫草素对IR-HepG2细胞葡萄糖消耗量的影响Fig.6 Effects of cordycepin on glucose consumption of IR-HepG2 cells
2.8.2 虫草素对IR-HepG2细胞活性的影响
由表4可得,虫草素质量浓度在0.01~0.75 g/L 范围内,随质量浓度升高和培养时间的延长,细胞存活率降低。相同质量浓度下,培养24 h时,细胞活性最高,细胞存活率均大于80 %,说明虫草素可保持IR-HepG2细胞活性,最佳作用时间为24 h。
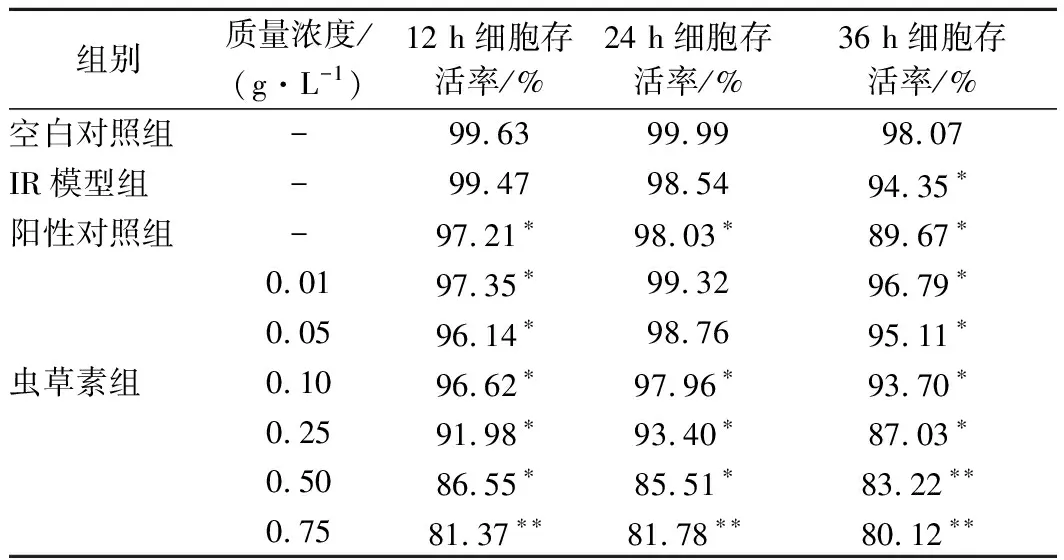
表4 虫草素对IR-HepG2细胞的影响Table 4 Effect of cordycepin on IR-HepG2 cells survival rate
3 结论与讨论
本研究采用超声波辅助酶解法提取北虫草菌素,得率可达到(8.097±0.028)mg/g,较单一超声波法提高15.85%,较单一酶解法提高72.35%,与目前研究文献的平均得率相比,提取得率具备显著优势。该法与传统单一提取方法相比,高效,省时,溶剂对环境友好,设备常规,成本低,适宜产业化推广。
胰岛素抵抗为Ⅱ型糖尿病的主要发病机制之一,通过有效成分干预从而改善胰岛素抵抗状态,是治疗Ⅱ型糖尿病的良好途径之一。本研究表明,虫草素质量浓度在0.25 g/L条件下,作用24 h时IR-HepG2细胞的葡萄糖消耗量最高为(4.554±0.008)mmol/L,消耗率可达 22.75%。与现有文献中萜类、皂苷类、多肽类降血糖成分相比,虫草素降糖效果明显,作用温和,无明显的毒副作用,且原料资源丰富,开发成本低于冬虫夏草、灵芝、松茸等其他食用菌。
研究结果显示,超声波辅助酶解法可高效提高虫草素得率,且提取物可改善胰岛素抵抗状态,丰富了北虫草研究领域,提高了天然产物的综合利用率,对降糖药物的探索和Ⅱ型糖尿病的治疗提供参考,对虫草属植物产业链延长、高值化产品推广应用具有指导意义。
