不同后发酵温度下曲霉型豆豉的氨基酸态氮生成动力学及品质变化研究
2021-05-21王迪王智荣陈湑慧宋军孔祥兵陈本开阚建全
王迪,王智荣,陈湑慧,宋军,孔祥兵,陈本开,阚建全*
1(西南大学 食品科学学院,重庆,400715)2(农业农村部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆,400715)3(中匈食品科学合作研究中心,重庆,400715)4(重庆市永川区君意食品厂,重庆,402160)
豆豉是将黄豆或黑豆经过浸泡、蒸煮和微生物发酵等工艺制成的一种风味食品,因其滋味独特而深受消费者的喜爱。在豆豉的生产工艺中,后发酵是其外观变化、风味物质生成、生物活性增强、营养成分变化的重要工序。在此阶段,豆豉中的还原糖和氨基酸进行非酶促褐变反应生成类黑精[1],使得豆豉的颜色逐渐向黑色转化,且在微生物酶系作用下,豆豉的蛋白质和纤维素发生水解,硬度和咀嚼度不断降低[2],滋味也由蒸煮后的奶香[3]向鲜味、甜味、苦味等滋味[4]转变。与此同时,大豆浸泡蒸煮后产生的20多种挥发性成分[3]经过后发酵后可增至60~80种[5],且后发酵后豆豉的游离氨基酸(free amino acids,FAA)总量、总酸(total acids,TA)和维生素B2等含量明显增高[6-7]。此外,豆豉在后发酵过程中产生的类黑精[1]和大豆多肽[8]等物质,具有抗氧化[9]及抑制血管紧张素转化酶活性作用[10]等多种生物活性,有利于促进人体健康。
研究认为,氨基酸态氮(amino nitrogen,AN)含量可以反映出豆豉中蛋白质的水解程度,其含量是判断豆豉后发酵是否完成的重要指标[11-12]。因此,研究AN生成动力学,将有利于减少工业生产成本,提高生产效率。目前,关于豆豉后发酵的研究主要集中后发酵工艺的优化和某一温度下理化性质的变化,但对于不同后发酵温度对豆豉的品质影响研究较少,尤其是不同温度下AN的生成动力学。近年来,修正后的Gompertz方程为描述豆豉后发酵过程中AN的动力学过程提供了新的思路,该方程已成功描述了多种发酵过程的产物的动力学变化[13-14]。
在豆豉工业生产中,根据不同工艺要求,曲霉型豆豉通常在45~60 ℃中的某一温度下进行保温后发酵。然而,在实际生产中,豆豉发酵程度往往依托于工人的经验进行判断,因此,本文以4种大豆(3种黄豆和1种黑豆)为原料,米曲霉为发酵菌种,使用修正后的Gompertz方程拟合45、55和65 ℃温度下AN的含量,评估不同温度下AN的最大值以及最大生成速率,同时探讨AN最大值和最大生成速率与温度的关系。此外,监测3种温度下豆豉的pH值、水分、褐变指数(browning index,BI)、TA及FAA的含量变化,并对这些指标进行相关性分析,旨在为曲霉型豆豉生产提供理论支持。
1 材料与方法
1.1 材料与试剂
4种市售大豆:重庆本地大豆(渝豆6号,文中缩写为LS),重庆市永辉超市;东北大粒大豆(东生7号,文中缩写为DBL)、黑豆(青仁乌,文中缩写为BS),黑龙江省大兴安岭市当地超市;东北小粒大豆(东生1号,文中缩写为DBS),黑龙江省哈尔滨市当地超市;米曲霉(沪酿3.042菌种),山东济宁玉园生物科技公司;醪糟、食盐,永辉超市。
赖氨酸(Lys)、亮氨酸(Leu)、谷氨酸(Glu)、精氨酸(Arg)、甘氨酸(Gly)、脯氨酸(Pro)、缬氨酸(Val)、胱氨酸(Cys)、异亮氨酸(Ile)、苯丙氨酸(Phe)、组氨酸(His)、天冬酰胺(Asn)、丙氨酸(Ala)、半胱氨酸(Cys)、酪氨酸(Tyr)、天冬氨酸(Asp)、蛋氨酸(Met)、苏氨酸(Thr),Sigma公司;1 mol/L NaOH标准溶液,Aladdin 公司;甲醛溶液、盐酸、三乙胺醋酸钠、乙腈,成都市科隆化学品有限公司;2,4-二硝基氟苯,成都科龙化工试剂厂,其中乙腈为色谱级,其余均为分析纯。
1.2 仪器与设备
WR-18威福光电色差仪,深圳市威福光电科技有限公司;Agilent 1260高效液相色谱仪,美国Agilent公司;FS-2可调高速匀浆机,江苏金坛科析仪器有限公司;DCX—9243 B-1电热恒温鼓风干燥箱,上海一恒科学仪器有限公司;PB-10 pH计、SQP电子天平,赛多利斯科学仪器有限公司;RCT basic package磁力搅拌器,德国IKA公司;LHS-150CLY恒温恒湿箱,上海齐欣科学仪器有限公司;
1.3 试验方法
1.3.1 曲霉型豆豉的制备
曲霉型豆豉的工艺及条件如下所示:
挑选大豆→浸泡 (25 ℃,12 h) →沥干→蒸煮 (常压蒸煮,2 h) →冷却→接种 (0.04%米曲霉) →制曲 (30 ℃,85%相对湿度,48 h) →拌料 (8%食盐、10%醪糟) →后发酵 (45、55、65 ℃)→豆豉
将拌匀后的曲料分装在无菌密封袋中,分别放在45、55及65 ℃的恒温箱中进行后发酵,并于0、2、4、7、10、14、18、22 d分别取样并进行相关理化指标的测定。
1.3.2 水分含量的测定
参考COSTA等[15]的方法并作适当修改,先称空白铝盒的质量记为m1,再称取5 g左右豆豉于铝盒中记为m2,再放置在105 ℃下烘16 h,烘后质量记为m3,按公式(1)计算水分含量:

(1)
1.3.3 pH值的测定
参考张仁凤[11]的方法。取5 g样品加入40 mL蒸馏水并用匀浆机破碎,7 500 r/min离心10 min,离心后将上清液移至50 mL容量瓶并定容,用pH计测定。
1.3.4 TA的测定
取5 g豆豉加入50 mL 蒸馏水并用匀浆机分散均匀,定容到100 mL,按照GB/T 12456—2008[16]中总酸的方法进行测定,结果以乳酸计。
1.3.5 AN的测定
样品制备方法与总酸测定相同,样品制备好后按照GB 5009.235—2016[17]测定AN的含量。
1.3.6 BI的测定
使用色差计直接测定豆豉的颜色,即L*、a*和b*值,按公式(2)计算BI[18]:
(2)
(3)
1.3.7 FAA的测定
(1) FAA标准曲线的绘制。分别准确称取氨基酸标准品各4 mg于5 mL 的棕色容量瓶中,用0.1 mol/L的HCl溶液定容。分别吸取上述混合标准溶液,用0.1 mol/L的HCl溶液稀释,制成一系列浓度的混合溶液。
(2) 豆豉样品的制备。参考梁叶星等[19]的方法并作适当修改。准确称取豆豉样品5 g,加入20 mL 0.1 mol/L HCl溶液,用匀浆机对样品进行破碎,将破碎后的样品溶液放置在25 ℃、160 r/min 振荡摇床中振荡提取1 h,8 000 r/min离心15 min,过滤至50 mL容量瓶,在滤渣中按照上述方法重复提取1次,合并滤液最后定容。
(3) FAA的柱前衍生和HPLC测定条件。将氨基酸标准溶液和豆豉样品参照文献[20]的方法进行柱前衍生,衍生结束后经0.22 μm有机微孔滤膜过滤,取滤液后HPLC上机分析。
1.3.8 数学模型
修正后的Gompertz方程如公式(4)所示[13]:
(4)
式中:Pm,AN的最大值,g/100 g;tz,滞后时间,h;km,生成速率,g/h;t,后发酵时间,d。
1.3.9 数据分析及处理
以上指标均重复测定3次。使用Microsoft Excel 2019处理数据,Origin pro 2019b绘制图形和拟合方程,Minitab 19进行显著性分析,SPSS 25进行相关性分析,确定系数(R2)和误差平方和(sum of squares due to error,SSE)对数学模型进行评估。
2 结果与分析
2.1 不同后发酵温度下曲霉型豆豉的AN生成动力学
如图1所示,在后发酵过程中,4种大豆在3种温度下AN含量总体呈现出先上升后逐渐趋于稳定最终有所下降的趋势,发酵前期的上升后趋于稳定是因为随着后发酵的不断进行,总蛋白酶活力逐渐下降,从而导致AN的增速逐渐变慢[7,21];发酵22 d AN含量下降可能是豆豉内某些生化反应消耗所导致的。同时,不同后发酵温度下AN的含量不同,这可能是因为后发酵的温度影响了蛋白酶的活力,温度越高,蛋白酶活力越低。值得注意的是,4种豆豉在65 ℃下,后发酵前期AN含量有明显的下降,这可能是因为在此温度条件下,蛋白酶活力很低,氨基酸的消耗量远大于产生量。

a-LS;b-DBL;c-DBS;d-BS图1 不同后发酵温度下4种曲霉型豆豉的AN含量Fig.1 AN content of four Aspergillus-type Douchi at different post-fermentation temperatures
由图1可知,4种豆豉在发酵18 d的AN含量达到最高,故将18 d作为豆豉发酵的终点。国家标准规定曲霉型豆豉AN含量需高于0.4 g/100 g,本文所研究的各温度下AN终点含量均符合该要求。为了更好地探索温度和AN的关系,剔除了65 ℃下0 d的值,使用修正后的Gompertz方程拟合了4种大豆在3种温度下的AN含量,拟合结果如表1所示,拟合曲线如图2所示。
表1中,R2均大于0.94,故该方程可以很好地拟合不同温度下后发酵过程中AN的生成;4种豆豉在同一温度Pm和km基本无差异,这说明大豆品种对于后发酵期间AN的生成无明显影响。4种曲霉型豆豉Pm和km均随着温度的升高而降低。CHOACHAMNAN等[22]使用Arrhenius方程描述km和T(K)之间的关系,本文使用线性回归描述Pm和后发酵温度T(K)之间的关系,结果如表2所示。在45~65 ℃,km和发酵温度之间也符合Arrhenius方程的关系,Pm和温度有良好的线性关系。

表1 方程系数及拟合优度表Table 1 Equation coefficients and goodness of fit

a-LS;b-DBL;c-DBS;d-BS图2 不同后发酵温度下4种曲霉型豆豉的AN实测值和拟合曲线Fig.2 Measured AN values and fitting curves of four Aspergillus-type Douchi at different post-fermentation temperatures

表2 模型系数和温度的关系Table 2 Relationship between model coefficients and temperature
2.2 不同后发酵温度下曲霉型豆豉的水分含量、pH及TA的变化
如图3所示,4种大豆在不同温度下的水分含量虽有波动但无显著差异,这可能是因为豆豉在后发酵过程中处于密闭环境,无法与外界交换水分,在赵文鹏[23]和张仁凤[11]的研究中也发现了类似的现象。4种豆豉的水分含量略有差异可能是因为品种不同。
由图4可知,4种大豆的pH值在3个温度下均呈现出短暂上升后下降的趋势,且在3种温度下无较大差异,4种豆豉间的pH值无显著的差异。如图5所示,在3种温度下,4种大豆的总酸含量整体呈现出先下降后缓慢上升最终趋于稳定的趋势。pH的上升和TA的下降可能是微生物生长消耗,后期pH的下降和TA上升可能是因为豆豉中的蛋白质和脂肪等物质被相关酶分解成有机酸、FAA及脂肪酸等酸性物质[11]。对TA而言,不同温度下,4种豆豉的TA含量呈现出一样的趋势:在45 ℃下含量最高,其次为55 ℃,65 ℃含量最低。这可能是在本文研究的温度下,温度越高,生成酸类物质相关酶的酶活力越低。对比同一温度下4种豆豉TA含量,发现DBL明显高于其他3种,其次是BS、LS和DBS,后3种差异不是很大,这可能与大豆品种有关。
2.3 不同后发酵温度下曲霉型豆豉的BI变化
由图6可知,随着后发酵的不断进行,4种豆豉BI值呈现出不断上升的趋势,吴枚枚[12]也发现了同样的现象。同时观察出,后发酵温度越高,BI值越大,这可能是因为温度越高,美拉德反应越快[22],由此证明,后发酵的时间和温度都会影响豆豉褐化。
2.4 不同后发酵温度下曲霉型豆豉的FAA含量变化
本文测定了发酵终点(18 d)4种曲霉型豆豉在3种温度下的FAA含量,结果如表3所示。由表可知,4种豆豉中都检测出18种FAA。对比4种豆豉后发酵前后总FAA的含量,观察到45 ℃和55 ℃的FAA含量大幅度增高,在65 ℃条件下,除黑豆的FAA含量有轻微上升以外,其余3种黄豆的FAA含量均轻微下降。同时除了Ala之外,其余氨基酸基本均随着后发酵温度的升高而降低。索化夷等[2]报道,Glu和Leu是大豆中的主要游离氨基酸,本文的结果也证实了这一点。4种豆豉中均含有除色氨酸以外的7种人体必需氨基酸[2],通过对比发酵前后必需氨基酸含量的变化,发现3种发酵温度下其含量都在增加:在45 ℃下,LS、DBL、DBS和BS分别增加了4.1、4.6、6.3和6.7倍;在55 ℃下,分别增加了3.8、4.4、5.2和6.1倍;在65 ℃下,4种豆豉分别增加了1.4、1.8、2.1和2.5倍;对比发酵前4种豆豉的FAA总含量,发现3种黄豆的总含量无明显差异且均高于黑豆的总含量,差异主要体现在Arg的含量不同;对比45和55 ℃下4种豆豉的游离氨基酸总含量,发现黑豆的总含量高于3种黄豆,主要体现在Glu的含量不同;但在65 ℃下没有发现4种豆豉的总含量有明显差异。通过对比发酵前4种豆豉的必需氨基酸含量,发现LS最高,其次为DBL、DBS和BS。对比同一温度下4种豆豉的必需氨基酸含量,发现在45和55 ℃下依旧是LS>DBL>DBS>BS,但在65 ℃下4种豆豉无明显差异。

a-LS;b-DBL;c-DBS;d-BS图3 不同后发酵温度下4种曲霉型豆豉的水分含量Fig.3 Moisture content of four Aspergillus-type Douchi at different post-fermentation temperatures

a-LS;b-DBL;c-DBS;d-BS图4 不同后发酵温度下4种曲霉型豆豉的pH值Fig.4 pH value of four Aspergillus-type Douchi at different post-fermentation temperatures

a-LS;b-DBL;c-DBS;d-BS图5 不同后发酵温度下4种曲霉型豆豉的TA值Fig.5 TA value of four Aspergillus-type Douchi at different post-fermentation temperatures

a-LS;b-DBL;c-DBS;d-BS图6 不同后发酵温度下4种曲霉型豆豉的BI值Fig.6 Browning index of four Aspergillus-type Douchi at different post-fermentation temperatures
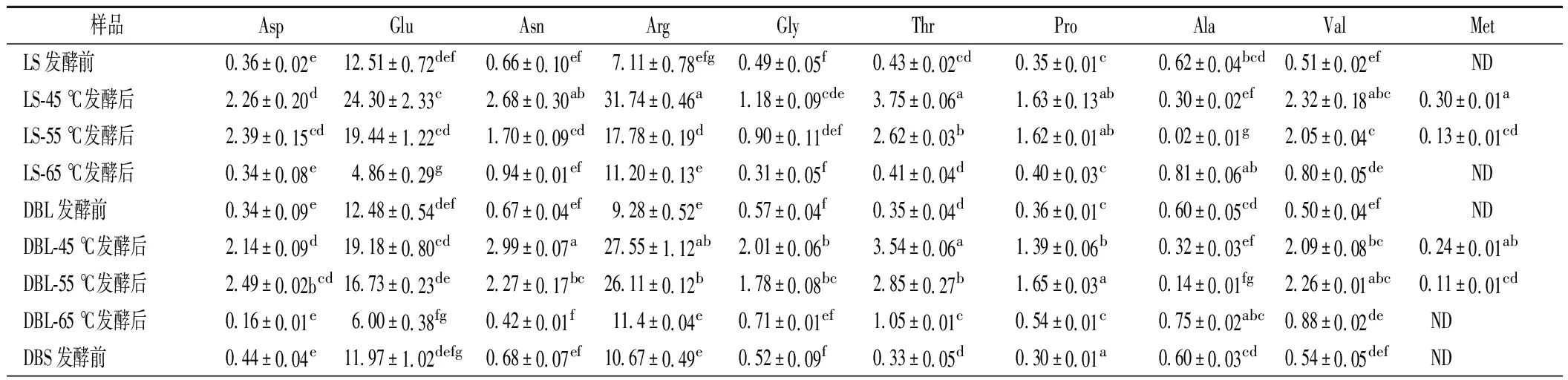
表3 四种曲霉型豆豉不同温度下发酵前后游离氨基酸含量Table 3 Content of free amino acids before and after fermentation of four Aspergillus-type Douchi at different temperatures
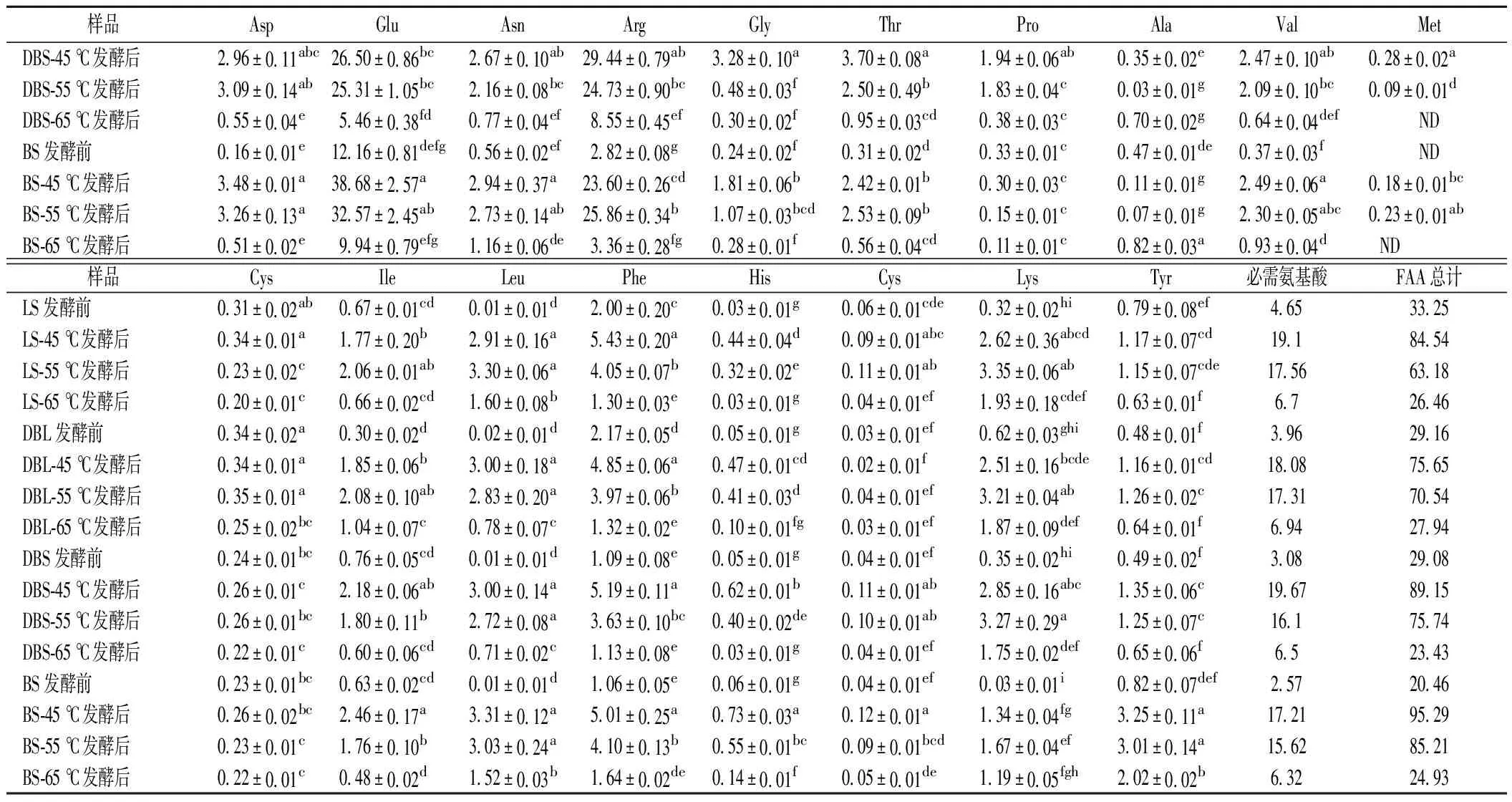
续表3
秦礼康[24]将游离氨基酸分为以下几种呈味氨基酸:甜味(Ala、Gly、Thr、Ser),鲜味(Glu、Asp),苦味(Met、Arg、Phe、Leu、His、Tyr、Val、Ile)及无味氨基酸(Pro、Cys、Lys)。由表4可知,在后发酵前后,鲜味和苦味氨基酸占了呈味氨基酸总量的80%及以上,甜味及无味氨基酸在呈味氨基酸中的占比差异不大。在后发酵前,4种豆豉的鲜味氨基酸占比略微高于苦味氨基酸;在后发酵结束后,3种黄豆豆豉中的苦味氨基酸明显高于鲜味氨基酸;而黑豆中鲜味及苦味氨基酸占比差异不大。此外,鲜味氨基酸在呈味氨基酸中占比随着后发酵温度的升高而降低。

表4 不同温度下4种曲霉型豆豉发酵前后呈味氨基酸在总氨基酸的占比Table 4 Proportion of flavored amino acids in total amino acids before and after fermentation of four Aspergillus-type Douchi at different temperatures
2.5 不同后发酵温度下曲霉型豆豉各指标的相关性分析
对4种曲霉型豆豉在45~65 ℃下后发酵期间(0~18 d)水分含量、BI值、pH、TA及AN含量进行相关性分析,分析结果如表5所示。在4种曲霉型豆豉中各指标间的相关性呈现一致的趋势:发酵温度与BI值呈极显著正相关(P<0.01),与TA和AN呈极显著负相关(P<0.01),这可能是因为在本文研究的温度范围内,温度越高,生成类黑精的褐变反应速度越快[7],生成有机酸和游离氨基酸的酶活力越低[12]。而水分含量和其余指标的相关度比较低,这是因为发酵过程豆豉水分没有显著变化。BI值和pH值呈极显著负相关 (P<0.01),可能是因为随着发酵的进行,豆豉的BI值越来越高,样品中的pH越来越低。本文研究了3个发酵温度,发现豆豉颜色和AN没有相关性;但仅对一种温度下的豆豉颜色和AN进行相关性分析,发现2个指标呈现正相关,这与韩佳冬[25]在永川豆豉的后发酵过程中发现豆豉的颜色和AN的生成有显著的相关性的结果类似。TA与AN呈极显著正相关 (P<0.01),张仁凤[11]使用同种米曲霉在后发酵过程中也发现了同样的结果,这可能是因为在后发酵过程中,TA和AN含量的增加都与其相关的酶有关,而大部分酶的酶活力均呈下降趋势[21]。

表5 不同指标间的相关性分析Table 5 Correlation analysis between different indicators
3 结论
本研究发现修正后的Gompertz方程可以很好地描述4种曲霉型豆豉在不同后发酵温度(45~65 ℃)下AN的生成动力学,观察拟合后的参数发现,AN的最大值和生成速率均随着温度的升高而降低,且AN的最大值与温度呈线性关系,生成速率和温度的关系符合Arrhenius方程,但4种豆豉的AN最大值和生成速率没有差异。此外,后发酵温度越高,4种豆豉的褐变程度越高,TA和AN含量越低,发酵结束后的游离氨基酸总量与必需氨基酸总量越低。本研究结果能准确描述不同温度下AN变化的动力学方程,明确了不同温度下曲霉型豆豉理化性质的变化,为曲霉豆豉的工业化生产提供理论支持。
