病毒性皮肤疣小鼠模型的建立
2021-05-20李丹蔡方舟李哲王卫
李丹蔡方舟李哲王卫
(北京协和医学院比较医学中心,中国医学科学院医学实验动物研究所,新发再发传染病动物模型研究北京市重点实验室,国家卫生健康委员会人类疾病比较医学重点实验室,北京 100021)
人乳头瘤病毒(human papillomavirs,HPV)可引起多种常见皮肤疾病,包括良性疣、光化性角化病及鳞状细胞癌等[1-2],其中免疫抑制患者感染发病并进展为癌症比免疫健全的人高100 倍[3]。由于乳头瘤病毒具有严格种属特异性,HPV 无法感染实验动物建立动物模型。科学家们通过犬口腔乳头瘤病毒(canine oral papillomavirus,COPV/CPV1)、棉尾兔乳头瘤病毒(cottontail rabbit papillomavirus,CRPV)、 及兔口腔乳头瘤病毒 ( rabbit oral papillomavirus,ROPV)以及牛乳头瘤病毒(bovine papillomavirus,BPV)等感染动物模型来理解乳头瘤病毒感染过程及发病机制[4-5],然而这些感染模型个体差异大及有限的技术等问题,使得更为理想的感染实验室小鼠模型尚待建立。2011 年,印度科学家从NMRI-Foxn1(Nu)/Foxn1(Nu)裸鼠上分离得到小鼠乳头瘤病毒(mouse papillomavirus,MmuPV1),其可感染实验室小鼠品系,首次提供利用小鼠研究乳头瘤状病毒的机会[6-9]。本研究利用MmuPV1 感染T 细胞缺陷的Crl:NU-Foxn1nu小鼠尾部并进展为病毒性皮肤疣模型,为进一步研究HPV 持续感染、致病机制研究等提供研究平台,有望助力于HPV 致病机制和治疗方法研究。
1 材料与方法
1.1 材料
1.1.1 实验动物
15 只 6 ~ 8 周龄 SPF 级雌性 NU/NU(Crl:NUFoxn1nu,编号403)小鼠,体重18 ~25 g,购自北京维通利华实验动物技术有限公司【SCXK(京)2016-006】。动物饲养于中国医学科学院医学实验动物研究所 ABSL-2 级实验室【SYXK(京)2019-0014】,饲养条件:温度 20 ~ 26℃,湿度 40% ~70%,光照周期12 h/12 h,动物自由采食和饮水。本动物实验已通过中国医学科学院医学实验动物研究所实验动物使用与管理委员会审批(批准号:WW19001)。
1.1.2 病毒毒株
小鼠乳头瘤病毒(MmuPV1)及质粒pMusPV 由宾夕法尼亚州立大学Jiafen Hu 教授惠赠。
1.1.3 主要试剂与仪器
三溴乙醇(Sigma-Aldrich, T48402), DNeasy Blood &Tissue Kit(Qiagen,69506),QuantiTect Probe PCR Kits(Qiagen,204343),RNAscope® Probe-VMusPV-E4 ( Advanced Cell Diagnostic, 473281),RNAscope® 2.5 HD reagent kit-Brown(Advanced Cell Diagnostic,322300);PlatinumTMTaqDNA Polymerase High Fidelity(Invitrogen,11304029),Trans2K® Plus DNA Marker(全式金,中国)。
Bead Ruptor Elite 多功能生物样品均质器(OMNI International,美国),PCR 仪(Bio-Rad T100 Thermal Cycler,美国),实时定量 PCR 仪(Applied Biosystems Quantudio 3,美国),NanoZoomer S60 数字切片扫描仪(HAMAMATSU,日本)。
1.2 方法
1.2.1 病毒制备
MmuPV1 是从小鼠尾部病变部位分离[9]。具体步骤为利用手术刀片将增生组织置于匀浆管中,加入PBS,电动匀浆器5.65 m/s 45 s,间隔30 s 后再次匀浆,将匀浆后的产物以 10 000 rpm 离心2 min,上清液置于 EP 管中-80℃储存。MmuPV1病毒液与 PBS 按1 ∶5进行稀释(即 40 μL 病毒液加入 200 μL PBS),混合后置于 0.22 μm 醋酸纤维素无菌离心过滤管,过滤管中再加入200 μL PBS,因过滤过程的损失,最终可得到250 μL病毒液。
1.2.2 小鼠感染
NU/NU 小鼠经三溴乙醇麻醉,按每公斤体重腹腔注射240 mg。待小鼠麻醉后,利用刀片在小鼠尾部反复轻轻刮擦20 次左右,取10 μL 病毒液(1.5 ×108copies vrial DNA)滴加到刮擦过的尾部,待病毒液体自然干燥后,将感染后的小鼠放回鼠笼。感染后16 周安乐小鼠并收集增生组织。
1.2.3 MmuPV1 DNA 及载量检测
利用Dneasy Blood&Tissue Kit(Qiagen)提取病毒或动物组织 DNA。使用 MmuPV1 E2 上下游引物,MmuPV1 _ E2 _1 (5’-GCCCGAAGACAACACC GCCACG-3’)和 MmuPV1_E2_2(5’-CCTCCGCCTCGTCCCCAAAAAATGG-3’)扩增[10],PCR 反应体系为25 μL, 具 体 为: 10 × High Fidelity PCR Buffer 2.5 μL、10 mmol/L dNTP Mix 0.5 μL、50 mmol/L MgSO41 μL、MmuPV1_E2_1 primer 1 μL、MmuPV1_E2_2 primer 1 μL、MmuPV1 DNA 3 μL、Platinum®TaqDNA polymerase High Fidelity 0.1 μL、去离子水15.9 μL。反应条件:94℃ 10 min;94℃ 15 s、60℃30 s,68℃ 45 s,35 个循环;68℃ 10 min,琼脂糖凝胶电泳鉴定。
qRT-PCR 法检测病毒载量,利用已知浓度pMusPV 质粒绘制标准曲线,同样靶向MmuPV1_E2基因进行检测,上下游引物同PCR 扩增引物,探针序列为 FAM-TGCCCTTTCAGTGGGTTGAGGACAGMGB[10]。反应体系为20 μL,具体为:2 × QuantiTect Probe PCR Master Mix 10 μL、MmuPV1_E2_1 primer 1 μL、MmuPV1_E2_2 primer 1 μL、MmuPV1_E2_probe 0.5 μL、Template DNA 1 μL、Rnase-free water 6.5 μL。反应条件:50℃ 2 min;95℃ 10 min;95℃15 s;60℃ 1 min,40 个循环。
1.2.4 免疫组化
感染16 周后,将MmuPV1 感染NU/NU 小鼠进行安乐,采集尾部增生部位皮肤,制备成石蜡块进行苏木精-伊红(HE 染色)。方法简述:增生组织经10%的多聚甲醛固定、脱水透明后,石蜡包埋后切片;切片脱蜡后进行HE 染色,显微镜下观察。
1.2.5 RNA 原位杂交
制备的石蜡切片,利用 RNAscope 检测[11]。具体为:(1)切片脱蜡:60℃烤片1 h,二甲苯脱蜡,100%酒精,室温静置干燥5 min;(2)双氧水靶标修复:滴加5 ~ 8 滴RNAscope® 双氧水后孵育10 min,蒸馏水清洗,浸没于煮沸的1 × RNAscope® 靶标修复液中放置15 min,蒸馏水清洗,100%乙醇中清洗,室温静置干燥 10 min; (3) 画疏水圈: 利用ImmedgeTM疏水笔在检测样本周围画疏水圈2 ~4次;(4)切片滴加5 滴 RNAscope® 蛋白酶 plus 的切片放入HybEZTM湿盒,再放入40℃杂交炉30 min,蒸馏水清洗;(5)探针杂交:切片滴加4 滴MmuPV1 E4探针,再放入湿盒,杂交炉40℃孵育2 h,1 × 清洗缓冲液清洗;(6)Amp 杂交反应:依次加入 Amp1 ~Amp6 杂交反应液4 滴,分别放回湿盒,杂交炉40℃孵育,结束后用1 ×清洗缓冲液清洗,再依次进行下次杂交;(7)信号检测:切片上滴加120 μL DAB 工作液,静置10 min,,蒸馏水洗3 ~5 次;(8)切片复染:放入苏木精染色液中,室温静置2 min,蒸馏水洗3 ~ 5 次,0.02%氨水洗1 次,蒸馏水再洗3 ~ 5 次;(9)切片分别置于70%乙醇,100%乙醇孵育2 min,以及二甲苯溶液,静置5 min;(10)切片风干后,滴加1 滴 Cytoseal 封片剂,盖上盖玻片,风干载玻片1 min;(11)结果判读:观察MmuPV1E4 转录本在感染增生组织中的表达,棕色斑点判定为阳性信号。
2 结果
2.1 MmuPV1 感染尾部皮肤后外观性状
MmuPV1 病毒感染NU/NU 小鼠4 周左右,其中5 只小鼠即可见尾部皮肤出现小米粒大小增生;16周后可观察到,小鼠尾部出现高于皮面,圆形或不规则形状的乳头瘤样增生,并且伴有角化过度,表面粗糙(图1)。收集增生组织,HE 染色进行病理分析,组织学观察可见感染小鼠尾部皮肤表面鳞状上皮增生(图2A),棘层肥厚,在棘层和颗粒层出现空泡化细胞(图2B)。

图1 MmuPV1 感染16 周后的NU/NU 小鼠尾部Figure 1 Tail skin of MmuPV1 infected NU/NU mouse after 16 weeks
2.2 PCR 检测增生组织MmuPV1 DNA
MmuPV1 感染增生部位提取 DNA, 利用MmuPV1 E2 基因特异性引物扩增鉴定MmuPV1 表达97 bp 片段。利用感染MmuPV1 的小鼠尾部提取DNA 进行鉴定,结果表明均可检测到MmuPV1 DNA(图3)。
2.3 qRT-PCR 法检测增生组织病毒载量
制备 MmuPV1 病毒液按 1 ∶5与 PBS 稀释后进行过滤,又追加 200 μL PBS。取 5 μL 过滤后的病毒液提取DNA,利用实时定量PCR 方法检测感染病变组织中MmuPV1 的病毒载量,同样利用MmuPV1 E2基因进行定量。结果表明,感染小鼠尾部增生部位均可检测到病毒载量,该病毒提取物中每微升含有大于 1.3 × 108viral DNA copies,RNase-Free 水作为阴性对照(NC)(图4)。
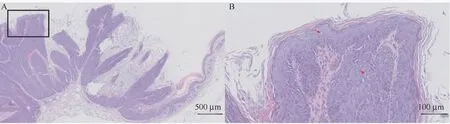
图2 MmuPV1 感染小鼠尾部病变组织学分析Figure 2 Immunohistochemical analysis of mouse tail hyperplasia by MmuPV1 infection

注:1 ~15:MmuPV1 感染小鼠尾部DNA 样本;16:pMusPV 质粒(阳性对照);17:未感染小鼠尾部DNA(阴性对照);18:水(空白对照);M:Trans 2 k Plus DNA Marker。图3 感染小鼠尾部MmuPV1 E2 基因PCR 鉴定Note. 1 ~15. Samples DNA from MmuPV1 tail infection. 16. pMusPV plasmid(Positive control). 17. DNA from the mock mice (Negative control). 18. Water (Blank control). M. Trans 2 k Plus DNA Marker.Figure 3 MmuPV1 DNA was analyzed by PCR on E2 gene from virus-induced mouse tails

图4 qPCR 法检测感染小鼠尾部病毒载量Figure 4 Vrial load in the MmuPV1-induced mouse tails by qPCR
2.4 RNA 原位杂交检测MmuPV1 E4 转录本
RNAscope 原位RNA 杂交技术可呈现单个细胞中RNA 分子原位的可视化及量化。因此本研究利用RNAscope 原位杂交检测MmuPV1 E4 转录本表达,因MmuPV1 E4 转录本存在于大多数乳头瘤病毒早期和晚期转录过程。用MmuPV1 E4 目的探针、阴性探针进行检测,出现棕色信号为探针结合RNA 分子,蓝色信号为细胞核。结果表明,目的探针MmuPV1 E4 杂交后可见明显的棕色斑点信号(图5A,B),而阴性对照则只有蓝色信号(图5C,D)。
3 讨论
乳头瘤病毒感染导致的相关疾病已成为世界范围内的主要问题。大多数HPV 型感染是良性的,但如HPV16、HPV18 等高危型HPV 可导致宫颈癌、皮肤癌、头颈鳞癌以及肛门生殖器癌症等恶性肿瘤。皮肤疣是因感染HPV 而导致的一种良性增生,儿童及青少年发病率较高,多发于手、面和足部,表现为圆形乳头状角化增生。目前的治疗方法主要以物理方法破坏疣体和手术切除,或者局部用药、免疫增强剂等治疗[12],但这些方法易复发、易感染,治疗时间久且治疗过程疼痛不适,使患者增加精神及经济负担,配合程度较差。HPV 属于自限性病毒,在HPV 感染、病变到致癌过程需经历数十年,而目前对于治疗中的给药途径及剂量无法系统评价,使得因HPV 感染而引起良性或恶性病变的患者尚无有效治疗方案[13]。因为HPV 感染具有严格物种特异性,前期科学家建立了棉尾兔乳头瘤病毒(CRPV)、多乳鼠乳头瘤病毒(MnPV1)等感染动物皮肤致病模型[14-15],但这些HPV 参比模型存在个体差异大,成本高和技术有限等问题,理想的感染动物模型的缺乏很大程度阻碍了HPV 感染致病机制及治疗手段的研究,因此,建立适合的动物模型进行该疾病的研究一直具有挑战性。
MmuPV1 最初是从 NMRI-Foxn1nu/Foxn1nu裸鼠中分离鉴定中分离得到,与皮肤型β-HPV 基因组更为相似,如HPV5 和HPV8 等皮肤型人乳头瘤病毒,与疣状表皮发育不良及免疫抑制患者的鳞状细胞癌有关。前期多个科研团队已利用MmuPV1 建立了尾巴,口腔周围、背部以及耳朵的多个小鼠品系感染模型[6,8,16-17]。因为免疫抑制患者更易感染而发展成疣或更高级病变,前期也有研究表明,T 细胞缺陷对病毒感染及进展至关重要。因此,建立了MmuPV1 感染裸鼠皮肤模型,显示其在尾部皮肤以及口腔周围皮肤(未发表)引起肉眼可见高出皮面的圆形丘疹,乳头瘤状外生性增生,角化过度,组织病理学分析发现空泡细胞,并可进展为高度鳞状上皮不典型增生,与人类感染HPV 引起的疣状病变相似。通过 PCR 可检测到 MmuPV1 DNA 以及利用qRT-PCR 检测到病毒载量,RNAscope 技术是在RNA 水平利用靶向特异性双Z 设计探针检测单链RNA 的原位杂交,解决了尚无MmuPV1 相应抗体检测及定量的问题,本模型利用RNA 原位杂交技术,在MmuPV1 感染小鼠尾部皮肤检测到明显的E4 转录本信号,即在增生部位可原位检测到乳头瘤病毒的存在。
多个科学家团队已证明,MmuPV1 具有广泛的组织嗜性[18],不仅可感染皮肤上皮细胞,也可感染HPV 性传播有关的部位,如女性与男性生殖器粘膜、肛门和口咽部位,头颈鳞癌等[11,17,19-22],这些结果与高危型HPV 非常相似。综上所述,MmuPV1 的发现为乳头瘤病毒多个领域的研究提供关键平台,其感染是模拟HPV 病毒潜伏期、病变形成以及控制感染等方面更为充分的临床前动物模型,有望改变我们对HPV 相关疾病的理解,并且帮助对HPV 相关疾病治疗方法的建立。
