我国18个省份猪源肠球菌耐药调查及分析
2021-05-20姚晓慧仝慧娴王舒丰魏建超邵东华邱亚峰马志永李蓓蓓夏利宁
姚晓慧,仝慧娴,王舒丰,魏建超,刘 珂,邵东华,邱亚峰,马志永,李蓓蓓,夏利宁
(1.新疆农业大学动物医学院,乌鲁木齐830052;2.中国农业科学院上海兽医研究所,上海200241)
肠球菌(Enterococcus)是革兰氏阳性兼性厌氧菌,对多种抗生素具有天然耐药和获得性耐药,是一种重要的人畜共患菌,是造成医院内感染的第二大病原菌[1-3]。近年来,随着临床抗菌药物的广泛使用,肠球菌对抗菌药物的耐药性和耐药种类不断增加,尤其是耐万古霉素肠球菌(vancomycin resistant Enterococcus,VRE)和氨基糖苷类高水平耐药肠球菌(high-level aminoglycoside resistant,HLAR)的出现,使得临床治疗的困难性进一步加大[4]。2017年2月,世界卫生组织将屎肠球菌列入重点病原体清单,以期在应对肠球菌对抗生素产生耐药性时作出有效指导[5]。
养殖场的动物源肠球菌耐药菌株可通过食物链传递给人,其耐药基因可在质粒等移动元件介导水平传播给其他病原菌,给人类健康和公共卫生带来威胁[6]。本研究系统地对我国18个省市的猪源肠球菌进行分离鉴定,并对其耐药性进行调查分析,为肠球菌耐药危害的风险评估和动物源耐药性的防控提供了一定的科学依据。
1. 材料与方法
1.1 菌株来源 2016年12月~2017年5月,自我国18个省市59个猪养殖场,用无菌拭子采集新鲜粪便,共836份样品,采样地点包括:新疆维吾尔自治区、青海省、四川省、贵州省、北京市、云南省、山西省、浙江省、辽宁省、福建省、海南省、黑龙江省、河北省、吉林省、江西省、山东省、河南省、上海市;标准菌株粪肠球菌ATCC29212、金黄色葡萄球菌ATCC29213均为本实验室保存。
1.2 药品与试剂 β-内酰胺类:氨苄西林(ampicillin)(AM);氨基糖苷类:阿米卡星(amikacin)(AMK);喹诺酮类:环丙沙星(ciprofloxacin)(CIP);酰胺醇类:氟苯尼考(florfenicol)(FFC)、氯霉素(chloramphenicol)(CHL);大环内酯类:红霉素(erythromycin)(ERY);四环素类:四环素(tetracycline)(TET)、米诺霉素(minomycin)(MI)、多西环素(doxycycline)(DOX);恶唑烷酮类:利奈唑胺(linezolid)(LZD);糖肽类:万古霉素(vancomycin)(VAN)。以上抗菌药物均购自上海源叶生物科技有限公司。
Mueller-Hinton肉汤、BHI肉汤、Mueller-Hinton琼脂、肠球菌培养基(叠氮钠-结晶紫-七叶苷琼脂)和柠檬酸铁铵均购自北京陆桥技术股份有限公司;细菌琼脂粉购自青岛高科园海博生物有限公司;1×TE缓冲液购自生工生物工程(上海)有限公司;DL2000 DNA marker购自天根生化科技(北京)有限公司;2×Taq PCR Master Mix、琼脂糖、50×TAE和核酸染料均购自上海翊圣生物科技有限公司。
1.3 分离及初步鉴定 将采集的样品置于1 mL 6.5%氯化钠BHI肉汤中,42℃、200 rpm培养18~24 h,用无菌接种环划线接种于肠球菌培养基平板上,37℃倒置培养18~24 h,选取平板表面呈白色圆滑、凸起、大小适中且菌落周围显黑色的单一菌落增菌后,制成20%甘油菌,-20℃保存备用[7]。
1.4 基因组制备 将初步鉴定的肠球菌单菌落接种于1 mL BHI培养基中,37℃、200 rpm培养过夜,吸取200 μL菌液13 201×g离心1 min,弃上清液;加500 μL 1×TE缓冲液震荡混匀,13 201×g离心1 min,弃上清液;加200 μL 1×TE缓冲液震荡混匀,沸水煮2 min,冰浴2 min;17 968×g离心5 min,取上清液(60~80 μL即可)做DNA模板,-20℃保存备用。
1.5 引物合成 根据文献[7]已有序列合成引物,对初步鉴定分离出的肠球菌扩增屎肠球菌(E. faecium)、粪肠球菌(E. faecalis)、鹑鸡肠球菌(E. gallinarum)及铅黄肠球菌(E. casseliflavus)的持家基因。对未鉴定出的肠球菌用16S rRNA扩增后送测序,并对测序结果进行比对以确定种属。引物均由上海英俊生物有限公司合成,见表1。

表1 本研究所用引物Table 1 Primers used in this study
1.6 药敏试验 按照CLSI[8]推荐的琼脂稀释法,对分离的肠球菌菌株进行11种抗菌药物的最小抑菌浓度(minimum inhibitory concentration,MIC)测定。以粪肠球菌ATCC29212和金黄色葡萄球菌ATCC29213作为质控菌株。MIC结果均按照CLSI发布的M100-S26(2016)抗微生物抗菌药物敏感性试验的标准执行。氟苯尼考因目前尚无肠球菌MIC值的判定标准,故采用CLSI[9]发布的VET01-A4中猪源链球菌氟苯尼考的判定标准。结果以敏感(S)、中介(I)、耐药(R)3种形式表示。
2 结果
2.1 猪源肠球菌分离结果 通过对初步鉴定分离出的肠球菌进行屎肠球菌(E. faecium)、粪肠球菌(E.faecalis)、鹑鸡肠球菌(E. gallinarum)的持家基因扩增,电泳结果均与预期片段大小符合(图1)。对未鉴定出的肠球菌用16S rRNA扩增后送测序,对测序结果进行比对以确定种属。

图1 肠球菌持家基因PCR扩增结果Fig.1 Amplification of Enterococcus housekeeping gene by PCR
836份样品中共分离到225株肠球菌(表2),其中屎肠球菌106株,占肠球菌总数量的47.1%;粪肠球菌共56株,占肠球菌总数量的24.9%;小肠肠球菌共34株,占肠球菌总数量的15.1%;鹑鸡肠球菌共17株,占肠球菌总数量的6.2%;铅黄肠球菌7株,坚忍肠球菌4株,Enterococcus thailandicus1株。

表2 我国18省市猪源肠球菌分离结果Table 2 The isolation of Enterococcus spp. of pig origin from 18 provinces in China
从我国不同省市猪源肠球菌的分离结果可知,分离率普遍不超过50%。肠球菌分离率由高到低的猪养殖场所在地依次为贵州省、青海省、云南省、上海市、河北省、江西省、北京市、新疆维吾尔自治区、山东省、福建省、四川省、吉林省、河南省、浙江省、海南省、辽宁省、黑龙江省、山西省,其中贵州省、四川省、福建省、河北省、上海市猪养殖场分离的肠球菌种类较多。
2.2 225株猪源肠球菌的药敏试验结果 对分离出的猪源肠球菌进行11种抗菌药物的耐药检测(图2),猪源肠球菌除对万古霉素和利奈唑胺不耐药外,对其他抗菌药物均呈现不同程度的耐药。猪源肠球菌对阿米卡星、氟苯尼考、红霉素、四环素、米诺环素和多西环素的耐药率分别是94.7%(213/225)、88.4%(199/225)、86.2%(194/225)、98.2%(221/225)、88.9%(200/225)、89.3%(201/225),6种抗菌药物的耐药率平均高达91%。对环丙沙星的耐药率为63.1%(142/225),对氨苄西林的敏感率为66.2%(149/225),对利奈唑胺的中介率达54.7%(123/225),对万古霉素高度敏感。由图3可知,我国18个省市的猪源肠球菌多药耐药菌株主要集中在6耐、7耐和8耐,共占肠球菌总数的72.9%(164/225)。肠球菌在5耐及5耐以下的耐药菌株共占肠球菌总数的15.5%(35/225),对9种抗菌药物均耐药的肠球菌菌株有26株,占肠球菌总数的11.6%。
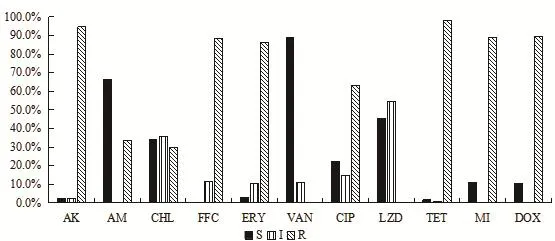
图2 猪源肠球菌对11种抗菌药物的耐药结果Fig.2 Resistance rates of 11 tested antibiotics for Enterococcus isolates of pig origin
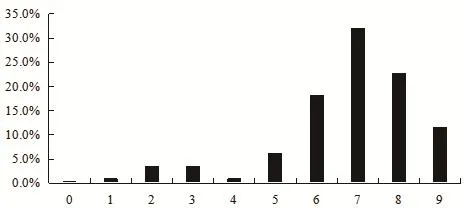
图3 猪源肠球菌多药耐药谱Fig.3 Multi-drug resistance patterns of Enterococcus isolates of pig origin
2.3 猪源不同肠球菌属对11种抗菌药物耐药情况分析 整体来看,我国18个省市猪源不同肠球菌属中的粪肠球菌(57株)、屎肠球菌(106株)、小肠肠球菌(34株)对除利奈唑胺和万古霉素不耐药外,对其余9种测试抗菌药物均显示不同程度的耐药(图4)。粪肠球菌、屎肠球菌、小肠肠球菌均对阿米卡星、氟苯尼考、红霉素、四环素、多西环素、米诺环素6种抗菌药物的耐药情况没有明显差异,耐药率在80%以上。屎肠球菌对氨苄西林的耐药率明显高于其他两种肠球菌的耐药率,对环丙沙星耐药率高于小肠肠球菌的耐药率。粪肠球菌对氯霉素的耐药率高于其他两种肠球菌的耐药率。
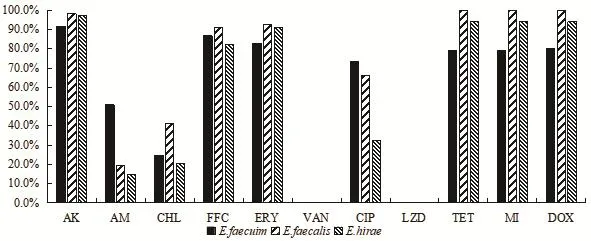
图4 猪源不同肠球菌对11种抗菌药物的耐药结果Fig.4 Resistance of 11 tested antibiotics for di ff erent Enterococcus isolates of pig origin
3 讨论
肠球菌与大肠杆菌都是人和家畜肠道常在菌,肠球菌的天然耐药和易获得性耐药使其成为耐药基因的储存库,是研究细菌耐药的重要菌群[10-11]。
从本研究中猪源不同肠球菌属分离结果可以看出,屎肠球菌的分离率最高;从不同省市猪养殖场分离的肠球菌结果来看,屎肠球菌的分离率也是较高的,这说明在被检猪养殖场的肠球菌中主要分布的是屎肠球菌,其感染率较高,与刘晓薇等[12]的报道相符合。
本研究的药敏结果表明,猪源肠球菌对检测的11种抗菌药物存在不同程度的耐药。除万古霉素和利奈唑胺外,对其余9种测试抗菌药物均有不同程度的耐药。其中,不同肠球菌属对四环素类的3种抗菌药物均有较高的耐药率,高达80%以上,与幸文定[13]和吴帆等[14]报道的猪源肠球菌对四环素类抗菌药物的耐药结果相似。分析其原因可能是多年来由于四环素类的广泛应用,临床常见革兰阳性菌病原菌对四环素多数耐药,并且,同类品种之间存在交叉耐药。肠球菌对红霉素抗菌药物的耐药率(86.2%)偏高,与陈丽颖等[15]报道的猪源肠球菌对红霉素的耐药率(84.62%)相近。
值得庆幸的是,本研究中未检出对万古霉素耐药的菌株,但猪源肠球菌对万古霉素的中介率为11.1%,养殖场应持续对万古霉素的耐药性进行监测并及时做出相应措施。猪源肠球菌对氯霉素的耐药率(29.8%)最低,这个结果可能与氯霉素被禁止用于食品动物有关。值得注意的是,猪源肠球菌对利奈唑胺的中介率约达60%,利奈唑胺作为治疗VRE和MRSA的最后一道防线,若不对使用剂量加以控制,可能会造成“无药可用”的境地[15-16]。
多药耐药结果显示,本研究中肠球菌的耐药水平普遍较高,耐药谱型较广泛,最多可耐9种抗菌药物,说明养殖场多局限于使用相对固定的几种药物,未能根据细菌的耐药情况及时做出调整,长期如此使用可导致多重耐药菌株的产生。
综上所述,我国18个省市猪养殖场分离的肠球菌对常见抗菌药物耐药率较高,耐药率较高的几类抗菌药物分别是四环素类、大环内酯类、氨基糖苷类,其耐药基因可传播给人或其他动物,造成人类健康和公共卫生的潜在威胁。因此,肠球菌的耐药调查应引起更多关注,做好长期监测工作,严格控制抗菌药物的使用,以达到最好的治疗效果和减少新的耐药菌株的产生。
