微塑料对大型溞摄食和抗氧化防御系统的影响
2021-05-20高嘉蔚赵莎莎李富云杨小满熊安琪李锋民
高嘉蔚, 赵莎莎, 李富云, 杨小满, 张 静, 熊安琪, 李锋民,3*
1.中国海洋大学环境科学与工程学院近海环境污染控制研究所, 山东 青岛 266100
2.中国海洋大学,海洋环境与生态教育部重点实验室, 山东 青岛 266100
3.青岛海洋科学与技术试点国家实验室, 海洋生态与环境科学功能实验室, 山东 青岛 266071
塑料由于价廉、质轻、耐用等特性,在包装业、建筑业、汽车制造业等多个领域得以广泛生产和使用[1],2019年全球塑料年产量达3.68×108t[2]. 随着塑料的大量生产和使用,导致大量塑料垃圾因管理不善进入自然环境[3],经过漫长的分解最终形成微塑料(Microplastics, MPs)[4]. 微塑料是指尺寸小于5 mm的塑料碎片或颗粒,大量野外调查发现全球范围内不同水域中均有微塑料污染现象[5-7];同时,水体中的生物也受到了微塑料的污染,野外采集的鱼类[8]、贝类[9]等生物体中也观察到微塑料的残留. 微塑料被水生生物摄入后不仅阻塞消化道,产生饱腹感[10],还导致其摄食和行为能力下降,体内能量储备减少从而影响其生长,甚至导致死亡[11-12]. 由于水生生物对微塑料的摄入、累积和营养传递作用,可能导致微塑料最终通过水产品等方式进入人体并危害其健康[13-14]. 因此,微塑料的生态风险及其对人体健康的威胁引起了国内外高度关注[15].
大型溞(Daphniamagna)属于浮游甲壳类动物,常被用作水生生物毒理学研究的标准测试生物[16],作为淡水水体中广泛存在的浮游动物,又是鱼类等养殖动物幼苗期的主要饵料,因此其在水生食物链中占重要地位. 由于部分微塑料的尺寸接近大型溞饵料生物的大小,一定尺寸和形状的微塑料可以被大型溞摄入[12,17-18],造成大型溞消化道堵塞、摄食率降低[18-19],引起运动抑制,甚至导致其死亡[20]. MA等[21]研究发现,仅50 nm的微塑料对大型溞表现出显著的生物毒性和物理损伤,而微米级塑料颗粒仅能被大型溞摄入并从体内排出而没有物理损伤. 而Rehse等[20]研究表明,1 μm的微塑料会导致大型溞固定化. 巩宁等[22]则认为2、20和50 μm聚乙烯微粒均可在大型溞肠道中积累,造成大型溞的运动抑制. 微米尺寸的微塑料能否对大型溞的摄食产生影响仍不明确,因此不同尺寸的微塑料对大型溞摄食的影响有待进一步研究.
该研究选用3种粒径(100 nm、5 μm、50 μm)的聚苯乙烯(Polystyrene, PS)微塑料,通过暴露和净化试验测定不同尺寸微塑料在大型溞体内的积累量和停留量,探究微塑料对大型溞滤水率和摄食率的影响,分析微塑料对大型溞体内超氧化物歧化酶(Superoxidase dismutase, SOD)和过氧化氢酶(Catalase, CAT)活性以及丙二醛(Malondialdehyde, MDA)含量的影响,以期为进一步揭示微塑料对大型溞的毒性效应提供基础资料,为评价微塑料的环境毒理效应和生态风险提供科学依据.
1 材料与方法
1.1 试验材料
微塑料购于天津倍思乐色谱开发技术中心,粒径分别为100 nm、5 μm、50 μm,浓度均为25 g/L,激发波长和发射波长分别为488和518 nm. 大型溞(Daphniamagna)购于青岛农业大学,用2 L的玻璃烧杯在恒温光照培养箱(GXZ-500B-LED型,宁波江南仪器厂)中培养,光暗比为16 h∶8 h. 培养基为配置的标准稀释水[23],水温为(20±1)℃,pH为7.8±0.2,溶解氧含量在80%以上. 每天喂食蛋白核小球藻(Chlorellapyrenoidsa)1次,藻细胞密度为6×105个/mL.
1.2 研究方法
1.2.1微塑料在大型溞体内的积累和停留
微塑料在数控超声波清洗器(KQ-500DE型,昆山舒美超声仪器有限公司)中超声预处理15 min (120 W)以确保微塑料颗粒在体系中更好地分散. 用超纯水将3种粒径的微塑料浓度分别稀释到0、0.5、1.0、3.0、5.0、10、20、40 mg/L,测定不同浓度微塑料的吸光度. 拟合微塑料浓度-荧光强度的标准曲线,得出相应线性回归方程以计算大型溞体内微塑料含量.
暴露试验设置5个微塑料暴露组(微塑料浓度分别为0.2、2、10、20、40 mg/L)和1个对照组(不添加微塑料),每个处理组3个平行. 微塑料暴露组设置6个取样时间(2、4、8、12、24、48 h),不同取样时间的烧杯中均放入20只健康活泼、大小相近的大型溞,每个烧杯含有80 mL微塑料溶液,取样时烧杯中的大型溞全部取出. 整个试验过程中烧杯封口以避免污染和水分蒸发,在封口膜上扎小孔保证气体交换,试验期间不喂食也不更换培养液. 按照上述微塑料暴露体系,大型溞在微塑料溶液中暴露8 h后取出,用超纯水冲洗3次转移到不含微塑料的培养基中,使大型溞排泄体内的微塑料,期间不喂食,8 h后测定大型溞体内的微塑料含量.
微塑料处理组的大型溞用超纯水冲洗3次以去除黏附在体表的微塑料,吸干水分进行称重,用超声波细胞破碎仪(JY92-IIN型,宁波新芝生物科技股份有限公司)进行组织匀浆(15 min,250 W,破碎10 s暂停10 s循环进行)使其充分研磨. 在每个烧杯中加入30 mL 100 g/L KOH溶液,在数显恒温水浴锅(HH-6型,常州国华电器有限公司)中60 ℃下消解72 h以彻底消解有机质,消解方法对微塑料荧光强度无影响[24],整个消解过程中烧杯封口以避免污染,冷却至室温后用超纯水定容至100 mL,测定消解溶液中微塑料的荧光强度并根据标准曲线计算微塑料在大型溞体内的含量.
1.2.2微塑料对大型溞摄食率和滤水率的影响
摄食试验分为3组,分别为对照组(不添加微塑料)、微塑料暴露组(100 nm、5 μm、50 μm)和无大型溞对照组,对照组的每个烧杯中分别加入20只大型溞;微塑料暴露组中3种粒径微塑料暴露浓度均为10 mg/L,每个烧杯中分别加入20只大型溞;无大型溞对照组中3种粒径微塑料暴露浓度均为10 mg/L,计算大型溞滤水率的校正因子需通过无大型溞对照组求得. 3个处理组的玻璃烧杯(200 mL)中分别加入160 mL蛋白核小球藻的藻液,初始密度均为6×105个/mL,每个处理组3个平行. 将大型溞置于恒温光照培养箱中黑暗培养,温度为(20±1)℃,5 h暴露试验结束后,在试验体系中加入鲁格试剂,将蛋白核小球藻固定,摇匀后取样在显微镜下采用血球计数板计数.
1.2.3微塑料对大型溞抗氧化防御系统的影响
将在微塑料中暴露24 h的大型溞(20只)取出,用超纯水冲洗3次,用滤纸吸干水分并称重,V(大型溞)∶V(生理盐水)=1∶9,在冰水浴条件下超声破碎15 min (250 W,破碎10 s暂停10 s循环进行)进行机械匀浆,匀浆液在高速冷冻离心机(HC-3018R型,安徽科大创新股份有限公司)中离心10 min (4 ℃,12 000 r/min),取上清液测定SOD活性、CAT活性、MDA含量.
1.3 分析测试方法
1.3.1微塑料荧光强度的测定
利用荧光分光光度计(F-4600型,日立高新技术公司)进行荧光强度的测定,测定前用超纯水进行调零. 测定模式为荧光模式,激发波长和发射波长分别设定为488和518 nm. 100 nm、5 μm、50 μm微塑料的线性回归方程分别为y=1.064 3x+0.449 1(R2=0.998 3)、y=1.871 0x+0.562 5(R2=0.997 4)和y=3.484 5x-0.486 1(R2=0.990 6),定量范围为0~40 mg/L.
1.3.2大型溞滤水率和摄食率的计算
参照文献[25]方法计算每只大型溞的滤水率(即大型溞在单位时间内平均过滤的试验溶液的体积)和摄食率(即大型溞在单位时间内平均摄取的蛋白核小球藻细胞数量),计算公式:
(1)
(2)
(3)
式中:F为大型溞的滤水率,mL/(只·h);V为试验中所用溶液的体积,mL;n为每个平行的处理组中大型溞的数量,只;C0为初始的蛋白核小球藻细胞密度,个/mL;Ct为被大型溞摄食后的蛋白核小球藻细胞密度,个/mL;t为暴露时间,h;A为校正因子;Ct′为无大型溞对照组暴露于微塑料后的蛋白核小球藻细胞密度,个/mL;I为大型溞的摄食率,个/(只·h).
1.3.3大型溞抗氧化防御系统的测定
采用考马斯亮蓝法测定大型溞蛋白含量,采用黄嘌呤氧化酶法和可见光法分别测定SOD和CAT活性[26],采用硫代巴比妥酸比色法测定MDA含量[27].
蛋白含量计算公式:
(4)
式中:Dprot为蛋白含量,g/L;ODc为试验组样品的吸光度;ODb为标准品的吸光度;OD0为空白组样品的吸光度;0.563为蛋白标准品的质量浓度,g/L.
SOD、CAT活性和MDA含量的计算公式:
(5)
(6)
(7)
式中:ESOD为SOD活性,以每mg组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量计,U/mg;ECAT为CAT活性,以每mg组织蛋白1 s分解1 μmol H2O2的量计,U/mg;EMDA为MDA含量,以每mg组织蛋白质中含有的MDA量计,nmol/mg;ODd为对照组样品的吸光度.
1.4 统计分析方法
采用SPSS 19.0软件进行数据分析,使用单因素方差分析(ANOVA)检验比较试验组和对照组之间的差异,P<0.05表示显著性差异. 使用Excel 2016软件进行绘图.
2 结果与分析
2.1 微塑料在大型溞体内的积累和停留
由图1可见,暴露2 h后50 μm的微塑料主要黏附在大型溞体内具有食物过滤能力的胸肢处,少量进入到肠道中,而100 nm和5 μm的微塑料能在大型溞肠道中大量积累,表明微塑料在大型溞体内的积累部位与粒径大小有关. 由图2可见,当微塑料浓度为10 mg/L时,暴露8 h后100 nm和5 μm微塑料在大型溞体内的积累量分别为(6.48±0.08)和(4.37±0.15)mg/g,而50 μm的积累量仅为(0.37±0.04)mg/g. 所有浓度微塑料暴露组均发现,50 μm的微塑料在大型溞体内的积累量明显少于100 nm和5 μm的微塑料,即粒径越小积累量越高,说明粒径大小会导致微塑料在大型溞体内积累量的差异. 此外,3种微塑料在大型溞体内的积累量均在暴露后第8天达到最大值,且最大积累量随微塑料暴露浓度的增加而增大.
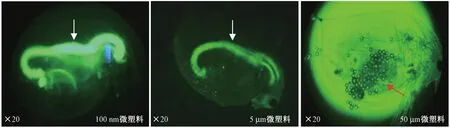
注: 白色箭头所指位置为肠道,红色箭头所指位置为胸肢.

注: 不同小写字母表示处理组间的显著性差异,P<0.05,下同.
大型溞暴露于不同浓度的微塑料8 h后转入不含微塑料的培养基中净化8 h,大型溞体内微塑料的停留量如图2所示. 由图2可见:100 nm和5 μm微塑料暴露组中,微塑料的停留量均随微塑料浓度的增加而增加;而50 μm微塑料暴露组中,微塑料的停留量不随微塑料浓度变化而变化. 相同浓度的微塑料暴露组中,小粒径的停留量高于大粒径,如微塑料浓度为2 mg/L时,100 nm和5 μm微塑料在大型溞体内的停留量分别为(0.48±0.04)和(0.25±0.06)mg/g,而50 μm微塑料的停留量为(0.09±0.005)mg/g.
2.2 微塑料对大型溞摄食率和滤水率的影响
由图3可见,除100 nm微塑料暴露组对大型溞的摄食率没有显著影响外,其他暴露组中大型溞的滤水率和摄食率均显著低于对照组(无微塑料). 暴露于3种粒径的微塑料后,大型溞的滤水率较对照组平均降低了50.7%±9.5%,摄食率平均降低了39.2%±10.7%,说明微塑料的暴露降低了大型溞的滤水率和摄食率. 100 nm微塑料暴露组中大型溞的滤水率和摄食率较对照组分别降低了39.8%±2.4%和26.9%±1.8%,5 μm微塑料暴露组中分别降低了57.8%±2.7%和45.9%±2.9%,50 μm微塑料暴露组中大型溞的滤水率和摄食率与5 μm微塑料暴露组相近. 大粒径(5和50 μm)的微塑料对大型溞滤水率和摄食率的抑制作用要强于小粒径(100 nm)的微塑料,说明较大粒径的微塑料对大型溞摄食能力的影响更严重.
2.3 微塑料对大型溞抗氧化防御系统的影响

图3 微塑料对大型溞滤水率和摄食率的影响
注:*代表微塑料暴露组与对照组(微塑料浓度为0)有显著性差异,P<0.05,下同.
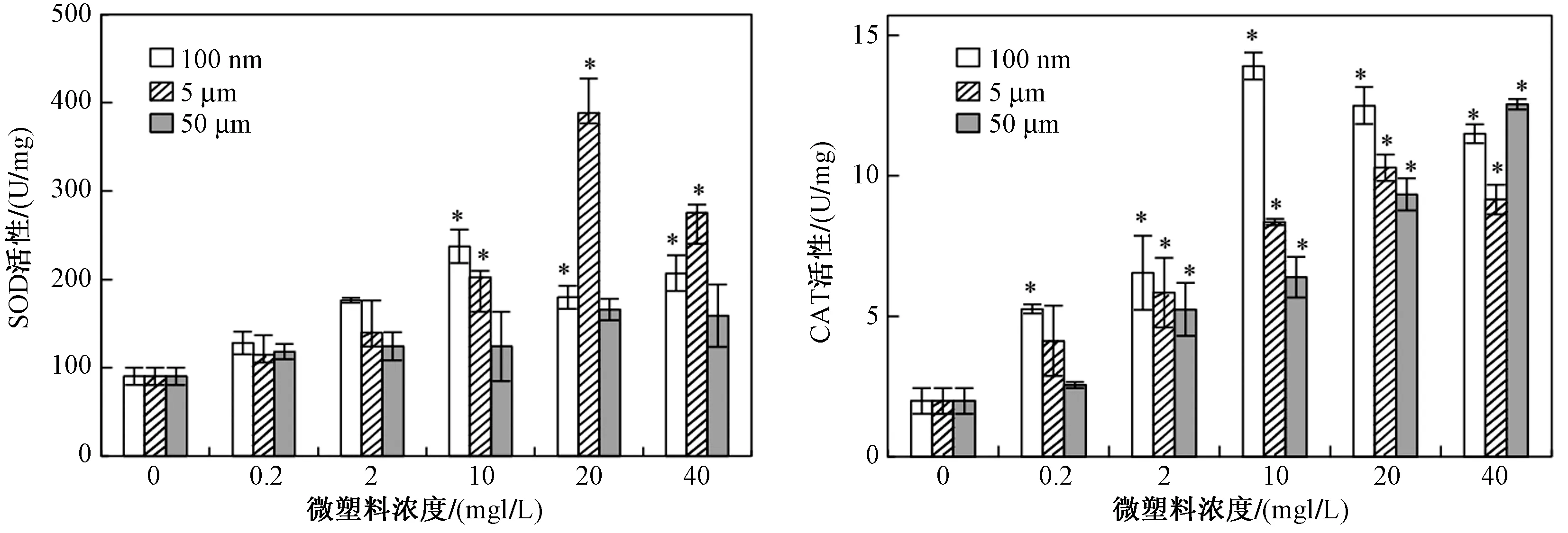
微塑料对大型溞体内SOD、CAT活性的影响如图4所示. 由图4可见,高浓度(10、20、40 mg/L)100 nm和5 μm的微塑料暴露组对大型溞体内SOD活性有显著促进作用,而各浓度50 μm微塑料暴露组大型溞体内的SOD活性水平均无显著差异,表明微塑料粒径越小对大型溞抗氧化防御系统的影响越大,越容易诱导大型溞体内细胞氧化胁迫. 3种粒径微塑料的CAT活性均有显著变化,对于100 nm微塑料暴露组,当微塑料浓度为0.2 mg/L时,就对大型溞体内CAT活性〔(5.26±0.16)U/mg〕具有显著的促进作用,而5和50 μm微塑料浓度大于2 mg/L时会显著促进CAT活性.
100 nm和5 μm微塑料暴露组中微塑料对大型溞体内SOD、CAT活性的影响均呈低浓度促进高浓度抑制的特征,SOD和CAT活性均随微塑料浓度的增加呈先升后降的趋势. 对于100 nm微塑料暴露组,当微塑料浓度增至10 mg/L时,大型溞体内SOD、CAT活性均达到最大值〔(237.44±18.90)和(13.91±0.48)U/mg〕,随后逐渐降低. 低浓度微塑料可以诱导酶活性的升高,而当微塑料浓度过高时会造成细胞损伤进而抑制SOD、CAT的活性. 与SOD活性相比,不同浓度的微塑料均能够诱导CAT活性的升高,较低微塑料浓度(0.2 mg/L)下CAT活性已有显著变化,说明CAT活性抗氧化响应较快.
暴露24 h后,3种粒径的微塑料均能诱导大型溞体内MDA含量升高(见图5),说明微塑料暴露会引起大型溞产生脂质过氧化反应,造成氧化损伤. MDA水平随微塑料暴露浓度的增加而升高,存在明显的剂量-效应关系. 在高浓度(10~40 mg/L)微塑料暴露组中,3种粒径的微塑料诱导大型溞体内MDA含量均显著增加,而低浓度(0~2 mg/L)微塑料暴露组中促进效果不显著.

图5 不同粒径微塑料对大型溞MDA含量的影响
3 讨论
3.1 微塑料对大型溞摄食的影响
由于微塑料的尺寸在大型溞摄食的适口范围内,所以很容易被大型溞摄入[12,28]. 该研究发现,粒径的大小会影响微塑料在大型溞体内的积累部位,100 nm和5 μm的微塑料接近大型溞饵料的大小,因此能在大型溞肠道中大量积累,而尺寸较大的50 μm微塑料则被胸肢上的滤器拦住,因此主要黏附在胸肢处. 在斑马鱼的研究中也发现这一现象,0.07和5 μm的微塑料可以在斑马鱼的肝脏中积累,而20 μm的微塑料只能在鳃和肠道中积累[11]. 微塑料在大型溞体内的积累量与粒径也明显相关,粒径越小积累量越高. 一方面是因为在相同浓度下,粒径越小的微塑料数量越多,增加了被大型溞摄入的机会,导致积累量更高;另一方面可能是由不同尺寸微塑料在水中的空间分布差异导致的,有研究[20]表明100 μm的聚乙烯颗粒容易漂浮在水表面,而1 μm的颗粒悬浮在水中,悬浮在水中的微塑料可能容易被大型溞摄入,导致积累量较高. 此外,微塑料在大型溞体内的积累量还受浓度的影响,Canniff等[29]研究表明,随微塑料暴露浓度的增加,大型溞对微塑料的摄入量增大,与笔者研究结果一致,大型溞对3种微塑料的最大积累量随微塑料暴露浓度的增加而增大.
经过8 h的净化试验发现,微塑料可以在大型溞体内停留,在藤壶[13]和轮虫[30]等动物中均发现了类似的现象. 由于100 nm和5 μm的微塑料通过肠道才能排出体外,而50 μm的微塑料主要黏附在胸肢处,在净化过程中胸肢上的刚毛清除了附着在滤器上的不能利用的大颗粒,因此50 μm的微塑料停留量不随暴露浓度变化而变化. 同一浓度微塑料暴露组中,小粒径的停留量高于大粒径,一方面是因为大粒径的微塑料积累量较低;另一方面,与小粒径相比,大粒径微塑料能更快地被大型溞排出体外[31].
Rist等[17]研究表明,暴露在聚苯乙烯微球(粒径0.1 μm,浓度为1.5×106个/mL)中的大型溞其摄食率比对照组降低了20.5%. 笔者研究结果略高于上述数值,在暴露5 h时,100 nm微塑料暴露组中大型溞摄食率比对照组(无微塑料)降低了26.9%±1.8%,可能是因为Rist等[17]研究暴露时间为24 h,随着暴露时间的增加,大型溞会将体内的微塑料逐渐排出,摄食能力不断恢复,达到相对稳定的状态. 对于滤食性动物大型溞,其适口饵料的大小一般在20 μm 以下,50 μm的微塑料超过其适口范围,因此在过滤食物过程中被胸肢上的滤器拦住,黏附在胸肢处,造成食物过滤器损伤,影响大型溞正常摄食,进而降低其滤水率和摄食率. 5 μm的微塑料接近蛋白核小球藻的尺寸,更容易干扰大型溞的摄食选择,被大型溞摄入后在消化道内积累,导致大型溞消化道堵塞、食欲降低[12],因此对滤水率和摄食率的影响较为明显.
3.2 微塑料对大型溞抗氧化防御系统的影响
微塑料暴露导致大型溞体内SOD和CAT活性水平均显著提高,SOD活性和CAT活性是对细胞中超氧化物自由基和过量过氧化氢的生化反应,表明微塑料可诱导细胞激活抗氧化防御系统以对抗氧化应激. 由于微塑料在大型溞体内的积累和停留导致正常摄食受阻,摄食率降低会引起氧化应激酶的变化[32],因此SOD和CAT活性升高. 该研究结果显示,微塑料粒径越小对大型溞抗氧化防御系统的影响越大,其中100 nm的微塑料在各浓度下对大型溞体内CAT活性均有显著的促进作用. 与微米级的微塑料相比,纳米塑料的尺寸更小,更有可能转移至大型溞的组织和细胞,对大型溞的氧化损伤更大[33]. HUANG等[34]研究发现,生物体在轻度逆境中SOD和CAT活性会相应升高,而当生物体处于严重逆境中时SOD和CAT活性反而会下降. YU等[35]在中华绒螯蟹的研究中也发现,暴露于低浓度(40和400 μg/L)聚苯乙烯微塑料的中华绒螯蟹体内SOD活性增加,但随着浓度的增大,SOD活性水平随之降低. 笔者研究也发现类似现象,随着微塑料浓度的增加,大型溞SOD活性和CAT活性均呈先升后降的趋势.
MDA作为脂质过氧化的产物,间接反映细胞的损伤程度. 有研究[36]报道,微塑料的存在会诱导鱼类出现氧化损伤,增加鱼类体内的MDA含量. 该研究中微塑料诱导大型溞产生氧化应激,破坏了细胞内的氧化和抗氧化系统的平衡,引起细胞内发生脂质过氧化反应,导致脂质过氧化产物MDA含量增加,造成氧化损伤[27];同时,微塑料暴露组的MDA含量显示出明显的剂量依赖性增加,而且微塑料达到一定浓度时才会显著影响MDA水平,可能是因为随着微塑料浓度的升高,大型溞体内ROS含量不断增高,超出了抗氧化酶SOD和CAT的清除能力,进一步加剧脂质过氧化程度. 抗氧化防御系统的破坏,会抑制大型溞的摄食行为[32],大型溞摄食能力下降导致体内能量储备减少从而影响其生长和存活.
4 结论
a) 微塑料在大型溞体内的积累部位与粒径大小有关;微塑料粒径越小、暴露浓度越高,微塑料在大型溞体内的积累量和停留量越高. 微塑料暴露显著降低了大型溞的滤水率和摄食率,与对照组相比分别降低了50.7%±9.5%和39.2%±10.7%,5 μm和50 μm的微塑料对大型溞滤水率和摄食率的抑制作用强于100 nm的微塑料.
b) 微塑料暴露导致大型溞体内SOD和CAT活性均升高,表现为低浓度促进高浓度抑制的特征;微塑料暴露还会诱导大型溞体内MDA含量升高,对大型溞造成氧化损伤.
