住院患者药源性粒细胞缺乏的风险预测模型的开发和验证:基于倾向性评分的病例对照研究
2021-05-20郭代红于承暄孔祥豪刘思源解放军总医院医疗保障中心药剂科北京00853重庆医科大学药学院重庆40006
朱 雨,郭代红,于承暄,孔祥豪,2,刘思源(.解放军总医院医疗保障中心药剂科,北京 00853;2.重庆医科大学药学院,重庆 40006)
中性粒细胞是白细胞的重要组成成分,对抵御外源性病原微生物起着至关重要的作用[1]。住院患者用药种类繁多,其中很多药品都有引起中性粒细胞减少的可能[2]。当中性粒细胞减少进展为粒细胞缺乏并引起发热时,患者发生致命性感染和死亡的风险都会增加[3]。应用粒细胞集落刺激因子(granulocyte-colony stimulating factors,G-CSF)可有效预防粒细胞缺乏及其并发症的发生,但随之也会加重患者经济等方面的负担[4]。因此,对粒细胞缺乏及其并发症的预测就显得至关重要。目前国内外指南仅对化疗患者进行了危险程度分层,国外已有多名学者针对特定肿瘤或者特定化疗方案构建了风险预测模型[5-6],国内也有化疗患者发生骨髓抑制的风险预测研究[7]。然而非化疗住院患者也有发生粒细胞缺乏的风险,住院患者用药情况也更加复杂。全药条件下住院人群发生药源性粒细胞缺乏的风险预测模型,更贴近临床实际情况,有利于高风险患者的识别以及药品不良反应(adverse drug reaction,ADR)的预防。
1 资料与方法
1.1 资料来源
借助我院研发的“临床药物不良事件主动监测与智能评估警示系统-Ⅱ”(adverse drug events active surveillance and assessment system-Ⅱ,ADE-ASAS-Ⅱ)[8],调取医院信息系统(hospital information system,HIS)中2019年10月 - 2020年10月期间114 351例住院患者信息,利用触发器原理识别研究者预先设置的报警指标,对满足条件的患者发出报警并提取保存患者信息,供研究者做进一步分析。研究者根据《药品不良反应报告和监测管理办法》相关评价标准判定ADR阳性病例。为了避免患者性别、年龄、体表面积(body surface area, BSA)及使用药品差异等混杂因素对实验结果的影响,在发生粒细胞缺乏的人群中和使用相同首要怀疑药品而未发生粒细胞缺乏的人群中,利用倾向性评分匹配(propensity score matching,PSM)按照1 : 2的比例对患者性别、年龄、BSA进行匹配(卡钳值0.05)。
1.2 定义、纳入与排除标准
系统报警规则为用药后发生粒细胞缺乏,定义为中性粒细胞绝对计数(absolute neutrophil count,ANC)< 0.5×109·L-1。纳入标准:年龄≥ 18岁。排除标准:①急性白血病;②HIV阳性患者;③用药前血液学检查指标缺失;④中性粒细胞基值异常;⑤合并脾功能亢进;⑥干细胞移植患者。
1.3 模型的开发与验证
按照70%和30%的比例将匹配后的病例和对照随机分为开发组和验证组。利用二元Logistic回归预测患者发生药源性粒细胞缺乏的概率并绘制列线图。
从模型的区分度和校准度两方面对模型进行验证。模型区分度使用受试者工作特征曲线(receiver operating characteristic curve,ROC)和曲线下面积(area under the curve,AUC)进行评价。模型的校准度使用校准曲线进行评价,并对实际发生情况与预测情况进行统计学检验。
1.4 统计学方法
定性资料采用数量和百分比表示,使用χ2检验或Fisher确切概率法检验。定量资料符合正态分布的以均值±标准差(standard deviation,SD)表示,使用t检验;不符合正态分布的以中位数和四分位间距(interquartile range,IQR)表示,使用Mann-Whitney U检验。将单变量Logistic回归中统计学差异显著的变量纳入多变量Logistic回归并使用向前LR法进行分析。将获取的独立影响因素用于模型开发。所有P值均为两侧,P< 0.05为统计学差异显著。使用Excel 2016、SPSS 25.0和R语言(3.6.2版)对数据进行分析处理。
2 结果
2.1 患者一般情况
114 351例住院患者中,系统报警可疑药源性粒细胞缺乏患者654例,经过人工评价后确定为阳性的患者共126例,住院人群中药源性粒细胞缺乏的发病率为0.11%。
药源性粒细胞缺乏的患者首要怀疑药品共有24种,其中占比较高的为异环磷酰胺、紫杉醇和环磷酰胺,分别为41.27%、20.63%和7.94%。见表1。病例、对照患者PSM匹配前患者年龄基线情况不同,匹配后患者性别、年龄及BSA基线情况均无显著统计学差异(P> 0.05)。见表2。
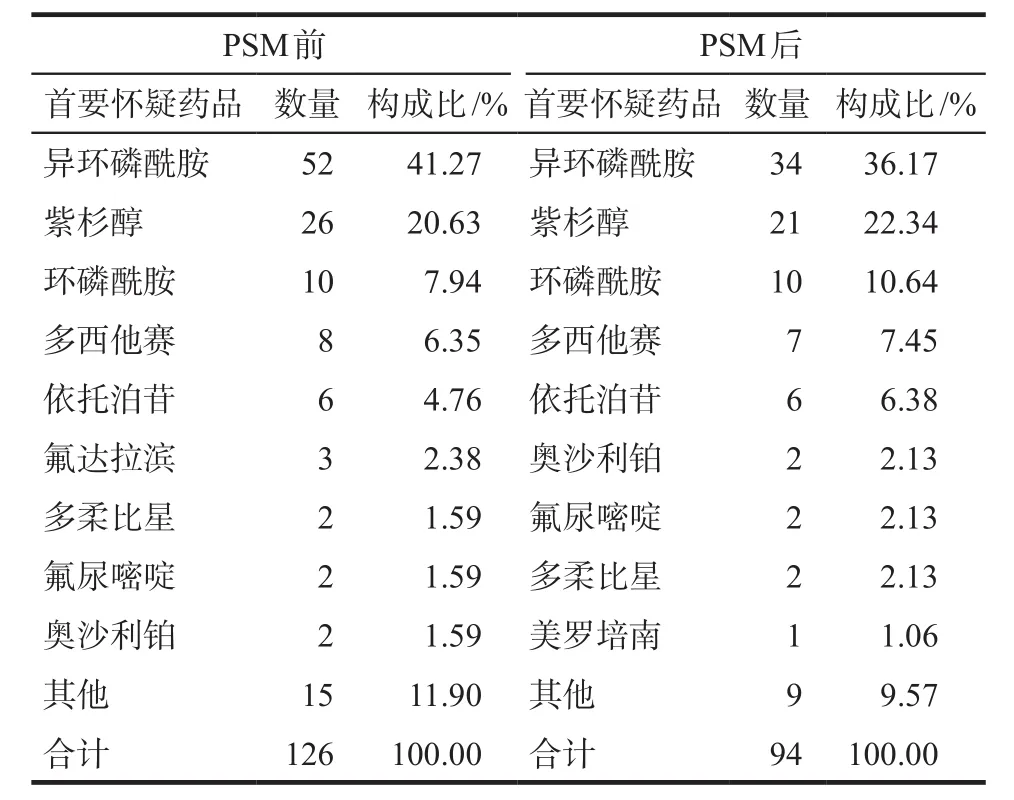
表1 病例组PSM前后首要怀疑药品分布Tab 1 Primary suspected drug distribution of the case group before and after PSM

表2 PSM前后患者特征Tab 2 Characteristics of patients before and after PSM
将PSM匹配后的患者按照70%和30%随机分为开发组(192例)和验证组(90例),两组患者原患疾病、合并症、化疗方案、合用化疗药、手术史、预防应用G-CSF及实验室检查等指标均无显著的统计学差异(P> 0.05)。开发组和验证组患者原患疾病均以肿瘤居多,且占比最高的均为实体瘤,分别占87.50% 和83.33%。心血管疾病为两组患者最常见的合并症,分别占16.67%和23.33%。两组患者联用超过2种化疗药的比例分别为41.67%和38.89%。开发组和验证组分别有5.73%和5.56%的患者住院期间或近1个月内接受过手术。两组患者预防性应用G-CSF比例均较低,分别为9.95%和13.33%。详见表3。

表3 开发组与验证组患者的一般情况Tab 3 General conditions of development group and validation group
2.2 模型的开发
对开发组患者的相关变量及实验室检查指标等进行单变量和多变量Logistic回归分析(见表4),单变量分析中具有统计学意义的有:首次入院治疗、KPS评分、合并用药≥10种、白细胞(WBC)基值< 4×109·L-1、淋巴细胞计数基值、淋巴细胞计数< 0.7×109·L-1和白蛋白(ALB)基值。多变量分析确定为独立影响因素的有:首次入院治疗(OR = 2.29,95%CI:1.05 ~ 4.99)、KPS评分(OR = 0.86,95%CI:0.79 ~ 0.93)和WBC基值< 4×109·L-1(OR = 3.54,95%CI:1.37 ~ 9.28)。将上述独立影响因素用于风险预测模型的开发并绘制列线图,详见图1。

图1 风险预测列线图Fig 1 Risk prediction nomogram
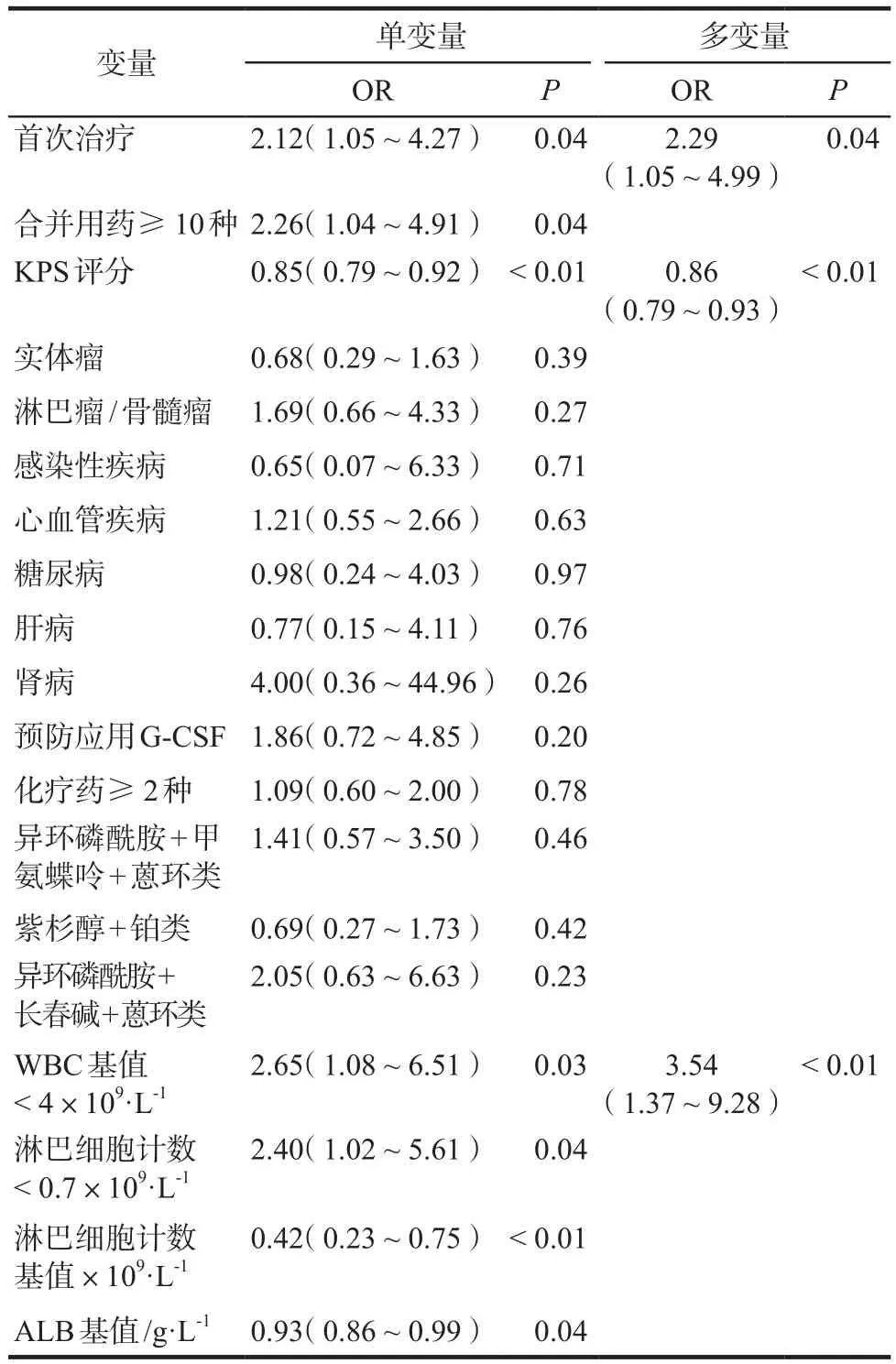
表4 单变量和多变量分析Tab 4 Univariate and multivariate analysis
应用举例:某患者,首次入院治疗,KPS评分90,WBC基值3.5×109·L-1。该患者得分为:17 + 27 = 44分,相应发生粒细胞缺乏的概率约为68%。见图2。

图2 风险预测列线图应用举例Fig 2 Application example of risk prediction nomogram
2.3 模型的验证
开发组和验证组AUC分别为0.70(95%CI:0.62 ~0.77)和0.67(95%CI:0.55 ~ 0.80)。开发组在30%预测概率时取得最佳灵敏度和特异度,分别为63.1%、70.9%。见图3。
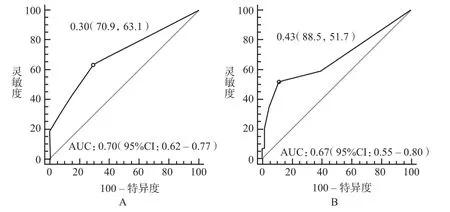
图3 开发组及验证组ROCA - 开发组,B - 验证组Fig 3 ROC of development group and validation groupA - development group, B - validation group
将两组预测概率与实际概率进行比较,绘制校准曲线,并进行检验,预测概率与实际概率差异不显著(P> 0.05)。见图4。
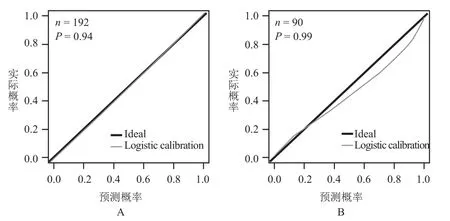
图4 开发组及验证组校准曲线A - 开发组,B - 验证组Fig 4 Calibration curve of development group and validation groupA - development group, B - validation group
3 讨论
3.1 流行病学特点分析
药源性粒细胞缺乏是一种剂量相关性ADR,患者往往因为粒细胞缺乏而减量、停药,直接影响到患者的治疗效果,严重者甚至会引起患者死亡[9]。因此早期识别药源性粒细胞缺乏并及时对症处理,有助于提高临床治疗效果,减轻患者负担。本研究借助ADE-ASAS-Ⅱ快速检索所有住院患者并对疑似的ADR病例发出报警,再由研究者进行人工评价确定阳性患者,较纯人工检索节省了时间成本[10]。有研究[11]显示,非化疗药物的粒细胞减少发病率约为每年5.02/百万人,且几乎涉及所有药品;而化疗引起的粒细胞缺乏发生率,据报道可高达50%[12]。真实世界中患者的联合用药情况往往更加复杂[13],但目前对于药源性粒细胞缺乏的研究多为随机对照研究、针对特定药品或者特定疾病患者的研究[14]。本研究监测了我院一年间114 351例住院患者,并最终获取药源性粒细胞缺乏阳性病例126例。该监测结果基本能够反映出全药条件下,住院患者发生药源性粒细胞缺乏的真实世界发生情况及特点。
3.2 患者一般情况分析
PSM可以根据相关变量指标在阳性和阴性人群中进行混杂偏倚的控制,使病例组和对照组具备较好同质性。由于PSM存在因无法匹配到同质对照而损失阳性病例的可能(本研究PSM前阳性126例,PSM后阳性90例),可以借助两组患者匹配指标基线情况的一致性,来减少混杂因素对结果的影响[15]。有研究显示,患者性别、年龄、BSA及使用药物不同均可能影响粒细胞缺乏的发生[16-18],所以我们应用PSM对使用相同首要怀疑药物的阴性患者上述指标进行了匹配,匹配前两组患者年龄基线不同,匹配后患者性别、年龄和BSA基线一致。
按照1∶2比例匹配对照后,两组患者共282例,按照70.0%和30.0%的比例随机分为开发组和验证组。开发组和验证组患者基线情况均无显著统计学差异(P > 0.05),两组患者原患疾病均以肿瘤为多,分别占97.9%和95.5%,这可能与抗肿瘤药大多具有细胞毒性,更易引起粒细胞减少有关[19]。两组患者使用G-CSF作为粒细胞缺乏一级预防的比例分别为9.95%和13.33%。Baig等研究者[4]指出在化疗患者中接受G-CSF一级预防治疗的患者比例在11.0% ~59.0%,尽管我院患者应用比例基本在上述区间范围内,但比例相对较低。分析可能原因如下:1)本研究并非所有患者均为肿瘤患者;2)一些传统中药被用于粒细胞缺乏的预防。
3.3 影响因素分析
对与患者自身条件相关、疾病相关以及治疗相关的变量和实验室检查结果进行Logistic回归分析,其中单变量分析中合并用药数量≥ 10种为粒细胞缺乏的风险因素。文献[20]报道认为其原因可能是由于潜在的药物相互作用、或潜在血液毒性的药物作用叠加所致。我们对患者合用化疗药物≥ 2种的情况进行回归分析,结果显示并没有显著统计学意义,还有待更大样本量来探究血液毒性药物叠加对粒细胞缺乏的影响。
多变量分析中发现较低的KPS评分、WBC基值都是粒细胞缺乏的独立危险因素,这与之前的研究结果一致[21]。此外,本研究还发现首次住院治疗也是一个独立风险因素;而文献也有报道初治化疗患者发生严重粒细胞减少的风险可高达70%[19]。但临床实践中,无论是化疗患者还是非化疗患者,在首次治疗发生粒细胞缺乏后,随后的治疗常会考虑减量、停药或者调整治疗方案,也可能是首次治疗相对后续治疗引起粒细胞缺乏风险更高的原因[22]。
3.4 模型的评价
将回归分析获得的独立影响因素用于建立药源性粒细胞缺乏模型后,需要对模型的区分度和校准度进行评价。AUC值用来阐明模型区别阳性事件和阴性事件的能力,AUC值介于0.5 ~ 1.0,0.5为完全随机,1.0为完全正确判别[23]。本研究开发组和验证组AUC值分别为0.70和0.67,具有较为满意的区分度。
模型的校准度采用校准曲线进行描述,开发组校准曲线(图4A)紧贴对角线,表示预测概率与实际观测概率一致性较好;对预测概率和实际概率进行统计学检验,差异不显著(P > 0.05)。尽管验证组校准曲线预测概率在0.4 ~ 0.8时可能会高估粒细胞缺乏的风险(图4B),但统计学检验差异不显著(P = 0.05)。
综上,通过信息化手段与人工评价结合,我们高效地获取了研究数据,开发并验证了全药条件下住院患者发生粒细胞缺乏的风险预测模型。经过验证,该模型具有良好的区分度和校准度;可以较好的预测患者发生粒细胞缺乏的风险,辅助医生进行决策,有效防控药品不良反应。
