微波-复合酶辅助提取海带多糖工艺优化及其抗氧化性能分析
2021-05-19聂小伟陈志兵顾晓慧王晓玲任召珍吴晴晴
聂小伟,陈志兵,顾晓慧,王晓玲,张 芹,任召珍,吴晴晴,王 磊
(威海海洋职业学院食品工程系,山东 威海 264300)
海带是一种药食同源的海洋巨藻,山东半岛是我国海带的主要产区[1-2]。目前,除少部分用于提取碘、甘露醇、海藻胶等产品深加工外,大部分以粗加工产品,如即食凉菜、盐渍、海带结和干制品为主,可以预见海带深加工将在我国具有巨大的发展潜力。而海带在加工过程中,会产生大量加工边角料,造成资源浪费。如何充分利用海带资源,提升其附加值,推动海带加工产业的健康发展,成为广大学者研究的热点。
研究表明,在海带细胞间和细胞内存在一类天然生物大分子物质——海带多糖(包括海带海藻酸、褐藻糖胶、昆布多糖等),从海带中分离出的海带多糖具有增强免疫力、抗癌和防癌等功效,同时在抗凝血、抗病毒、减肥、降血糖和降血脂等方面具有显著功效[3-7]。
目前,国内外学者提取海带多糖采用的主要方法有水提醇沉法、酸提法、碱提法、超声波法和酶解法等。水提醇沉法简单经济,但海带多糖提取率较低,并且长时间高温会导致海带多糖结构破坏[8];碱提法和酸提法易导致海带多糖降解,功能活性丧失[9-10]。而微波技术利用极性分子在电磁场中高速旋转特性,加速活性分子溶出,具有提取率高、耗能低、时间短等优势[11],在植物活性物质提取中得到广泛应用[12]。复合酶解法可针对植物细胞壁组成和结构,充分破坏植物细胞结构,条件温和,在海带多糖提取率显著提高的同时,可有效保护活性物质的结构和活性[13]。近年来,将微波辅助浸提技术和生物酶解技术结合是一种新型的破壁提取方法,与传统方法相比具有节能、快速、条件温和、提取效率高等优势,已广泛用于植物有效成分的提取[14]。
为改善现有海带多糖提取方法的操作时间长、提取率低等不足,本研究拟结合木瓜蛋白酶、果胶酶、纤维素酶的酶解条件温和、环保低能耗等特点与微波的高效节能等优势,采用微波-复合酶辅助提取海带加工下脚料的海带多糖,探求其最佳工艺条件,并对该方法获取的海带多糖体外抗氧化性能进行研究,旨在为海带多糖的提取研究提供新方法、新思路,为海带多糖的实际应用提供理论依据。
1 材料与方法
1.1 试剂与仪器
木瓜蛋白酶(酶活力为1×105U/g,下同)购自浙江多味化工食品有限公司;纤维素酶(1×105U/g)购自宁夏夏盛实业集团有限公司;果胶酶(6×104U/g)购自河南华锐化工产品有限公司;海带加工废弃物购自山东海之宝生物科技有限公司;柠檬酸(食品级)购自连云港科德食品配料有限公司;磷酸氢二钠(食品级)购自潍坊英轩实业有限公司;苯酚购自天津市瑞金特化学品有限公司;浓硫酸购自烟台市双双化工有限公司;2,4,6-三吡啶基三秦(TPTZ)、七水合硫酸亚铁、三羟甲基氨基甲烷、番红、1,1-二苯基-2-三硝基苯肼(DPPH)购自国药集团化学试剂有限公司。本研究所用分析化学试剂均为分析纯。
MAS-Ⅱ plus型常压微波合成/萃取反应工作站购自上海新仪微波化学科技有限公司,SHA-C型恒温振荡器购自常州国华电器有限公司,V-1800型可见分光光度计购自翔艺仪器(上海)有限公司,BT125D型电子分析天平购自赛多利斯科学仪器(北京)有限公司,SC-3612型低速离心机购自安徽中科中佳科学仪器有限公司,RE-3000型旋转蒸发仪购自上海亚荣生化仪器厂,SHB Ш型循环水式多用真空泵购自郑州长城科工贸易有限公司,DS-T300型高速多功能粉碎机购自上海顶帅电器有限公司。
1.2 样品前处理
将新鲜的海带加工废弃料(初加工产品整形边角料,冷冻储藏)解冻、洗净后切成3~5 cm条状,在60 ℃下真空干燥至水分质量分数为5%以下;冷却至室温,经高速组织粉碎机粉碎后,过40目标准筛,迅速装入自封袋置于玻璃干燥器中保存待用。
1.3 酶种类的筛选
1.3.1 纤维素酶辅助提取 称取2.00 g按照“1.2”处理过的样品,在预试验基础上,选取pH5.5的水缓冲体系(磷酸氢二钠-柠檬酸缓冲液,下同),在液料比40.00 mL/g,温度55 ℃,纤维素酶添加量(2.00 g样品中达到的酶活力,下同)3.00×103U下酶解240 min后,在80 ℃下水浴灭酶10 min,离心过滤,取上清液定容,按“1.7”方法测定计算海带多糖提取率。试验平行3次,其结果取平均值。
1.3.2 果胶酶辅助提取 选取pH4.0的水缓冲体系和果胶酶添加量1.80×103U,按“1.3.1”方法进行试验。
1.3.3 木瓜蛋白酶辅助提取 选取pH6.0的水缓冲体系和木瓜蛋白酶添加量4.00×103U,按“1.3.1”方法进行试验。
1.3.4 复合酶辅助提取 选取pH6.0的水缓冲体系,纤维素酶、木瓜蛋白酶和果胶酶添加量3.40×103U、 3.00×103U和 1.56×103U(预试验基础上确定上述比例),按“1.3.1”方法进行试验。
1.4 微波-复合酶辅助处理顺序对浸提效果的影响
1.4.1 先酶解再微波处理 称取2.00 g经“1.2”处理的样品,以样品质量40倍的pH5.0的水缓冲体系为浸提介质,纤维素酶、木瓜蛋白酶、果胶酶添加量同“1.3.4”,在55 ℃下保温酶解浸提240 min,过滤。滤渣在微波功率500 W,样品质量30倍的pH7.5的水浸提介质中,75 ℃保温浸提20 min,离心过滤。合并两次上清液定容后,按“1.7”的方法测定计算海带多糖提取率。试验平行3次,结果取平均值。
1.4.2 微波、酶解同时处理 称取2.00 g经“1.2”处理的样品,以样品质量30倍的pH5.0的水缓冲体系为浸提介质,纤维素酶、木瓜蛋白酶、果胶酶添加量同“1.3.4”,在微波功率500 W,55 ℃下保温浸提240 min(微波工作方式为工作1 min停歇12 min),离心过滤。上清液定容后,按“1.7”的方法测定计算海带多糖提取率。试验平行3次,结果取平均值。
1.4.3 先微波再酶解处理 按“1.4.1”试验方法和参数,先微波后酶解处理。
1.5 微波-复合酶辅助提取单因素试验
1.5.1 微波浸提单因素试验设计 按照“1.4”确定的方法提取海带多糖,考察微波辅助浸提下水浸提液pH、微波温度、微波时间、液料比以及微波功率对海带多糖浸提效果的影响。每个因素试验平行3次,结果取平均值。
1.5.2 酶解浸提单因素试验设计 按照“1.3”确定的酶种类,考察微波浸提海带残渣酶解辅助浸提下的pH、酶解温度、液料比、3种酶添加量、酶解时间对海带多糖浸提效果的影响。每个因素试验平行3次,结果取平均值。
1.6 优化试验设计
1.6.1 微波浸提响应面试验设计 根据单因素试验结果,在以水为浸提介质、微波功率为400 W下,根据Box-Behnken原理,采用Design-Expert 8.0.5进行4因素3水平试验,确定海带多糖微波辅助浸提最佳条件[15]。以海带多糖提取率为指标,缓冲溶液的pH、液料比、微波温度和时间为自变量,试验因素水平设计见表1。

表1 响应面因素水平表Tab.1 Factors and levels of the response surface
1.6.2 酶解浸提正交试验设计 根据单因素试验结果,固定液料比为40.00 mL/g,以海带多糖提取率为评价指标,进行正交试验设计优化[16],确定最佳酶添加量、pH、温度和时间,试验因素水平见表2。

表2 L18(37) 正交试验因素水平选取Tab.2 Selection of L18(37) orthogonal test on factors and levels
1.7 海带多糖提取率计算
参照徐光域等(2005)[17]运用硫酸-苯酚法测定海带多糖,绘制标准曲线,且空白试样以纯水代替待测海带多糖样品进行测定,海带多糖提取率的计算公式如下:
(1)
式(1)中:Y为海带多糖提取率(g/kg),C为浸提液海带多糖浓度(mg/L),V为测定取样体积(mL),F为测定样品稀释倍数,m为称取海带粉质量(g)。
1.8 抗氧化性测定
1.8.1 总抗氧化能力测定 参照魏碧娜(2016)绘制FeSO4标准曲线的方法[18],求得回归线性方程为Y=3.883 3X+0.037(r2=0.999 6),其中Y为593 nm下吸光值,X为FeSO4浓度(mmol/L)。取海带多糖样品稀释成200 mg/L的待测溶液,然后取上述待测溶液0.20 mL,再加入1.80 mL TPTZ工作溶液(称取TPTZ样品31.233 mg,用40 mmol/L的盐酸定容至10 mL,即得10 mmol/L的TPTZ工作溶液)混匀后置于37 ℃水浴中保温10 min,在593 nm处测定吸光值。空白组以超纯水代替待测样,其他条件相同。
1.8.2 羟自由基(·OH)清除能力测定 将制得的海带多糖样品稀释成200 mg/L的待测溶液。以200 mg/L维生素C溶液做阳性对照,在测定管中依次加入磷酸盐缓冲液(0.15 mol/L,pH7.4)1.00 mL,番红溶液(360 ug/mL)1.00 mL,EDTA-Fe(2 mmol/L)0.50 mL,待测样液1.00 mL,体积分数为3%的H2O21.00 mL,反应总体积为4.50 mL。将待测溶液混匀,在37 ℃水浴中保温30 min;迅速冷却至室温,在520 nm处测定吸光值。空白组:以1.00 mL蒸馏水代替待测样品;对照组:以1.00 mL维生素C溶液(200 mg/L)代替待测样品[18]。其计算公式如下:
T=(A样品-A空白)/(A对照-A空白)×100
(2)
式(2)中:T为羟自由基清除率(%),A样品为样品在520 nm处吸光值,A对照为对照组在520 nm处吸光值,A空白为空白组在520 nm处吸光值。
1.8.3 DPPH自由基消除能力测定 用100%(体积分数,下同)甲醇配制浓度为120 umol/L的DPPH,用40%甲醇配制200 mg/L的海带多糖样品。取4 mL样品,加入1 mL DPPH,在30 ℃水浴保温30 min,517 nm处测定吸光值。空白组用40%甲醇溶液代替待测样品[19-20]。计算公式如下:
t=(1-B样品/B空白)×100
(3)
式(3)中:t为清除率(%),B样品为样品组在517 nm处的吸光值,B空白为空白对照组在517 nm处的吸光值。
1.9 数据处理
采用Excel 2007进行数据处理、绘制图表;运用Design-Expert 8.0.5软件对响应曲面法设计试验结果进行方程拟合、参数优化和方差分析。
2 结果与讨论
2.1 酶种类筛选
纤维素酶、果胶酶、木瓜蛋白酶及复合酶分别酶解海带制备海带多糖的效果见图1。3种酶的复合酶辅助提取效果最好,海带多糖提取率达到126.38 g/kg;其次为纤维素酶和木瓜蛋白酶;果胶酶辅助提取效果最差,但海带多糖提取率也达到94.16 g/kg。从生产效率和成本的角度出发,选取3种酶的复合酶辅助提取制备海带多糖的工艺进行优化。
2.2 微波-复合酶辅助提取顺序的确定
微波辅助提取与复合酶辅助提取顺序对海带多糖提取效果的影响见图2。先微波再复合酶辅助提取效果最好,较先复合酶辅助提取再微波和微波-复合酶同时辅助提取效果有显著提高,其海带多糖提取率达到176.53 g/kg。从生产效率的角度出发,选取先微波再复合酶辅助提取制备海带多糖的工艺进行优化。

图1 不同种类酶对提取效果的影响Fig. 1 Effects of different kinds of enzymes on extraction efficiency

图2 微波与复合酶辅助提取顺序对提取效果的影响Fig. 2 Effects of microwave and compound enzyme-assisted extraction sequence on extraction efficiency
2.3 微波辅助提取响应面试验结果
2.3.1 响应面设计方案与试验结果 在单因素试验研究基础上,确定对浸提效果影响较大的pH、温度、时间、液料比等4个因素,采用Box-Benhnken中心组合方法设计响应面试验方案[21]。以海带多糖提取率为响应值,响应曲面试验设计方案及结果见表3。

表3 响应曲面分析试验设计及结果Tab.3 Experimental design and results of the response surface
运用Design-Expert 8.0.5软件对表3中的试验数据进行多元线性回归拟合,构建回归模型,得到海带多糖提取率与pH、温度、时间、液料比等4个因素变量的二次多项式回归方程:
Y=98.17+8.06A+4.08B+1.77C+8.04D
-0.90A·B+3.41A·C+2.05A·D
+2.04B·C-3.50B·D-1.95C·D-22.89A2
-6.55B2-3.87C2+0.02D2
(4)
式(4)中:A、B、C、D分别为pH、温度、时间和液料比。
由回归方程中一次方因素系数值大小可得出,各因素对海带多糖提取率的影响大小顺序为pH>液料比>温度>时间。
2.3.2 回归方程的建立及方差分析 由表4可知,回归方程模型显著(p<0.05),而失拟项不显著(p>0.05);校正决定系数值为0.952 6,预测决定系数值为0.905 1,表明试验结果与模型预测值联系紧密,该回归模型方程拟合性较好,可准确考察各因素对微波辅助浸提海带多糖的影响。
从表4可以看出,一次项A、B、D均达到了极显著的水平(p<0.01),而C是不显著的(p>0.05),说明pH、温度和液料比对海带多糖提取率的影响较大,因此要得到良好的浸提效果,就应该严格控制浸提液的pH、温度和液料比;而浸提时间达到一定范围之后,对海带多糖提取率影响不大。两两因素间的交互作用均不显著(p>0.05),表明因素之间的交互作用对海带多糖提取率的影响不大。同时,二次项A2、B2表现为极显著(p<0.01),C2显著(p<0.05),而D2不显著(p>0.05)。
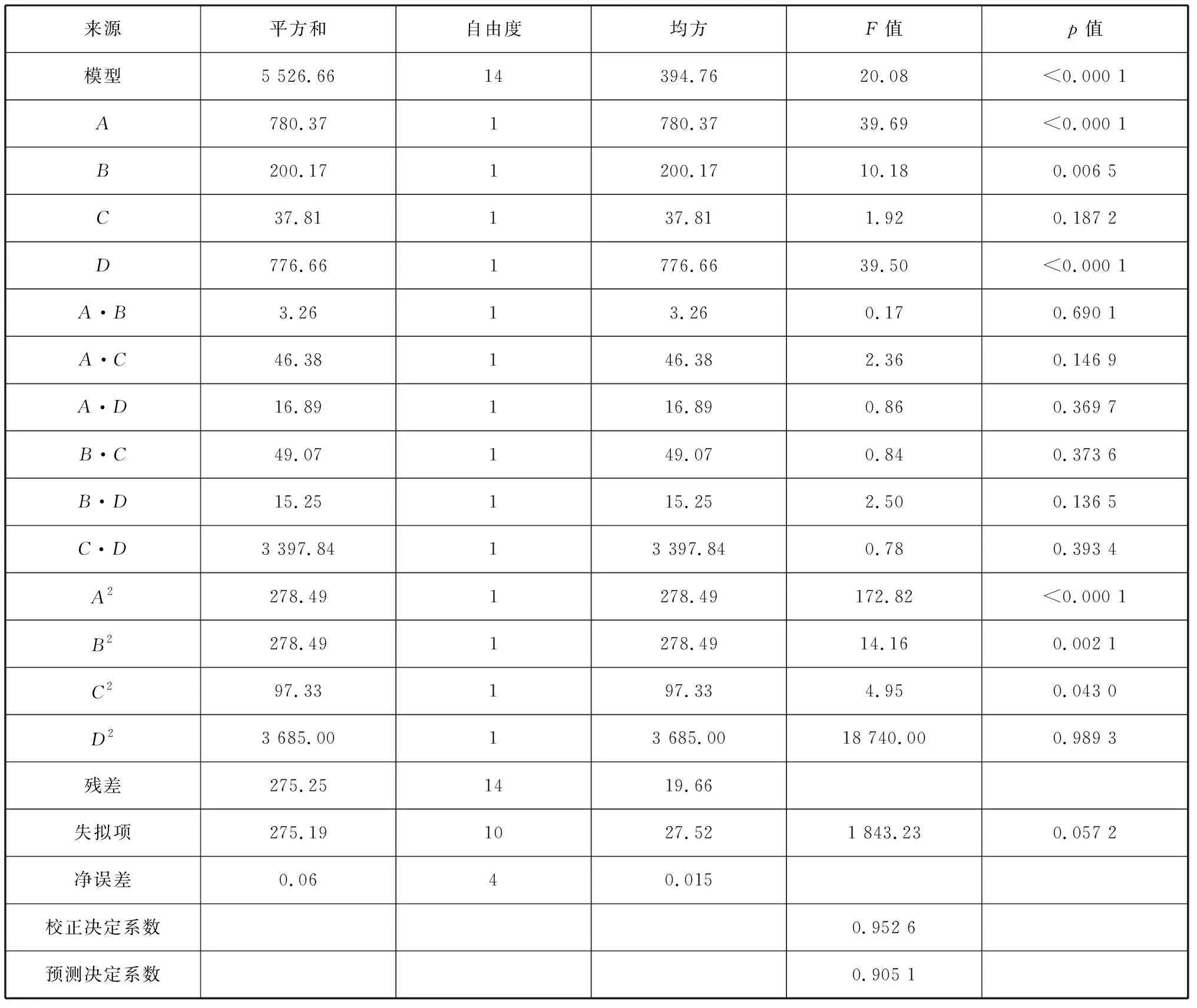
表4 回归方程的方差分析Tab. 4 Analysis of variance of regression equation
2.3.3 响应曲面分析 图3~8是依据回归方程绘制的海带多糖提取率与各因素交互作用项的响应面关系图,反映了各因素在海带多糖提取过程中对响应值的影响。
从图3~8可以看出,海带多糖提取率随pH、温度、时间的增大而增大,达到各因素中心值以后,提取率随各因素增大而逐渐减小。对比各图可知,pH对海带多糖的提取率影响最大,表现为图3~8的曲面较陡,由此可知,浸提液pH大小对海带多糖提取效果至关重要;其次是温度,再次是液料比。而响应曲面随微波浸提时间的变化幅度不大,说明该因素对海带多糖提取率影响较小。
图3~8中等高线椭圆形状不明显,由此可判别各因素之间的交互作用不强,验证了回归方程模型的方差分析是可靠的,说明响应曲面法优化设计可以很好的预测微波温度、时间、pH和液料比等4个因素对海带加工下脚料中海带多糖提取率的影响。

图3 pH与温度相互作用的响应面Fig. 3 Response surface plot of interaction between pH and temperature

图4 pH与时间相互作用的响应面Fig. 4 Response surface plot of interaction between pH and time

图5 pH与液料比相互作用的响应面Fig. 5 Response surface plot of interaction between pH and ratio of solvent to substrate

图6 温度与时间相互作用的响应面Fig. 6 Response surface plot of interaction between temperature and time

图7 温度与液料比相互作用的响应面Fig. 7 Response surface plot of interaction between temperature and ratio of solvent to substrate

图8 时间与液料比相互作用的响应面Fig. 8 Response surface plot of interaction between time and ratio of solvent to substrate
通过回归方程模型拟合计算出微波浸提最佳提取工艺条件为:微波功率400 W、 pH6.6、温度60 ℃、时间12.3 min和液料比60.00 mL/g,海带多糖提取率的理论值可达107.40 g/kg。
为试验操作方便,将工艺条件修正如下:微波功率400 W、 pH6.5、温度60 ℃、时间12 min和液料比60.00 mL/g,进行3次验证性试验,得海带多糖的平均提取率为106.49 g/kg,相对标准偏差为0.14%,与预测值的相对误差为0.85%,验证值与预测值基本相符,可见运用响应曲面法优化微波辅助提取海带多糖的工艺条件切实可行。
按上述所得修正的最佳工艺条件对海带多糖进行连续提取,结果表明,两次后海带多糖提取率为(107.52±0.16)g/kg,3次后海带多糖提取率仅为(108.84±0.13)g/kg,可见增加微波浸提次数已无法大幅提高海带多糖提取率,所以需要辅以其他方法来进一步使海带多糖从细胞中溶出,进而提高海带多糖提取率,避免资源浪费。
2.4 复合酶解辅助提取正交优化试验结果
以单因素试验为基础,选取酶解pH、温度、时间和酶添加量(纤维素酶、果胶酶和木瓜蛋白酶)为考察因素,以海带多糖提取率作为评价指标,通过L18(37)正交试验,试验结果及极差分析如表5所示。

表5 L18(37) 正交试验方案及结果Tab. 5 L18(37) orthogonal design and the results
由表5可知,以海带多糖提取率为评价指标,各因素对海带多糖提取率影响的主次顺序为时间>pH>果胶酶添加量>纤维素酶添加量>木瓜蛋白酶添加量=温度。由表5直观分析可知,酶解辅助浸提海带多糖的最佳工艺条件为:液料比40.00 mL/g,温度55 ℃、 pH6.0、时间105 min、纤维素酶4.00×103U、木瓜蛋白酶4.00×103U、果胶酶2.40×103U。在上述工艺条件下,海带多糖的提取率为115.16 g/kg。
在上述最佳条件下,按照“1.3.1”方法,进行微波-复合酶辅助提取海带多糖,得海带多糖平均提取率为208.93 g/kg,标准偏差为0.18%,相对标准偏差为0.08%,较单独使用微波或酶解技术浸提海带多糖提取率有显著提升[21-22]。同时,也说明本研究微波-复合酶辅助提取海带多糖的工艺条件真实可靠,稳定性较好,在实际生产中具有参考价值。
2.5 抗氧化性能测定
海带多糖提取物样品抗氧化能力结果如表6所示,测得其总抗氧化能力为0.128 0 mg/mL,对羟自由基和DPPH自由基清除率分别为64.10%和4.99%。可见,通过微波-复合酶辅助提取的海带多糖提取物组分是具有还原性的多糖,总抗氧化能力显著。对羟自由基有较强的清除能力,而对DPPH自由基的清除能力不强,可能与其浓度较低有关,但也可以作为自由基的抑制剂或清除剂的潜在抗氧化剂,有待做进一步深入研究。

表6 抗氧化能力结果Tab. 6 Results of antioxidant capacity
3 结论
通过对微波-复合酶辅助提取海带加工下脚料中海带多糖的工艺进行研究,最终得到微波-复合酶辅助提取海带多糖的最佳工艺条件为:微波功率400 W、 pH6.5、温度60 ℃、时间12 min和液料比60.00 mL/g,第二步酶解辅助浸提液料比40.00 mL/g,温度55 ℃、 pH6.0、时间105 min、纤维素酶添加量4.00×103U、木瓜蛋白酶添加量4.00×103U、果胶酶添加量2.40×103U,在最佳工艺条件下海带多糖的提取率可达(208.93±0.18) g/kg。因此,微波-复合酶辅助适用于海带多糖的提取,与传统酸液提取法、微波提取法及复合酶法、热水浸提法相比,具有提取率显著提高、总操作时间短、条件温和、耗能低等优点。上述参数下制得的海带多糖清除羟自由基的能力较强,其具有的抗氧化活性,使其有望作为天然抗氧化剂和功能性产品而得到开发利用,成为提升海带资源综合开发利用水平的突破口。
