小分子伴侣对淀粉样蛋白β 聚集抑制作用研究
2021-05-19关怡新姚善泾
肖 超, 闫 啸, 关怡新 , 姚善泾
(1. 浙江大学 化学工程与生物工程学院, 浙江 杭州 310027;2. Max Planck Institute of Molecular Cell Biology and Genetics, 01307 Dresden, Germany)
1 前 言
由于生活水平的显著提高和医疗条件的普遍改善,人类的平均寿命在过去几十年中已大幅度增加。然而,随之而来的人口老龄化问题导致痴呆症的患病率显著增加。痴呆症的主要特征是记忆混乱、人格改变和逻辑受损,在临床上痴呆症可能有多种表现形式,但迄今为止最典型的是阿尔茨海默症(Alzheimer’s disease, AD)。据估计全世界有4 700 万人受此困扰,占所有痴呆症患者的60%~80%[1]。AD患者的脑部组织学切片显示,淀粉样蛋白β(amyloid β, Aβ)和过度磷酸化tau 蛋白的自聚集导致脑细胞外淀粉样斑块的形成,以及胞内神经纤维缠结的积累[2]。淀粉样前体蛋白(amyloid precursor protein, APP)经β-分泌酶酶切产生的C 末端片段具有99 个氨基酸,该片段可以被γ-分泌酶进一步切割,最终形成2 种主要的淀粉样蛋白:Aβ40和Aβ42[3]。Aβ40在脑细胞中含量最为丰富,而Aβ42则更易于聚集,因而后者是淀粉样斑块的主要组成成分[4]。研究表明,Aβ 的自聚集会形成含有交叉β 折叠结构的有序聚集体,聚集体导致神经突触功能紊乱,引发神经系统异常[5],因此抑制Aβ 的聚集被认为是AD 的有效治疗方法之一。目前,大量关于抑制剂的研究工作都是围绕天然药物分子展开的,尤其是多酚类小分子受到了人们的广泛关注。例如,单宁酸可以显著降低Aβ 的细胞毒性,还可以将成熟的Aβ 纤维解聚[6]。其他多酚类衍生物,如:姜黄素[7]、表没食子儿茶素没食子酸酯(epigallocatechin gallate, EGCG)[8]等,均展示了一定的Aβ聚集抑制作用,而且Aβ 自聚集形成的纤维形貌也发生了显著改变,但是可能存在的细胞毒性及不能有效跨越血脑屏障(blood-brain barrier, BBB)等问题还有待深入研究。
在体外和体内,Aβ 存在着数种寡聚体,从二聚体到三聚体、十二聚体和多聚体不等,其中十二聚体(其相对分子质量为56 000,又称为Aβ*56)具有独立于淀粉样斑块而损伤神经细胞的能力[9]。在将记忆受损型Tg2576 小鼠大脑中纯化出的Aβ*56 向正常幼鼠给药后,幼鼠的记忆遭到破坏。有研究指出[10],并非所有的聚集体都具有高细胞毒性,如果能够将毒性通路聚集体(on-pathway aggregates)转变为非毒性通路聚集体(off-pathway aggregates),同样是一种抑制Aβ42聚集、降低其细胞毒性的策略。分子伴侣(molecular chaperone)家族是一类细胞固有的蛋白质,其作用是与其他蛋白质相结合,稳定其构象,使之正确折叠至天然结构,并发挥正常生理功能[11]。在大肠杆菌的分子伴侣体系中,GroEL/GroES 系统是在所有生长条件下都不可或缺的分子伴侣[12]。小分子伴侣,即GroEL 顶端结构域(191-345 位残基),由于其在不需要GroES 和ATP 等辅助因子的协助下,仍能显示出结合蛋白和协助蛋白质复性的活性[13],因而在协助蛋白质重折叠方面具有广泛的应用[14]。
鉴于小分子伴侣与目标蛋白的结合主要依赖疏水相互作用[15],而Aβ 聚集的主要原因在于其17-42位残基所形成的疏水腔[16],因而小分子伴侣具有改变Aβ 构象,从而抑制Aβ 聚集的能力和潜在的应用前景。本研究以文献报道的多酚类抑制剂(姜黄素、EGCG)作为对比,考察了部分疏水性药物分子(布洛芬、槲皮素、核黄素)对Aβ42的抑制作用,重点研究了小分子伴侣的抑制机理和细胞毒性,为多肽和蛋白类抑制剂的开发和临床应用奠定基础。
2 实验部分
2.1 材料
小分子伴侣(minichaperone 191-345)质粒由英国剑桥大学Alan R. Fersht 教授惠赠,其质粒载体为pRSET A(T7 启动子,AMP 抗性标记),质粒结构图如图1 所示。宿主细胞大肠杆菌BL21 购自北京擎科生物科技有限公司。Aβ42冻干粉(纯度>95%)购自吉尔生化(上海)有限公司,姜黄素(developer grade)购自生工生物工程(上海)有限公司,EGCG、槲皮素(纯度≥95%)购自西格玛奥德里奇(上海)贸易有限公司。细胞毒性实验中,细胞株SH-SY5Y 人神经母细胞瘤细胞购自上海酶研生物科技有限公司,培养基DMEM/F12(1:1) + 10% FBS + 1% 双抗,购自赛默飞世尔科技(中国)有限公司。其他试剂均为市售生化试剂。
图1 小分子伴侣pRSET A 质粒结构Fig.1 The structure of minichaperone 191-345 pRSET A plasmid
2.2 实验方法
2.2.1 小分子伴侣在大肠杆菌中的表达和纯化
小分子伴侣的表达和纯化具体参见文献[17]。纯化后,用凝胶过滤色谱法分析其纯度,所用仪器为LC3000 型高效液相色谱仪(CXTH,China),凝胶色谱柱为TSK-GEL G2000SWXL(Tosoh Bioscience,Japan)。具体地,上样量为20 μL,流动相为PBS,流量为0.5 mL·min-1,在215 nm 处测定其吸光度值。浓度测定使用Bradford 法,以BSA 作为参比蛋白计算得到小分子伴侣蛋白浓度。
2.2.2 Aβ42的预处理
预处理方法如文献[18]所述。首先将Aβ42冻干粉转移至温度为4 ℃冰箱中,待其温度稳定在4 ℃后,以质量浓度为1 mg·mL-1溶解于六氟异丙醇中,冰浴超声20 min 以分散Aβ42聚集体。随后将蛋白溶液在4 ℃冰箱中静置2 h,冷冻干燥得到絮状Aβ42,置于-20 ℃冰箱中保存待用。使用前,将质量为5 mg 的Aβ42溶解于4 mL 20 mmol·L-1NaOH 溶液中(Aβ42终浓度为275 μmol·L-1),冰浴超声20 min 使之完全溶解,所得母液冰浴备用。使用时,分别以含不同种类、不同浓度抑制剂的PBS 稀释母液至所需浓度。
2.2.3 硫代硫磺素(thioflavin T,ThT)荧光
非原位ThT 荧光测定:按照文献[19]的方法,将上述制备得到的Aβ42溶液置于37 ℃和转速为150 r·min-1摇床中进行老化。在不同的时间(0、4、8、24、48 h)分别吸取100 μL 样品,加入1 mL、25 μmol·L-1的ThT 溶液(溶剂为PBS)中,混匀后测定其荧光强度。其中,Aβ42、姜黄素、布洛芬、槲皮素、核黄素和EGCG 的终浓度为25 μmol·L-1,小分子伴侣浓度分别为25 和50 μmol·L-1。所用仪器为F-4500 荧光分光光度计(Hitachi,Japan),设定激发波长为440 nm,发射波长为480 nm,带宽为5 nm,扫描速度为100 nm·min-1。记录所得到的扫描数据并扣除不含Aβ42的背景。每个实验点均重复3 次,并进行误差分析。
原位ThT 荧光测定:96 孔板中每孔加入的溶液体积均为220 μL,其中包括20 μL 浓度为275 μmol·L-1的Aβ42母液、90 μL 浓度为122.2 μmol·L-1的ThT 溶液(ThT 和Aβ42的摩尔浓度比为2.0[20])和110 μL 的抑制剂PBS 溶液。其中,Aβ42、姜黄素、EGCG 和槲皮素的终浓度为25 μmol·L-1,小分子伴侣浓度分别为25 和125 μmol·L-1。每组实验均设定未添加Aβ42母液为背景组,将每孔所得到的数据减去背景后记录其数值。酶标仪型号为Spectra Max M2e(Molecular Device,USA),设定激发波长为440 nm,发射波长为480 nm,温度37 ℃,测量前振荡混匀30 s,每个实验点均重复3 次,计算平均值及方差。
2.2.4 透射电镜
取30 μL 老化24 h 后的Aβ42样品滴加到300 目的碳支持膜上,用滤纸吸除碳支持膜边缘多余溶液。随后,滴加30 μL 质量分数为2%的醋酸双氧铀溶液进行负染,观测电镜结果。所使用仪器为120 kV 透射电子显微镜HT-7700(Hitachi, Japan),对照组放大标尺为200 nm,实验组放大标尺为50 nm。
2.2.5 凝胶过滤色谱分析
将老化18 h 后的Aβ42溶液取出,于4 ℃和12 000 g 条件下离心15 min。随后取上清液,测定其215 nm 处吸光度[20],通过对各蛋白组分流穿的出峰时间和峰面积的比较,分析Aβ42可溶性组分的分子量组成。使用牛血清白蛋白(BSA,相对分子质量67 000)、溶菌酶(lysozyme,相对分子质量14 300)作为分子量标准,实验条件同2.2.1 节小分子伴侣纯度测定。
2.2.6 细胞毒性
向96 孔板中加入5 000 个细胞/孔,添加培养基至总体积为180 μL,培养24 h。待细胞完全贴壁后,再向每孔中加入20 μL 老化24 h 的Aβ42样品,使得Aβ42终浓度为5 μmol·L-1,继续培养24 h。向每孔中加入20 μL MTT 溶液(5 mg·mL-1,溶剂为PBS),培养4 h 后,取出96 孔板,离心移除上清液。而后,向每孔加入200 μL DMSO,在37 ℃和100 r·min-1条件下振荡15 min 使结晶完全溶解。使用酶标仪(MR 550酶标仪,Bio-Rad,USA)测定570 nm 处吸光度,计算细胞存活率。仅加入PBS 的细胞存活率定义为100%,每个点均设置6 组平行实验,所得实验数据均需减去缓冲液背景,并作均一化处理。
3 结果与讨论
3.1 小分子伴侣的重组表达及纯化
小分子伴侣的重组表达及纯化电泳图如图2 所示。小分子伴侣主要存在于破胞上清液中,本实验中pRSET A 载体表达的小分子伴侣,在其N 末端含有6×His 纯化标签,因而可以使用Ni-NTA 亲和层析柱进行捕获和初步分离工作(图2(a))。为获得更高纯度的小分子伴侣[21],从而满足后续实验的要求,在镍柱纯化后,洗脱液通过体积排阻层析柱进一步精制,结果如图2(b)所示。将纯化蛋白使用分析用凝胶过滤色谱(ana-SEC)进行检测,表明制备得到的小分子伴侣纯度>99%。使用Bradford 法,测得小分子伴侣浓度为47.8 mg·mL-1(2.74 mmol·L-1),产量为230 mg·L-1。
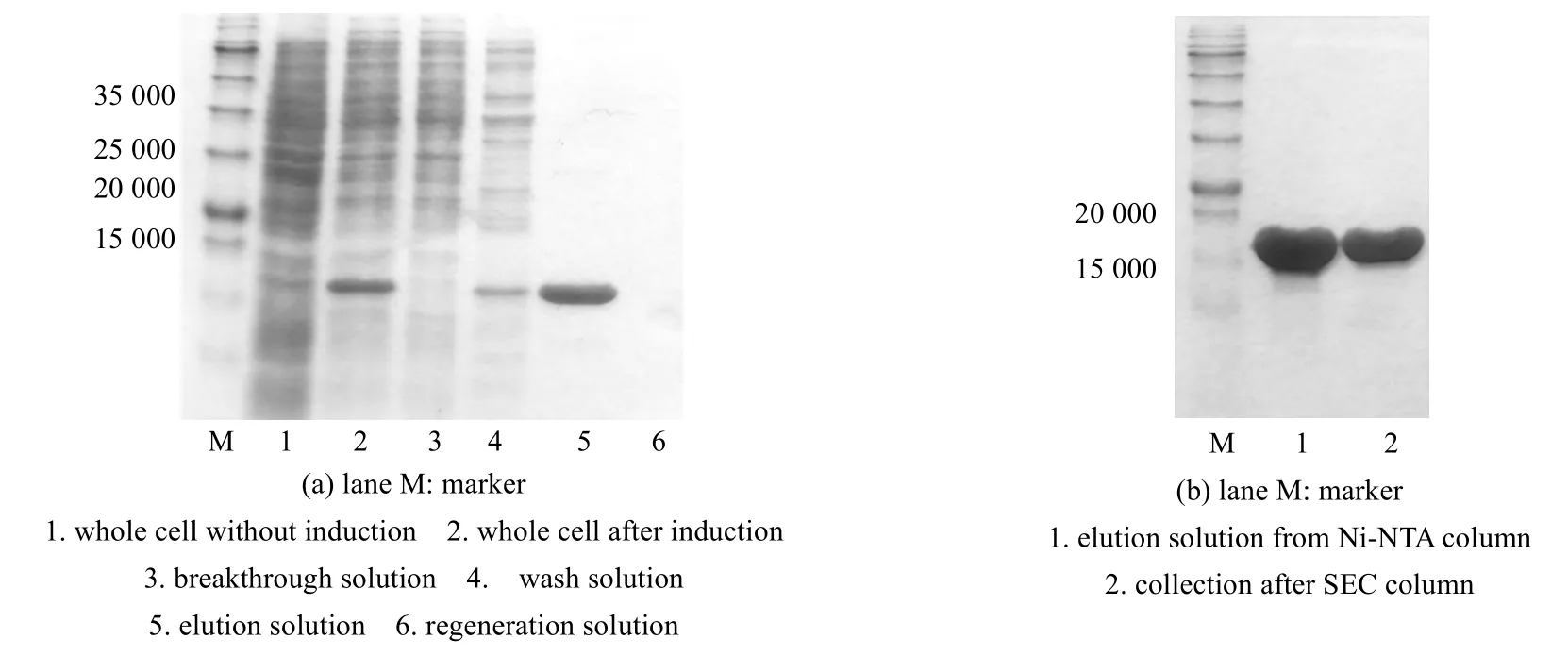
图2 重组小分子伴侣表达及纯化SDS-PAGE 图Fig.2 SDS-PAGE of recombinant minichaperone expression and purification
3.2 小分子伴侣对Aβ42 溶液聚集动力学的影响
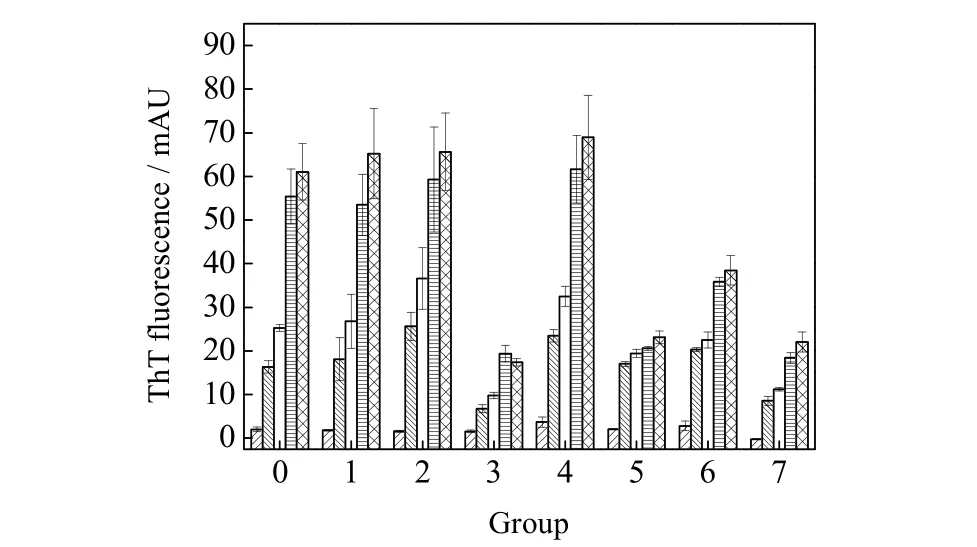
图3 各抑制剂对Aβ42 的非原位ThT 荧光强度影响Fig.3 Ex situ ThT fluorescence intensity of Aβ42 with different suppressors
图3为在各种抑制剂存在时Aβ42非原位ThT 荧光实验结果。可以发现,姜黄素、EGCG 和槲皮素均表现出对Aβ42聚集有良好的抑制作用,相较于PBS 组,其在24 h 时的ThT 荧光强度分别下降了65%、63% 和66%。原位ThT 荧光实验结果(图4(a))同样验证了这3 种分子的显著抑制作用,对比未添加抑制剂的Aβ42聚集动力学曲线,抑制剂不仅降低了荧光响应值,同时也使得聚集到达稳定期的时间大大缩短。然而,小分子伴侣的抑制行为则比较复杂,对比图3 和图4(b),两者的荧光响应值表现出不同的变化趋势,非原位ThT 荧光结果并未表现出与对照组间的显著差异;而原位ThT 实验中,在老化16 h 且小分子伴侣和Aβ42的摩尔比为5:1 (小分子伴侣浓度为125 μmol·L-1)时,荧光响应值相较于对照组下降了72%。究其原因,非原位和原位ThT 实验结果的差异可能与抑制剂及ThT 分子在淀粉样纤维上的结合间的竞争性抑制相关[22]。在非原位实验中,Aβ42-小分子伴侣体系和ThT 接触时间较短,结合的竞争性抑制不强,这导致了所扣除的背景值偏小。而在原位实验中,Aβ42-小分子伴侣-ThT 的体系混合充分,达到了较稳定的状态,因而所扣除的背景值更接近真实值。
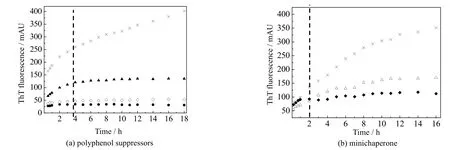
图4 各抑制剂对Aβ42 的原位ThT 荧光强度影响Fig.4 In situ ThT fluorescence intensity of Aβ42 with different suppressors
值得注意的是,相较于PBS 组和多酚类抑制剂,Aβ42在小分子伴侣的存在下能更快地到达聚集稳定期。如图4 中黑色虚线所示,在等摩尔量多酚类抑制剂存在下,Aβ42聚集动力学达到稳定期需要约4 h,而5 倍摩尔量以上的小分子伴侣可以将这一时间缩短到2 h 以内。Stan 等[23]报道了小分子伴侣的短暂结合释放模型(transient binding release,TBR),相比于多酚类抑制剂通过疏水作用力与21~30 位残基的β 转角结合[24],小分子伴侣的作用更为高效,使得蛋白迅速跨越能阱到达能量最低态[25],从而缩短了Aβ42从单体向高分子量聚集体过渡的时间。当小分子伴侣与Aβ42的摩尔比大于5:1 后,聚集的稳定期并没有进一步缩短,这可能是蛋白结合位点已经饱和,空间位阻阻碍了小分子伴侣的进一步作用。
3.3 小分子伴侣抑制Aβ42 自聚集形成的纤维丝
为了考察各种抑制剂对Aβ42成纤维形貌的影响,本研究利用透射电镜观察了老化24 h 后的Aβ42纤维样品,结果如图5 所示。从图中可以看到,未添加抑制剂的Aβ42样品视野中出现了大量的长纤维(如图5(a)所示),该纤维长度可达到数百纳米,是典型的成熟纤维聚集体形貌;而加入了多酚类抑制剂(姜黄素、槲皮素,如图5(b)~(c)所示)和小分子伴侣(如图5(d)~(e)所示)混合培养,Aβ42样品视野中未出现长纤维的形态,却出现了尺度较短的短棒状或颗粒状的纤维形态,纤维长度在50 nm 左右。可见,与Aβ42自聚集形成细长纤维相比,添加了抑制剂的聚集体外观呈现不规则的状态,证明小分子伴侣的加入使Aβ42稳定在自聚集过程中未出现的聚集形态,从而使得聚集体形貌发生改变,最终成功抑制了Aβ42形成长而细的成熟纤维丝。

3.4 小分子伴侣改变Aβ42 聚集路径
为了进一步分析各种抑制剂对于Aβ42聚集的抑制作用,本研究采用分析型凝胶过滤色谱探究了各种情况下Aβ42的可溶性组分分子量的分布,从而了解在各种抑制剂的作用下Aβ42聚集状态的差异。实验结果如图6 所示,其中选择了牛血清白蛋白(BSA,相对分子质量67 000,出峰时间14.8 min)和溶菌酶(lysozyme,相对分子质量14 300,出峰时间19.6 min) 2 种蛋白质作为色谱柱出峰时间的标定物,以黑色箭头标于图中。如图中黑色线所示,在PBS 中,Aβ42样品初始的可溶部分有2 个洗脱峰:第1 个峰的相对分子质量略小于60 000,第2 个峰略大于15 000,这一结果与文献报道相符[26]。从相对分子质量进行分析,第1 个洗脱峰的Aβ42聚集体应为12 聚体,相对分子质量约为56 000(即Aβ42*56),这是一种不会进一步聚集而形成更大分子量聚集体的可溶性低聚体[27];第2 个洗脱峰的Aβ42聚集体应为三聚体,相对分子质量约为15 000,在单体、二聚体和三聚体间存在着动态平衡[27],因而可以认为该洗脱峰实际上是Aβ42单体的洗脱峰。
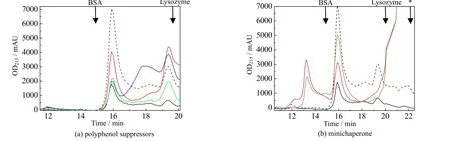
图6 凝胶过滤色谱分析Aβ42 老化18 h 后可溶组分分子量分布Fig.6 Ana-SEC spectra for molecular weight distribution of Aβ42 soluble components after 18 h aging
从图6(a)不难得出,经过18 h 的老化后,在多酚类抑制剂存在的情况下,Aβ42可溶性组分的总量相较于初始溶液未有明显下降,但其中单体形式的含量显著提升,相应地Aβ42*56 含量下降。这说明所选用的3 种多酚类抑制剂能有效抑制Aβ42的聚集。这一现象和多酚类抑制剂的疏水性有着重要关系,Wang 等[28]曾报道Aβ42与EGCG 并非通过特异性结合,而是通过疏水相互作用,使得Aβ42结构发生改变。改变后的寡聚体结构具有较低的吉布斯自由能,难以发生聚集。而在小分子伴侣存在下,可溶性组分分子量的组成则呈现了不同的变化规律(如图6(b)所示)。首先,单体峰完全消失,这是源于小分子伴侣能促进蛋白向能量最低态发展的性质;其次,相较于初始状态,Aβ42*56 峰面积减少,并出现了一个更高相对分子质量组分的洗脱峰。这一现象表明可能部分Aβ42*56的结构发生变化,使其形成了高聚物。当然,这种高相对分子质量聚集体是否具有细胞毒性,即小分子伴侣是否成功地将毒性通路聚集体(on-pathway aggregates)转变为非毒性通路聚集体(off-pathway aggregates),尚需要细胞毒性实验进一步验证。
3.5 小分子伴侣降低Aβ42 的胞外毒性
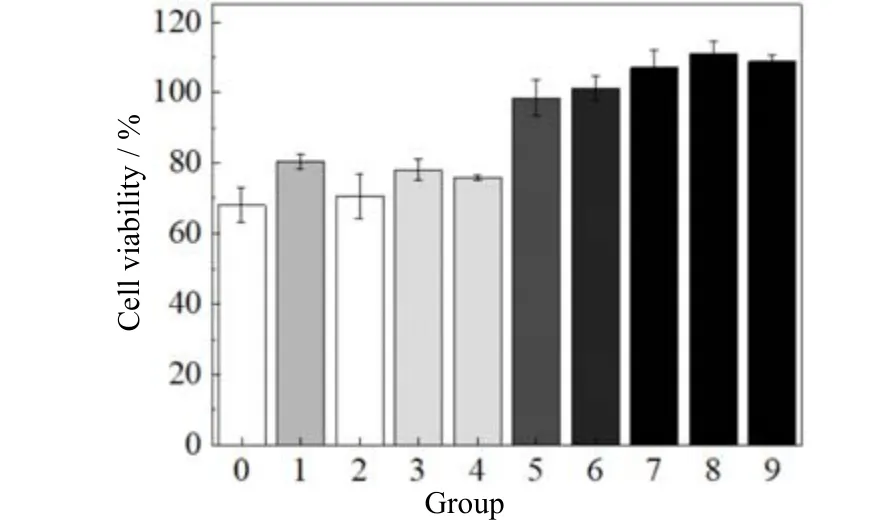
图7 各抑制剂对Aβ42 的体外细胞毒性影响Fig.7 Effects of different suppressors on Aβ42 in vitro cytotoxicity
通过MTT 实验研究了Aβ42聚集体对SH-SY5Y的细胞毒性。考察的多酚类抑制剂浓度为1.25、2.5、5、10、20、40 μmol·L-1,选取细胞存活率最高的浓度组数据,结果如图7 所示。未添加抑制剂的对照组中,细胞存活率为67.9%;添加多酚类抑制剂后,细胞存活率提升最多的是添加5 μmol·L-1姜黄素组,细胞存活率为80.3%。导致多酚类抑制剂无法显著降低细胞毒性的原因也源于其疏水性:一方面,疏水性这一特性使得姜黄素等抑制剂具有着良好的抑制效果;另一方面,由于多酚类抑制剂与Aβ42的相互作用为非特异性结合,因而此能量最低形态也改变了溶液性质,而这一改变对于细胞的功能维持是致命的。更重要的是,将寡聚体解聚确实可以使Aβ42更容易通过血液系统运输出脑部,但在抑制剂移除后,Aβ42单体的高度聚集趋势以及本身的细胞毒性无异于在神经细胞周围安装了大量“定时炸弹”。Selkoe[29]提出了一个典型的阿尔茨海默症的致病模型:淀粉样蛋白β 的双聚体阻碍了谷氨酸在大脑内部的重吸收,进而使得神经细胞周围的谷氨酸过量积累,最终导致神经元激活异常,其功能被破坏。相较而言,小分子伴侣则显著降低了Aβ42的细胞毒性,加入2.5 μmol·L-1小分子伴侣后,细胞存活率可提高到98.4%。与凝胶过滤色谱分析结果相结合,表明所得到的高相对分子质量聚集体确实是一种非毒性通路聚集体。此外,小分子伴侣促使可溶性聚集体迅速转变为成熟纤维,而成熟纤维被认为是生物学惰性的[30],这也有助于提升细胞存活率。由于小分子伴侣蛋白具有良好的生物相容性,可以在较为温和的条件下改变Aβ42聚集通路,使得其细胞毒性大大下降,展现了其作为抑制剂的安全性和有效性。
4 结 论
通过多种表征手段,对小分子伴侣抑制Aβ42聚集的过程及机理进行了研究,结果表明小分子伴侣是一种生物相容性好、抑制作用显著的Aβ42聚集抑制剂。其优势主要展现在以下方面:
(1) 小分子伴侣的TBR 模型不仅使得Aβ42的聚集程度降低,也使得其向聚集稳定期发展的时间大大缩短。这缩短了过渡态中存在的高神经毒性寡聚体的停留时间,使其迅速转变为具备生物学惰性的纤维,这是细胞存活率大幅提高的一个重要原因;
(2) 小分子伴侣引导活跃的Aβ42的单体或寡聚体形成低细胞毒性的聚集体,避免了Aβ42对神经细胞造成2 次损伤;
(3) 相较于多酚类抑制剂,小分子伴侣的作用条件更为温和,生物相容性好。由于多酚类抑制剂的作用为非特异性结合,因而其潜在的副作用是不能忽视的。而分子伴侣家族本身就广泛存在于生物体内,因而有望应用于阿尔茨海默症以及其他由蛋白错误聚集造成的神经退行性疾病的治疗中。
