滩羊肌肉在煮制过程中可挥发性化合物的变化
2021-05-19单启梅赵晓策罗瑞明尤丽琴
单启梅,赵晓策,罗瑞明,尤丽琴
(宁夏大学农学院,宁夏 银川 750021)
滩羊主产于宁夏盐池县,为国家二级保护畜种[1-3]。盐池滩羊肉质细嫩,无膻腥味,脂肪分布均匀,风味独特,深受广大消费者的喜爱[4-7]。
肉加热后不仅质构发生变化,风味前体物质经系列化学反应而产生香气[8-9]。肉品在煮制过程中产生的挥发性风味物质种类较多,包括酸类、醇类、醛类、酯类、酮类、芳香烃、酚类等,其中酸、醇、酯、酮、醛具有较低的阈值,对风味的形成具有重要作用,因此对食品中的挥发性风味物质进行检测非常重要[10-11]。李伟等[12]采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)测定了滩羊肉可挥发性成分,共检测出43 种挥发性风味物质。但目前对滩羊肉煮制过程中可挥发性化合物形成的温度、时间及挥发性风味物质随温度时间变化的相关研究较少,使得宁夏手抓羊肉、清炖羊肉等特色滩羊肉制品工业化生产中风味控制技术的研发缺乏理论指导。
目前,对可挥发性化合物质研究大都采用GC-MS联用技术对产品风味进行成分分析,但此技术无法分析鉴定出一些含量少而对风味至关重要的物质[13]。气相色谱-嗅闻(gas chromatography-olfactometry,GC-O)技术将嗅味检测仪与分离挥发性物质的GC相结合,能有效地从复杂的化合物中分析鉴定出气味物质[14]。郝宝瑞等[13]采用GC-O-MS技术研究了清酱肉中可挥发性化合物,并分析各个物质对清酱肉整体风味的贡献大小;苏晓霞等[15]以菜籽油为研究对象,采用GC-O-MS技术确定该物质的特征风味物质,对菜籽油的香气特征有了完整概念,并可以借此优化菜籽油的商品品质。所以将GC-MS和GC-O技术结合,优势互补,对可挥发性化合物的分析鉴定起到更大的作用。风味物质在进行GC-MS检测前,需对其进行分离和取样,吹扫捕集(purge and trap,P&T)法具有高吸附率、对痕量物质敏感的特点,可较为完整地提取可挥发性风味成分[16]。本研究采用P&T结合GC-MS和GC-O技术,以滩羊肌肉为原料,研究在煮制过程中挥发性风味物质的形成及变化,旨在为研发肉品风味形成控制技术提供理论指导。
1 材料与方法
1.1 材料与试剂
盐池滩羊背最长肌 宁夏盐池县大夏农林牧开发有限公司;正构烷烃(C6~C26)标准品、2-甲基-3-庚酮Sigma-Aldrich(上海)贸易有限公司。
1.2 仪器与设备
KT300数字温度计 广州潮州市潮安区保德仪器具有限公司;Trace MS GC-MS联用仪 美国Finnigan公司;Atomx型吹扫捕集仪 美国Tekmar实业发展有限公司;Agilent DB5-MS-123-5533气相毛细管色谱柱 上海迈隆科技有限公司;Tenax TA石英玻璃吸附毛细管 北京谱鹏科技有限公司;ODP2嗅闻检测仪 德国Gerstal公司;DS-II型电热三用恒温水浴箱 余姚市亚星仪器仪表有限公司;FA系列电子天平 上海蒲春计量仪器有限公司;AUX HR50F多功能电热锅 广东江门市威多福电器有限公司。
1.3 方法
1.3.1 样品预处理
随机选取5 只体质量为(20.00±2.00)kg经草料喂养的6 月龄纯种公滩羊,将5 只实验羊现场屠宰,分别去除5 只羊背最长肌的皮下脂肪后采样500.00 g。将其切成12 份(0.60 cm×0.60 cm×8.00 cm),4 ℃贮藏,待分析。
因短链脂肪酸熔点为44~55 ℃[17],故本实验将检测温度起始点定为50 ℃。将水(4.00 L)和8.00 g NaCl放入锅中[18],加热并监测其中心温度至50、60、70、80、90 ℃以及水煮沸后每20 min(0、20、40、60、80、100、120 min)分别取样10.00 g。放入PE材质的自封袋中,为防止挥发性物质遗失,于冰浴中进行冷却[19],同时将其贮存在-18 ℃条件下直到取出分析检测。
1.3.2 滩羊肌肉中脂肪酸提取与分析
精确称取10.00 g滩羊肌肉,去除筋膜等后切成薄片,放入真空冷冻干燥机中干燥,待干燥后用粉碎机打碎,并用氯仿-甲醇溶液(87%氯仿)在索氏抽提器中提取10 h,然后将提取后的残渣放入真空冷冻干燥机挥去残留的有机溶剂,放入干燥器中备用。向样品中加入5.00 mL的KOH-CH3OH溶液(0.50 mol/L),将样品在70 ℃条件下皂化5 min,然后加入5.00 mL体积比为1∶3的BF3-CH3OH溶液,并将样品在70 ℃条件下进行甲酯化2 min,再加入3.00 mL正己烷溶液,70 ℃条件下回流萃取1 min后,最后于样品中加入饱和NaCl溶液5.00 mL,然后静置10 min,分层吸取出1.00 mL上层液于进样瓶中进行GC-MS分析,每组平行3 次实验。
1.3.3 P&T-GC-MS技术分析检测
参考郝宝瑞[13]、陈海涛[20]等方法,并进行适当调整。
剪碎研磨后取2.00 g滩羊肌肉装置于40.00 mL P&T样品瓶中,加入1.00 μL内标溶液(0.408 μg/μL的2-甲基-3-庚酮)和质量分数3%的NaCl溶液,使用自动P&T浓缩器以50.00 mL/min流速的氮气将顶空物质吹扫出来,并吸附到装有极性Tenax-TA吸附材料和非极性Agilent DB5-MS-123-5533气相毛细管色谱柱的毛细管捕集器上。设定条件为60 ℃平衡25 min,氮吹流量为50 mL/min,吹扫吸附60 min。完成吸附过程。最后通过快速热解吸,200 ℃解吸4 min,将解吸出的物质注入GC-MS仪进行分析。每组样品平行3 次进样。
GC条件:载气为99.99%的氦气,恒流量1.20 mL/min,入口温度250 ℃,压力14.87 Pa。分流比1∶1;初始柱温40 ℃保持3 min,然后以5 ℃/min的速率升至200 ℃,再以10 ℃/min的速率升至230 ℃,并保持3 min。色谱毛细管柱为DB-5ms(30 m×0.25 mm,0.25 μm)。
MS条件:电子电离源,电子能量70 eV,离子源温度230 ℃,MS传输线温度280 ℃,质量扫描范围m/z50~350。
1.3.4 滩羊肌肉的挥发性风味物质分析检测
采用GC-MS分析提取滩羊肌肉样品中挥发性成分,分析条件同1.3.2节,流出物在毛细管末端以1∶1的比例分别流入嗅闻仪和质谱检测器。嗅闻仪端口选取经过专业闻香培训的品评人员对本实验的样品进行GC-O分析和香气提取物稀释分析。
气味检测条件:嗅觉检测端口(瑞士布雷赫布勒,嗅探器9000)。将界面温度为150 ℃,并引入湿氮,以防止实验人员弄干鼻子。
通过查找参考文献,得到本实验检测到物质在水中的阈值,计算被测到表示该物质对整体气味贡献大小的气味活性值(odor activity value,OAV),计算公式为:

式中:Cx为该物质含量/(μg/kg);OTx为该物质的气味阈值/(μg/kg)。
1.4 数据处理
根据积分色谱图结果,在NIST 05a.L谱库数据库检索,与标准谱图对比进行定性分析,根据CAS号确定其化学成分及化学名称,用峰面积归一法计算化合物在滩羊肉挥发性风味物质中的含量(μg/kg)。基于获得的数据对化合物定性定量,使用IBM SPSS Statistics 23 for windows(SPSS Corp.,Chicago,USA)和Microsoft Excel 2003软件进行统计分析。结果表示为,P<0.05,差异显著,每组实验平行3 次。
2 结果与分析
2.1 基于GC-MS技术对滩羊肌肉煮制过程中挥发性物质的变化规律分析
如表1所示,通过GC-MS对12 个滩羊肌肉样本在煮制过程中的挥发性物质进行检测,最终共检测出42 种挥发性物质,其中醛类16 种、酮类6 种、醇类5 种、酸类3 种、杂环类化合物12 种。不同阶段共检测出14(50 ℃)、16(60 ℃)、15(70 ℃)、25(80 ℃)、26(90 ℃)、27(煮沸0 min)、32(煮沸20 min)、32(煮沸40 min)、35(煮沸60 min)、39(煮沸80 min)、39(煮沸100 min)、26(煮沸120 min)种挥发性物质。
由表1可知,滩羊肌肉在煮制过程中,在不同煮制温度和不同煮制时间产生的可挥发性化合物不同。当温度为50 ℃时,壬醛相对含量为26.27%,庚醛为10.01%,己醛为7.64%,2-丁酮为1.40%,吡咯为1.43%;温度为60 ℃时,壬醛相对含量为23.43%,庚醛为11.68%,己醛为7.54%,2-丁酮为1.78%,吡咯为3.59%;煮沸0 min时,壬醛为14.54%,庚醛为2.34%,己醛为5.37%,2-丁酮为0.48%,吡咯为10.75%;煮沸20 min时,壬醛相对含量为12.46%,庚醛为1.26%,己醛为3.93%,2-丁酮为0.48%,吡咯为9.24%。
在整个煮制过程中,检测出的醛类物质在种类和相对含量上都占有较大比例,主要有壬醛、己醛、苯甲醛等。这些醛类物质的含量均呈现先增加后减少的趋势,含量减少是因为达到了醛类物质溶解所需要的条件,从而溶解在肉汤中[21],(Z)-2-庚烯醛、(E)-2-辛烯醛和(E)-2-壬烯醛等醛类物质是煮制温度达到一定条件才检测到,预测其原因是达到了反应所需条件。产生大量醛类化合物是因为在风味形成的过程中,当美拉德反应生成含有羰基的戊糖和丁糖时,进一步发生Strecker降解反应也可产生醛类,如苯甲醛是苯丙氨酸的降解产物[22]。此外,Strecker反应也会形成某些醛类物质,如2-甲基丁醛来源于亮氨酸的Strecker反应[23]。
在肌肉煮制过程中产生的主要酮类物质有2-丁酮、1-辛烯-3-酮、2,3-辛二酮、2-十一酮。其中2-丁酮于50 ℃时被检出,因其能溶于水,且当温度到达一定值时溶解度会随温度的升高而降低,所以其含量呈先增后减又增的趋势,煮沸120 min后未检出。1-辛烯-3-酮也在50 ℃时检出,含量呈波动增减。2,3-辛二酮在加热70 ℃时被检出,含量呈先增后减趋势,可能是部分酮类溶于肉汤,也有部分挥发所致[24]。2-十一酮煮沸后被检出,因其不溶于水,所以含量一直处于增长状态。醇类挥发性物质集中产生于加热90 ℃以后,且其含量均呈现不稳定变化状态。主要有1-戊烯-3-醇、1-戊醇、1-辛烯-3-醇、3-甲基-1-丁醇和(E)-2-癸烯醇。其中1-辛烯-3-醇阈值较低,对羊肉风味的形成作用较大。滩羊肌肉产生的酸类挥发性物质含量较低,阈值较高对肉香气贡献较小,主要有(E)-3-壬烯酸、(E)-2-壬烯酸和4-乙基辛酸。可以看出,在整个煮制过程中,酮类、醇类和酸类物质含量与所占比例均较低。但部分酮、醇、酸类是形成杂环类化合物或其他风味物质的重要中间体[25],并对其他风味化合物起到一定的协同作用。比如滩羊肌肉产生的丙醛,可作为前体物质产生中间体丙酮,从而产生风味物质2,3-戊二酮,这与王亚娜等[26]对大足黑山羊肉挥发性风味物质进行分析后得出的结果具有一致性。
随着煮制温度和时间的升高,检出的杂环类化合物的种类和数量也增多。其中吡咯、2-甲基吡啶和二甲基三硫醚于50 ℃被检出,且含量随着煮制温度和时间的
变化呈先增后减的趋势,含量减少可能是在煮制过程中转化为其他的可挥发性化合物。4-甲基-5-羟乙基噻唑、2-戊基呋喃、2-甲基-5-(甲硫基)呋喃、2,3,5,6-四甲基吡嗪均于70~80 ℃时被检出,含量基本呈先增后减的趋势。2-甲基哌嗪、2-乙酰基噻唑、4-甲基-2-异丁基吡啶和二甲基二硫醚于煮沸后被检出,含量均呈先增后减,且初始含量均高于其他化合物的初始含量。苄基甲基硫醚于煮沸80 min后被检测出,推测为达到了该物质形成所需要的条件,且含量呈增长趋势。
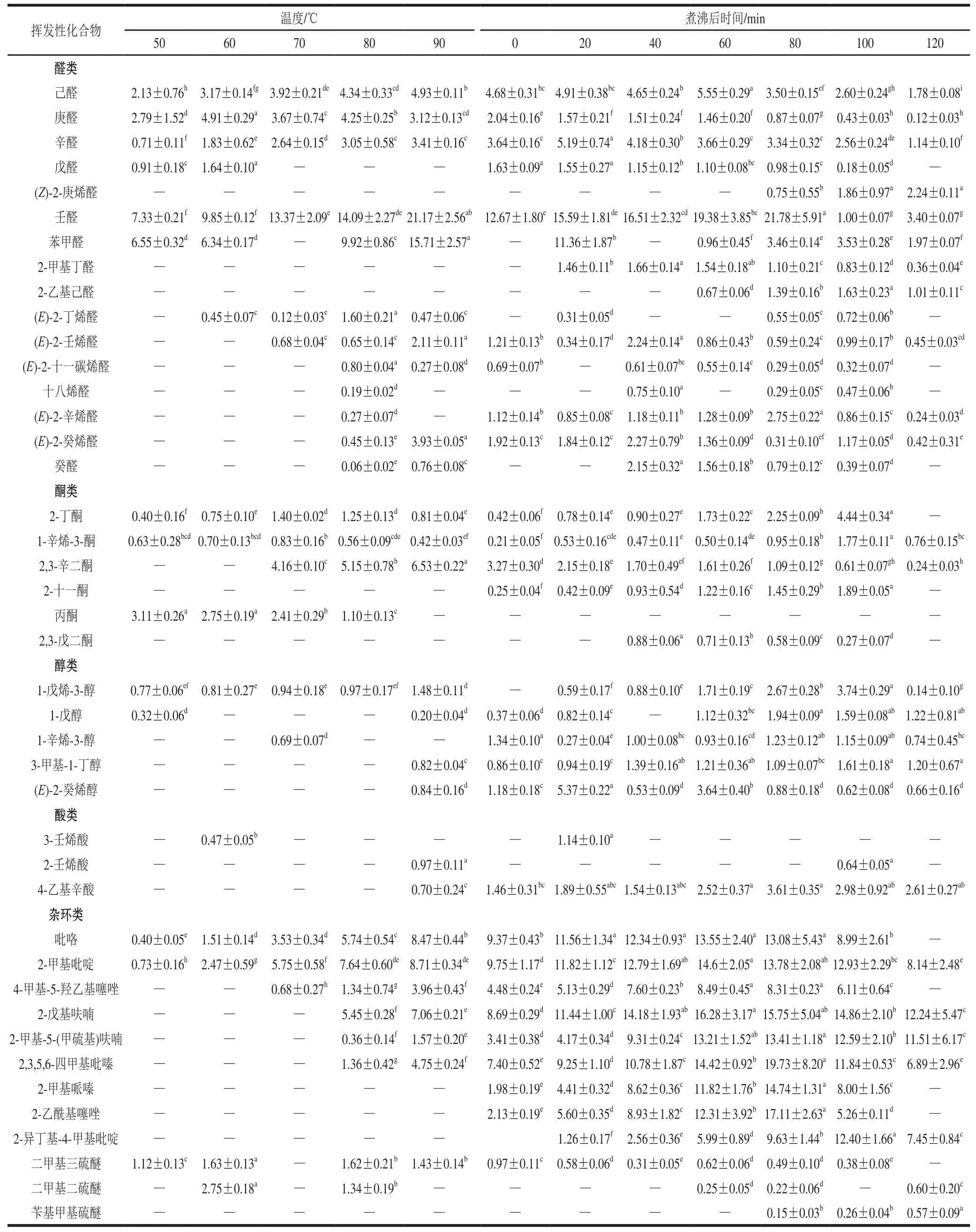
表1 滩羊肌肉煮制过程中挥发性化合物含量变化Table 1 Changes in volatile compounds contents during cooking of Tan sheep muscle μg/kg
基于以上分析可知,在肌肉煮制过程中,挥发性物质的种类总体呈增长趋势,如(Z)-2-庚烯醛和(E)-十八烯醛等随着加热温度的上升逐渐被检出;但其含量呈先增长后下降的趋势,如2-戊基呋喃,在80 ℃时检测到的相对含量为7.40%,且含量逐渐上升,至煮沸60 min后,相对含量由9.60%下降到8.40%。由Varavinit等[27]研究可知,含量增长的主要原因是风味前体物质随着煮制温度升高而增加直到达到了风味物质产生所需条件而被分解氧化。而含量下降是风味前体物质已基本被反应和挥发性物质溶于肉汤中多种可能因素导致的。在整个煮制过程中,因只采用滩羊肌肉作为样本,故美拉德反应及硫胺素降解反应为主要反应,但也不能排除有肌内脂肪如结构磷脂、甘油三酯等的存在,因不饱和脂质熔点较低,故在50~90 ℃时,醛类、酮类、醇类、酸类等,特别是以脂质氧化为主体被产生的醛类所占比例较大,但在煮沸后,2-甲基吡啶、吡咯和2-戊基呋喃等杂环类化合物占主要比例,与王瑞花[28]对红烧肉风味物质的研究结果一致。
2.2 基于GC-O技术的滩羊肌肉煮制过程挥发性风味物质分析
滩羊肌肉在煮沸80 min和100 min后产生挥发性物质种类较多,对其进行GC-O分析。如表2所示,共有29 种风味物质的检测率大于50%且OAV>1,可作为滩羊肌肉挥发性成分的特征气味物质。
由表2可知,在这些风味物质中OAV大于10的有呈青香的戊醛、可可香和麦芽香的2-甲基丁醛、蔬菜味的2-乙基己醛、果香的(E)-2-丁烯醛、果香味的(E)-2-辛烯醛、松香和青草味的(E)-2-癸烯醛、蘑菇味的1-辛烯-3-酮和1-戊烯-3-醇、肉香和坚果味的4-甲基-5-羟乙基噻唑、青香和肉香的2-戊基呋喃,它们对滩羊肌肉的整体风味具有较大贡献。然而,有些化合物含量虽低,但其对滩羊肌肉整体的风味贡献却大,如(E)-2-十一烯醛、4-乙基辛酸、4-甲基-5-羟乙基噻唑、2-戊基呋喃、2,3,5,6-四甲基吡嗪及苄基甲基硫醚等。詹萍[18]对不同产地的羊肉所产生的挥发性化合物进行检测,得出上述化合物是不同产地羊肉共有化合物的结论,与本实验结果一致。
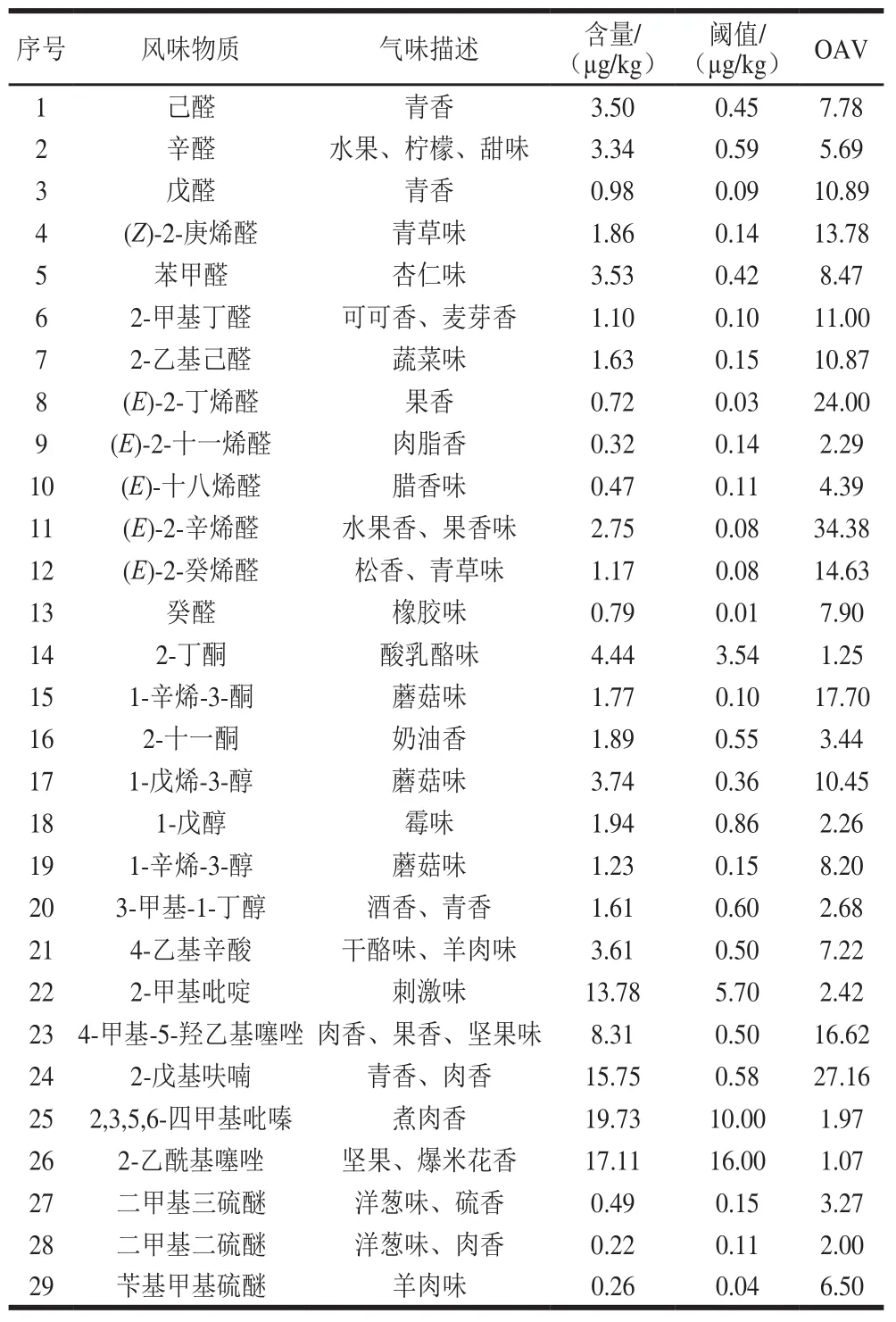
表2 滩羊肌肉中挥发性风味物质信息Table 2 Information about the characteristic volatile flavor substances of Tan sheep muscle
2.3 滩羊肌肉煮制过程中挥发性风味物质的形成
由表1和表2可知,滩羊肌肉在煮制过程中产生的挥发性风味物质在不同温度、不同时段均发生变化,也正是这些变化,使得滩羊肌肉整体风味更加饱满。
在煮制过程中风味物质形成的主要途径是美拉德反应以及与其相关的Strecker降解反应[29]。发生美拉德反应的前体物质有糖类、核苷酸、自由氨基酸、肽类等[30-31]。通过加热使得只具有咸腥味,基本无香味的生鲜肉产生醛类、呋喃衍生物、酮类、吡嗪类等挥发性风味物质[21,32]。由表1可看出,在煮制前期,滩羊肌肉中产生醛类、酮类、醇类、酸类等主要挥发性风味物质的含量占有较大比例。为进一步研究肌内脂肪对滩羊肌肉风味的影响,取与煮制所用同批次滩羊肌肉进行脂肪酸提取后,采用GC-MS技术对滩羊肌肉中的脂肪酸进行检测分析,结果如表3所示。

表3 滩羊肌内主要脂肪酸含量Table 3 Contents of main fatty acids in Tan sheep muscle
由表3可知,滩羊肌肉检出的脂肪酸有棕榈酸(40.35%)、硬脂酸(31.45%)、油酸(26.47%)、棕榈油酸(1.16%)、亚油酸(0.59%)、亚麻酸(0.11%),未检出肉豆蔻酸。罗玉龙等[33]检测了苏尼特羊和小尾寒羊中脂肪酸含量,得出棕榈酸、硬脂酸、油酸、亚油酸和花生四烯酸为这两种羊肉中的主要脂肪酸,且苏尼特羊肉中棕榈酸和硬脂酸含量高于小尾寒羊肉。由此可见,不同品种羊肉中所含脂肪酸含量也有所不同。在滩羊肌肉煮制过程中,由于肌内脂肪的存在,使得美拉德反应及硫胺素降解反应与脂肪发生交互反应,产生了醛类、酮类、醇类、酸类等挥发性风味物质。除此之外,美拉德反应和硫胺素降解反应也可产生。
醛类主要来源于脂肪的氧化降解,但Strecker降解反应也可产生醛类物质。Strecker降解是由氨基酸作为前体物质脱羧、脱氨后形成醛类。Varoujan等[34]研究表明:当美拉德反应产生戊糖和丁糖含羰基的降解产物如2,3-丁二酮和2-氧代丙醛等化合物时,可作为催化剂促进Strecker降解反应的发生,从而产生醛类。
酮类、醇类、酸类在滩羊肌肉中产生,一部分原因是肌内脂肪的存在,发生氧化降解反应产生酮类、醇类、酸类等挥发性风味化合物。另一部分原因是大多的支链醇来自氨基酸的Strecker降解,多数直链醇来自不饱和脂肪酸的氧化降解反应[35-36]。罗玉龙等[37]以苏尼特羊肌肉为研究对象,检测出醛类、醇类、酮类、酸类、烃类和其他化合物,同时还对肌内脂肪进行了研究,表明肌内不饱和脂肪酸的含量对风味产生起重要作用,与本研究结论一致。从而合理解释了为何主要产自于脂肪氧化的醛、酮、醇、酸类风味化合物会在滩羊肌肉中产生的现象。
在整个煮制后期检测出大量的杂环类化合物,其中具有肉香的二甲基二硫醚和硫香味的二甲基三硫醚因其具有独特的化学元素而使得肉品的风味更加丰富。这是因为当肉被加热,硫氨酸作为前体物质降解重排后生成噻唑、噻吩、呋喃及硫类等化合物[38-39],且核糖与半胱氨酸作为前体物质也可以产生硫化物,并成为肉制品中重要的风味化合物。由表1和表2可看出,呈硫香味和洋葱味的二甲基三硫醚及呈肉香味和洋葱味的二甲基二硫醚相继被检出,且其OAV均大于1,说明其对滩羊肌肉的风味的呈现具有重要的作用。
3 结 论
本实验以滩羊肌肉为研究对象,在50、60、70、80、90 ℃以及煮沸后0、20、40、60、80、100、120 min时采样,通过GC-MS及GC-O技术对12 组样品进行检测分析,共检测出42 种挥发性物质,即醛类(16 种)、酮类(6 种)、醇类(5 种)、酸类(3 种)和杂环化合物(12 种)。
研究表明,从滩羊肉中剔除脂肪后,由于肌肉组织中存在的少量脂质,在煮制前期,醛类、酮类、醇类等相对含量较大,如壬醛、苯甲醛等相对含量分别为26.27%和23.47%。但在煮制后期,这些物质便失去主导地位,低温美拉德反应特别是硫胺素降解反应所产生的吡咯、吡啶、噻唑等杂环类化合物开始占据有利地位,如2-戊基呋喃和2,3,5,6-四甲基吡嗪相对含量分别为17.59%和9.90%。但因挥发性风味物质的含量与其风味阈值关联性不大,对挥发性物质进行嗅闻技术检测及OAV定量后,确定如(E)-2-十一烯醛、4-乙基辛酸、2-戊基呋喃、2,3,5,6-四甲基吡嗪、二甲基二硫醚和苄基甲基硫醚等挥发性风味化合物为滩羊肌肉的主要风味物质。
依据挥发性风味物质随温度变化其种类及含量的变化规律,结合加热时美拉德反应和硫胺素降解的反应机理,本实验进一步分析了滩羊肌肉风味物质由前体(硫胺素、氨基酸、糖等)形成风味物质的过程。研究滩羊肌肉煮制过程中不同阶段所产生的可挥发性风味化合物,可为手抓羊肉、清炖羊肉等宁夏特色滩羊肉制品工业化加工风味控制提供理论参考。
