基于高通量测序对茅台镇酱香白酒主酿区霉菌菌群结构多样性的解析
2021-05-19朱治宇黄永光
朱治宇,黄永光
(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州 贵阳 550025)
以贵州茅台酒为代表的酱香型白酒工艺复杂、香气成分丰富,具有酱香突出、酒体醇厚、空杯留香持久等特点[1]。酱香白酒酿造是自然开放式、多菌固态发酵过程,其中开放式制曲和堆积发酵是网罗环境微生物必不可少的工艺[2],说明酿造环境中必然大量存在与发酵相关的微生物。王雪山[3]对清香白酒大曲、环境(地面、工具等)以及新厂和老厂之间进行了微生物多样性探究,结果表明不同环境中、不同厂区之间微生物种群结构均具有明显差异;任爱容等[4]采用传统可培养技术从酱香白酒大曲和环境中得到细菌28 个属,其中大曲18 个属、环境24 个属,结果表明大曲与环境微生态结构具有差异性,环境微生物多样性较高,为发酵提供了必需的微生物资源;Wang Qiang等[5]应用DGGE技术发现茅台酒发酵酒醅中多种微生物来源于大曲、窖泥、原料和环境(空气、灰尘和地面等);罗方雯等[6]应用高通量技术从酱香白酒酿造区域环境和大曲中检测到多种酵母,且大曲中90%以上的酵母来源于环境。由此可见,研究酿造环境微生物多样性对深入解析酱香白酒发酵机理具有重要意义。
大曲作为糖化发酵剂,富含多种酶系和微生物资源,对提升发酵动力和酒体风格具有重要意义[7-8],制曲过程包含细菌、酵母、霉菌等菌群结构的演替,其中霉菌在酿造过程发挥着重要作用,能产生糖化酶、蛋白酶、脂肪酶、淀粉酶等水解酶系,对降解发酵原料和产生白酒中呈香呈味物质具有重要贡献[9-10]。夏玙等[11]采用高通量测序分析大曲中真菌群落结构差异,发现嗜热子囊菌属(Thermoascus)、根毛霉属(Rhizomucor)、曲霉菌属(Aspergillus)等霉菌是大曲中的优势真菌类群;班世栋等[12]采用传统可培养技术从酱香型白酒大曲中分离得到Aspergillus、红曲霉属(Monascus)、毛霉属(Mucor)、青霉属(Penicillium)、Rhizomucor等19 株霉菌;李静心等[13]采用高通量测序技术从大曲中分离出Aspergillus、Thermomyces和Rhizomucor等优势霉菌。研究结果表明,酱香大曲中霉菌资源丰富,其复杂的菌群多样性结构和演替规律值得深入探讨。
本课题基于MiSeq平台,采用高通量测序技术系统性研究茅台镇主酿区生产大曲和酿造环境中霉菌菌群结构多样性(跟踪整个酱香白酒酿造周期)。实验样品来源于茅台镇酿酒企业相对集中的7 个主酿区,同时采用可培养技术完善数据并加以验证,采用统计学方法分析各主酿区之间、生产大曲和酿造环境之间霉菌菌群结构差异性,通过对比各主酿区霉菌多样性指数、富集率、衰减率和迁移率变化,以期为酱香白酒生产大曲和酿造环境微生态结构研究提供数据基础,并从微生物角度为酒厂的选址提供理论依据。课题组同时对各主酿区堆积发酵和窖池发酵过程中微生物结构多样性进行实验探究,以期完善酱香白酒微生物数据库的科学性和全面性。
1 材料与方法
1.1 材料与试剂
样品取自贵州省茅台镇TMS、GT、DDH等17 家酱香型白酒公司的白酒生产车间2018—2019年1~7轮次主酿区环境和大曲。
DNA Marker(TaKaRa)、磷酸盐缓冲液(phosphate buffered saline,PBS)、引物(合成) 生工生物工程(上海)股份有限公司;E.Z.N.A. Soil DNA Kit 美国Omega BioTek公司;异丙醇(分析纯)、TEA缓冲液北京索莱宝科技有限公司;琼脂糖 南京生兴生物技术有限公司;Goldview染料 上海赛百盛有限公司;rTaqDNA聚合酶试剂盒 北京全式金生物技术有限公司;AxyPrep DNA凝胶回收试剂盒 美国Axygen公司。
1.2 仪器与设备
G154DW高压蒸汽灭菌锅 致徽(厦门)仪器有限公司;台式高速冷冻离心机 德国Sigma公司;GeneAmp®9700型聚合酶链式反应(polymerase chain reaction,PCR)仪 美国ABI公司;DYY-8C型电泳仪北京六一仪器厂;JS-680C凝胶成像仪 上海培清科技有限公司;QuantiFluorTM-ST蓝色荧光定量系统 美国Promega公司;MiSeq测序仪 美国Illumina公司。
1.3 方法
1.3.1 样品采集
样品取自贵州省仁怀市茅台镇观音寺区、上坪村、椿树村、岩滩村、向阳村、卢荣坝村及合马镇街道社区共7 个酱香白酒主酿区的17 个代表性酿酒企业,2018年1—9月1~7轮次酒醅堆积发酵期间的酿造环境样品和生产使用大曲样品。环境样品采集:企业生产车间的晾堂、墙角地面土尘、灰尘,窗户玻璃、窗台、墙体、行车梯子、配电箱、消防箱、储酒罐表面的灰尘、粉尘,车间外地面、沟渠表面土质粉尘,对各采样点均进行固定、定期、定量采集样品,再将采样点采集的样品进行等量均值混匀,每个企业收集混合样500 g(1 个轮次、1 个企业),准确标记每个取样点以防被破坏,且每次都在相同取样点取样。大曲样品:在采集环境样品时于酿酒企业大曲曲房采集使用前的贮存曲样,每企业取样量500 g,采样大曲均为酿酒企业生产。
样品采集后均密封装袋,作为该轮次样品(17 个采集酿造企业1~7轮次共计119 个大曲样品和119 个环境样品),并立即运回实验室即时开展分析研究(24 h内),实验室留存样品均放置于-20 ℃冰柜贮存。按照区域划分将每个酒厂的样品等量混合为代表一个区域的最终混合样品(本实验采用共分为7 个区域,每个区域1 个最终混合样品,7 个轮次共计49 个大曲最终混合样品和49 个环境最终混合样品)。
1.3.2 样品处理
1)分别取1.3.1节最终混合样品各16 g于100 mL离心管中,用30 mL灭菌后的0.1 mol/L PBS悬浮,加入3~5 颗玻璃珠,旋涡振荡7 min,400 r/min离心5 min,取上清液。2)沉淀用PBS洗涤,旋涡振荡4 min,400 r/min离心5 min,收集上清液。3)将沉淀用PBS洗涤,旋涡振荡2 min,400 r/min离心5 min,收集上清液。全部上清液于12 000 r/min离心5 min,弃上清液,收集细胞沉淀。4)预处理结束后,根据E.Z.N.A.®soil DNA Kit的操作说明提取各样品中的微生物总DNA。
1.3.3 16S rDNA基因扩增及Illumina MiSeq测序
使用16S rDNA通用真菌引物ITS1F(5′-CTTGGTCATTTAGAGGAAGTAA-3′)和ITS2R(5′-GCTGCGTTCTTCATCGATGC-3′)对真菌ITS1FITS2R区域进行扩增。每个样本做3 个重复。将同一样品的PCR产物混合后用1.1%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒切胶回收PCR产物,Tris-HCl洗脱;1.1%琼脂糖电泳检测。
参照电泳初步定量结果,将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统进行检测并定量,再按照每个样本的测序量要求,进行相应比例的混合。连接“Y”字形接头,使用磁珠筛选去除接头自连片段,利用PCR扩增进行文库模板富集,氢氧化钠变性,产生单链DNA片段,制备MiSeq PE文库。再在Illumina MiSeq(PE300)平台上机测序[14]。
1.4 数据分析
采用WPS 2019进行数据统计,Origin 8.6绘制堆积柱状图和柱形图,RStudio绘制Upset plot、pheatmap、Venn图及和弦图。
2 结果与分析
2.1 霉菌多样性分析
采用堆积柱形图直观呈现样本中各霉菌的相对丰度(平均相对丰度>0.1%)。对茅台镇酱香白酒7 个主酿区大曲和环境样品霉菌的高通量测序结果进行统计分析,结果如图1所示。

图1 主酿区生产用大曲(a)和环境(b)霉菌群落结构多样性在属水平上的分布(相对丰度≥0.1%)Fig. 1 Genus-level distribution of mold community structure in Daqu (a)and environmental samples (b) from the main brewing areas (relative abundance ≥ 0.1%)
从7 个主酿区生产用大曲中共检出霉菌68 个属,有11 个属相对丰度至少在一个样品中超过0.1%(图1a),分别是:Aspergillus、Auxarthron、Byssochlamys、Microascus、Monascus、Penicillium、Rhizomucor、Rhizopus、Thermoascus、Thermomyces、Trichothecium。其中优势霉菌属(相对丰度≥1%)为Aspergillus(4.14%~11.8%)、Byssochlamys(13.0%~44.8%)、Monascus(1.41%~18.8%)、Thermoascus(25.9%~67.4%)、Thermomyces(7.70%~23.3%)、Rhizomucor(0.02%~5.70%)。由图1a可知,Thermoascus在区域1和区域6相对丰度均高于60%,是7 个区域大曲样品中平均相对丰度(48.8%)最高的优势霉菌,Thermoascus具有良好的酶分泌特性,产过氧化氢酶(除去过氧化氢等细胞毒性物质)、内切葡聚糖酶(纤维素酶系主要组成之一)、葡萄糖苷酶(分解葡萄糖苷键,是微生物代谢重要酶类之一)、角质酶(食品工业具有催化酯化作用)和几丁质酶(水解几丁质抑制真菌病原菌)等多种酶系[15];Byssochlamys平均相对丰度(22.8%)次之,具有耐热、耐低氧、耐酸和产果胶酶等特性[16];Monascus、Aspergillus、Rhizomucor等优势霉菌同样产酶丰富,为持续发酵和促进风味及其前体物质的形成提供动力[10,17-18]。本课题同时采用传统平板分离技术鉴定了7 个主酿区酱香大曲中的可培养霉菌,数据显示Aspergillus和Thermoascus是样品中的优势霉菌(平均相对丰度≥20%),与高通量分析结果对应性较好,但Monascus和Rhizomucor在可培养条件下相对丰度较小且Byssochlamys未筛出,可能是因为可培养与高通量技术存在检测手段和培养条件的不同,使检出结果存在一定差异,相比传统可培养技术,高通量测序分析能更全面与准确地分析样品的微生态结构[19]。郭敏等[7]应用高通量测序分析,从传统大曲、机械化大曲制曲过程样品中检出真菌共58 个属,大曲入曲房时优势霉菌包括Thermoascus、Thermomyces、Aspergillus等;第1次翻曲为Thermoascus、Thermomyces等;第2次翻曲为Byssochlamys、Aspergillus等;出房时为Byssochlamys、Thermomyces等,该实验对整个制曲过程微生态结构变化进行了解析,具有较高的参考价值。对比分析发现,本实验大曲样品中优势霉菌种类一致但检出量达到了68 个属,原因为采集了茅台镇大量的企业样品,样品丰富导致检测霉菌相对较多(更多对照结果见表1)。
从7 个主酿区环境中共检出霉菌89 个属,有26 个属相对丰度至少在一个样品中超过0.1%(图1b),分别是:Acremonium、Alternaria、Aspergillus、Byssochlamys、Cladosporium、Cyphellophora、Fusarium、Fusicolla、Gibberella、Kabatiella、Lecythophora、Microascus、Monascus、Mortierella、Mucor、Penicillium、Phoma、Pyrenochaeta、Rhizomucor、Rhizopus、Simplicillium、Talaromyces、Thermoascus、Thermomyces、Toxicocladosporium、Trichothecium。其中优势霉菌属(平均相对丰度≥1%)为Alternaria(0%~2.80%)、Aspergillus(10.4%~75.9%)、Byssochlamys(2.75%~13.8%)、Cladosporium(0.25%~31.0%)、Fusicolla(0%~2.08%)、Lecythophora(0%~10.7%)、Monascus(0.49%~10.2%)、Penicillium(0.56%~1.93%)、Phoma(0.01%~6.65%)、Pyrenochaeta(0%~22.9%)、Thermoascus(6.19%~49.0%)、Thermomyces(1.81%~12.4%)、Toxicocladosporium(0%~1.65%)。由此可知,在茅台镇酱香白酒主酿区环境中存在的霉菌多样性极其丰富,且部分霉菌(Aspergillus、Byssochlamys、Monascus、Thermoascus、Thermomyces等)在与大曲制曲、贮存、酒醅堆积发酵过程迁移到大曲、酒醅中,并得到富集,成为优势菌种主导发酵(表1),本实验与其他研究者检出的优势霉菌契合度较高,验证了优势霉菌的可靠性。通过对比7 个酱香白酒主酿区环境中的可培养霉菌数据,发现Mucor、Aspergillus、Monascus、Rhizomucor等优势霉菌在可培养中同样具有较高的丰度。研究发现虽然环境霉菌种类丰富,但并非都与发酵相关,如Phoma、Alternaria、Cladosporium等环境中的优势霉菌同时也是常见的病原菌,常寄生于植物引起多种病害[20-22],可能会由原料或环境迁移到酿造过程,这是需要防控的微生物。
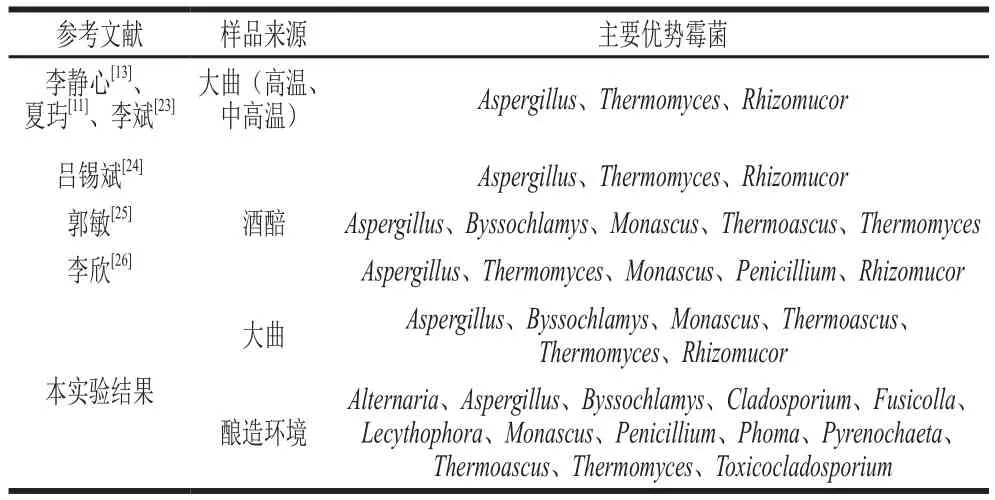
表1 基于高通量测序对主要优势霉菌的比较分析结果Table 1 Comparative analysis of dominant molds using high-throughput sequencing
综上结果表明,大曲中优势霉菌(相对丰度≥1%)种类与前人研究结果具有相似性,通过功能性分析发现这些优势霉菌有利于发酵;环境霉菌多样性丰富,提供益生菌的同时也存在大量丰度较高的病原菌,在生产上需要有效防控,尽量避免其迁移到发酵体系中。
2.2 各主酿区间霉菌差异性分析
运用软件RStudio绘制主酿区大曲霉菌(68 种)和环境霉菌(89 种)Upset plot分析各主酿区之间的霉菌差异性,如图2所示。结果表明7 个主酿区同时共有的霉菌占比为:大曲(18 种,26.47%)、环境(26 种,29.21%);而单独出现在1 个区域的霉菌占比为:大曲(21 种,30.88%)、环境(7 种,7.87%)。数据分析表明:1)在大曲样品中各主酿区霉菌种群结构差异性较高(高达30.88%),说明各主酿区可能因为原料来源、水源、制曲工艺和发酵环境等因素的影响,使其中微生物多样性产生较大差异。众所周知“曲为酒骨”,大曲中富含多种微生物及其代谢产物,推动了酒醅发酵和呈香物质及其前体物质的产生和富集[8],正是由于各主酿区大曲微生物种群差异性较高,才有可能导致各区域酒厂所酿酱香白酒质量的差异。2)在环境样品中各主酿区霉菌种群结构差异性较低(7.87%),而7 个主酿区同时共有的霉菌相似度较高(高达29.21%),说明茅台镇整个环境微生态结构具有相对稳定性,得天独厚的地理、气候条件造就了稳定的微生态大环境,正如“南橘北枳”一样,这也证实了“离开茅台镇,就酿不出茅台酒”的说法。
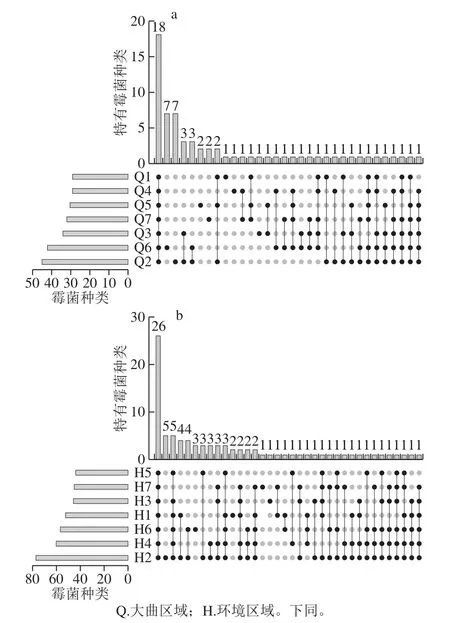
图2 各主酿区大曲(a)和环境(b)样品霉菌Upset plot分析Fig. 2 Upset plot analysis of mold communities in Daqu (a) and environmental samples (b) from the main brewing areas
为进一步统计分析不同区域大曲和环境样本中霉菌群落多样性,采用α多样性综合分析主酿区之间的霉菌多样性差异,绘制Shannon指数、Simpson指数和Pielou指数分析图,如图3所示。
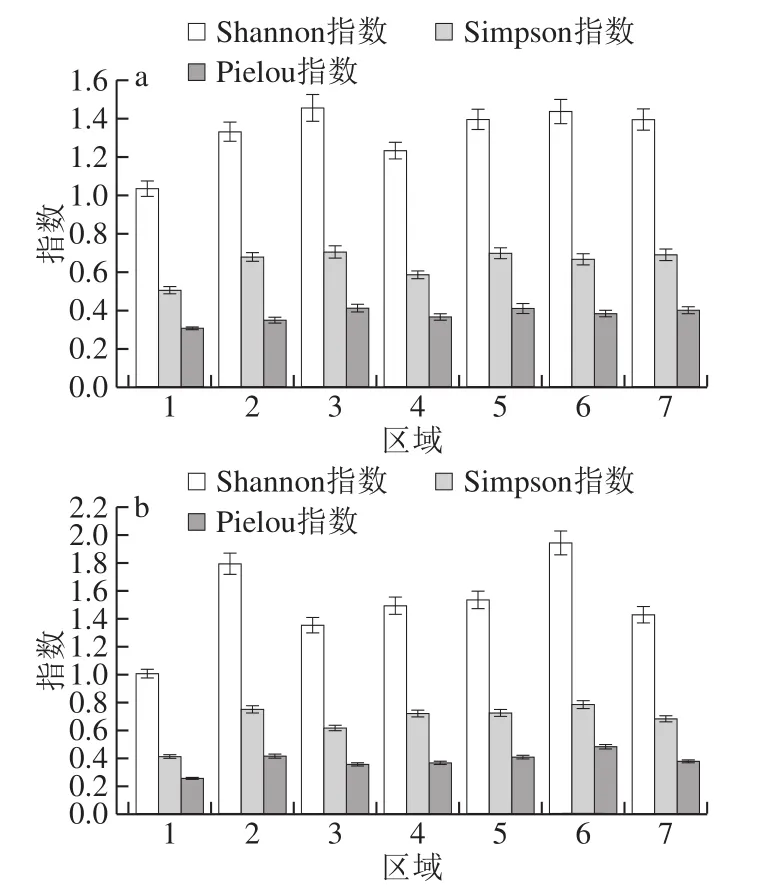
图3 主酿区大曲样品(a)和环境样品(b)霉菌多样性指数图Fig. 3 Mold diversity indexes of Daqu (a) and environmental samples (b)from the main brewing areas
图3 结果表明,茅台镇7 个主酿区霉菌多样性具有一定差异,其中大曲样品霉菌多样性区域3最高,区域1最低;环境样品霉菌多样性区域6最高,区域1最低,主酿区之间的差异表明各区域酒厂具有不同霉菌种群结构。综合对比发现除区域1、3外,其余区域环境样品霉菌多样性均高于大曲样品,说明环境样品中霉菌多样性普遍高于大曲样品,而酿造环境为酱香白酒堆积发酵和开放式制曲工艺提供了微生物基础。综合图1~3可知,区域2在7 个主酿区中微生态优势明显,原因如下:1)区域2环境和大曲样品中霉菌种类最多且多样性指数较高,具有霉菌种群资源优势;2)区域2大曲样品中霉菌种群结构稳定,有利于发酵的霉菌比重较大;3)酿造过程中Aspergillus分泌酸性糖化酶、蛋白酶等重要酶系,为发酵持续进行和风味物质形成发挥着重要作用[10],区域2环境样品中Aspergillus相对丰度最高(高达75.9%),迁移至大曲后同样具有较高的相对丰度(11.2%),表明区域2中Aspergillus含量高且对发酵环境胁迫耐受性较强,迁移至大曲后能够成为主导发酵的优势菌种。综上可知,区域2整体微生态环境相比其他区域优势明显,对提供发酵动力和提升酒体风格具有较大助力,该结论从微生物角度为酒厂的选址提供了理论依据。
2.3 主酿区生产大曲和酿造环境中霉菌种群结构差异性分析
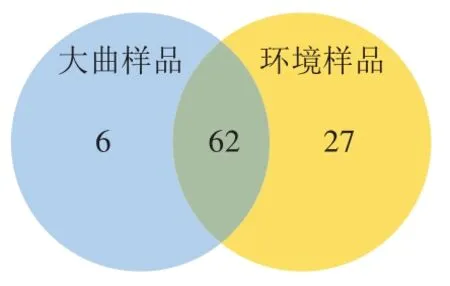
图4 主酿区环境和大曲样品霉菌属水平Venn图Fig. 4 Venn plot analysis of unique and shared molds between Daqu and environmental samples from the main brewing areas at the genus level
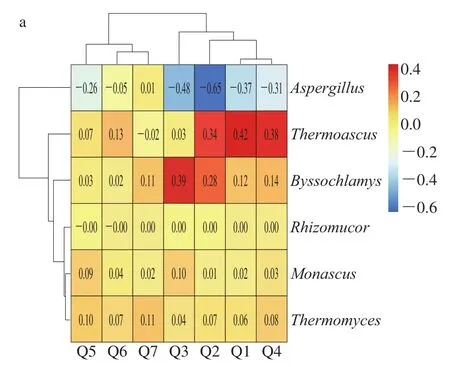

图5 主酿区大曲样品优势霉菌(属)富集率(a)和环境样品优势霉菌(属)衰减率(b)pheatmap分析Fig. 5 Pheatmap analysis of enrichment rate of dominant mold genera in Daqu samples from main brewing area (a) and decay rate of dominant mold genera in environmental samples (b)
绘制Venn图直观分析酱香白酒主酿区环境和大曲样品中霉菌属水平差异性。由图4可知,主酿区环境和大曲样品共检出95 种霉菌(属)包括大曲68 种和环境89 种,其中62 种霉菌同时在2 个类别的样品中检出,占大曲样品的91.18%和环境样品的69.66%。值得注意的是,大曲中8.82%的霉菌未在环境中发现,这部分霉菌可能来源于原料、空气或其他途径,说明环境绝非大曲获取微生物资源唯一途径,但大曲在曲房开放式发酵、贮存过程中与环境霉菌资源交互作用最为明显。
运用软件RStudio绘制pheatmap分析大曲样品6 种优势霉菌(属)富集率和环境样品13 种优势霉菌(属)衰减率(图5)。酱香大曲的陈曲过程是对环境微生物的网罗和筛选[27],并富集优势霉菌进入酒醅后迅速主导发酵。通过分析大曲样品6 种优势霉菌(属)的富集变化可知(图5a),Byssochlamys、Monascus、Thermoascus、Thermomyces、Rhizomucor等菌在制曲过程中发生了富集;通过分析环境样品13 种优势霉菌(属)的衰减变化可知(图5b),Alternaria、Aspergillus、Cladosporium、Fusicolla、Lecythophora、Penicillium、Phoma、Pyrenochaeta、Toxicocladosporium等菌在与大曲进行交互作用过程中发生了衰减。分析以上数据发现:1)各主酿区之间霉菌种群结构共性特征明显,具有相似的优势菌群结构。2)如图5b所示,环境中的优势霉菌迁移至大曲后因富集环境的变化而发生变化,甚至消亡(Pyrenochaeta)。由于酱香大曲制曲温度较高(高达58~65 ℃)[28],对酿酒微生物具有良好的筛选、富集特性,从而抑制了环境中多种酸败微生物的生长,促进了嗜热细菌、霉菌的繁殖[29]。另外,高温大曲在贮存环境富集的优势霉菌与发酵酒醅中的优势霉菌契合度非常高(表1),说明当大曲在贮存期从环境中富集的优势霉菌进入发酵酒醅后能够迅速调控发酵,这就是酱香高温大曲必须要经过6 个月的贮存、酱香白酒酿造用曲量大的根本原因。3)Aspergillus是大曲富集的优势霉菌,但富集率为负,对比可培养霉菌数据发现,曲霉种类繁多,通过平板培养在环境中发现17 种而在大曲中仅发现了8 种,由此可知,尽管曲霉同时作为大曲和环境样品中的优势霉菌,但大曲内部条件还是抑制了部分曲霉的生长。
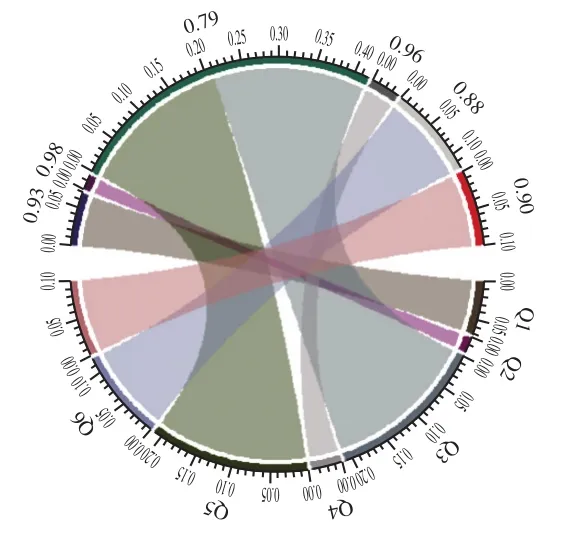
图6 各主酿区霉菌由环境至大曲的迁移率和弦图分析Fig. 6 Chord diagram analysis of mold migration from environment to Daqu in the main brewing areas
为进一步分析各主酿区环境中霉菌向大曲的迁移情况,运用软件RStudio绘制各主酿区霉菌由环境至大曲的迁移率和弦图(图6)。和弦越粗表示各主酿区环境霉菌向大曲的迁移率越低(小刻度数值越大迁移率越低),大刻度数值越大迁移率越高。由图6可知,各主酿区环境霉菌向大曲的迁移率略有不同(79%~98%),表明大曲中至少79%以上的霉菌来自环境中霉菌的迁移,而迁移率不同表明在不同环境中大曲和周围环境的交互程度存在差异。结合2.2节部分结论分析,可能由于各主酿区大曲微生物迁移率的不同,影响了整个大曲微生态结构,甚至影响了各主酿区酒体风格。
3 结 论
本课题基于MiSeq平台采用高通量测序技术,对茅台镇酱香白酒7 个主酿区酿造大曲和环境样品霉菌进行解析,共检出霉菌95 个属,其中从大曲样品中检出68 个属,环境样品中检出89 个属。通过对霉菌多样性结构分析,明确了Aspergillus、Byssochlamys、Monascus、Thermoascus、Thermomyces、Rhizomucor等是酱香白酒酿造大曲中的优势霉菌(相对丰度≥1%);Alternaria、Aspergillus、Byssochlamys、Cladosporium、Fusicolla、Lecythophora、Monascus、Penicillium、Phoma、Pyrenochaeta、Thermoascus、Thermomyces、Toxicocladosporium等是酱香白酒酿造环境中的优势霉菌。其中,大曲优势霉菌种类与前人研究重复率较高,通过功能性分析发现这些优势霉菌属有利于发酵;环境霉菌多样性丰富,提供益生菌的同时也存在大量丰度较高的病原菌,还需要复杂的发酵过程进行筛选。
通过对各主酿区霉菌差异性分析,发现各主酿区霉菌种群结构在大曲样品中的差异性较高,在环境样品中的差异性较低,但7 个主酿区同时共有的霉菌相似度较高,说明在茅台镇稳定的微生态大环境中,大曲微生物差异性赋予各区域酒厂酒体不同的风格特点;研究发现区域2酿造环境微生态结构相比其他区域优势明显,对提供发酵动力和提升酒体风格具有较大助力,该结论从微生物角度为酒厂的选址提供了理论依据;通过对主酿区生产大曲和酿造环境中霉菌种群结构差异性分析,发现大曲在曲房开放式发酵、贮存过程中与环境霉菌资源交互作用明显,但迁移率的不同表明在不同区域大曲和周围环境的交互程度存在差异,这种差异可能对整个大曲微生态结构甚至各主酿区酒体风格差异产生重要影响。
