焦磷酸钠对腺嘌呤核苷三磷酸解离氧化肌动球蛋白的影响
2021-05-19吕博文耿晓茜张月姝李春强邵俊花
吕博文,耿晓茜,张月姝,于 泽,李春强,邵俊花
(沈阳农业大学食品学院,辽宁 沈阳 110866)
肌肉具有较高的营养价值,但是在贮藏和加工过程中汁液易流失,导致肉制品持水性差、口感粗糙。为了提高产品的多汁性和食用口感,焦磷酸钠(sodium pyrophosphate,TSPP)、三聚磷酸钠和六偏磷酸钠等碱性磷酸盐常用于肉制品中,通过调节pH值[1]、增加离子强度[2]、螯合金属离子[3]、解离肌动球蛋白[4]等机制改善肉制品的品质[5-7]。其中TSPP应用最为普遍,其关键作用机制是可以解离肌动球蛋白。动物屠宰发生僵直后,由于腺嘌呤核苷三磷酸(adenosine triphosphate,ATP)的缺乏,肌肉中的肌球蛋白和肌动蛋白以肌动球蛋白的形式存在,持水力差。TSPP是ATP的结构类似物,且与肌球蛋白头部S1活性部位中ATP结合位点相同或相近[8-9],可将部分肌动球蛋白解离为肌球蛋白和肌动蛋白[4]。在肉制品加工过程中,焦磷酸盐结合粉碎、混合、滚揉按摩等操作,会使肌原纤维解体,产生游离的肌球蛋白和肌动蛋白,持水能力和凝胶能力大大增加,故可提高肉及肉制品的持水性、嫩度和质地等品质[7,10-11]。而且,在盐(≥0.4 mmol/L)和TSPP同时存在时,肌动球蛋白在解离的同时伴随着粗丝解聚和肌原纤维膨胀,更多的水分被包裹在肌纤维内部,也会提高肌肉的持水性[12]。一般认为,足够量ATP作用于肌动球蛋白时,会使其完全解离,但TSPP作用于肌动球蛋白会发生何种程度的解离尚不清楚。
此外,由于肌肉蛋白富含金属离子、脂肪和血红素类化合物等促氧化物质,在冷冻、贮藏和加工过程中易被氧化,导致肌肉蛋白结构发生变化[13]。Li Chunqiang等[14]研究表明,蛋白氧化能够封闭肌球蛋白头部S1活性部位中的SH1和SH2(活性巯基),使肌球蛋白头部S1结构发生巨大变化,影响ATPase活性。而刘泽龙[15]和孙悦等[16]研究表明,1 mmol/L TSPP的加入能够在一定程度上抑制蛋白氧化。而TSPP对蛋白氧化的抑制作用是否会影响ATP的完全解离作用还鲜有报道。因此,本实验采用从猪外脊肉中提取的肌动球蛋白为研究对象,以羟自由基氧化系统为模型,研究TSPP的解离效果及其对ATP解离不同氧化程度肌动球蛋白的影响,旨在为TSPP在肉制品中应用和调控提供一定理论依据。
1 材料与方法
1.1 材料与试剂
本实验选取宰后24 h内pH 5.5左右的金球牌猪外脊肉作为提取肌动球蛋白的原料,购买于辽宁沈阳兴隆大家庭超市,猪品种为大白猪。
6-羟基-2,5,7,8-四甲基色烷-2-羧酸、ATP上海麦克林生化科技有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)、TSPP、NaHCO3、Na2CO3、H2O2、乙二胺四乙酸二钠(ethylenediaminetetraacetic acid disodium salt,EDTA-2Na)国药集团化学试剂有限公司;5,5′-二硫代双(2-硝基苯甲酸)(5,5′-dithiobis-(2-nitrobenzoic acid),DTNB)、盐酸胍、β-巯基乙醇(β-mercaptoethanol,β-ME)、哌嗪-N,N′-(2-乙磺酸)(piperazine-N,N′-bis(2-ethanesulfonic acid),PIPES) 美国GENVIEW生化试剂公司;N-乙基马来酰亚胺(N-ethylmaleimide,N-EM) 百灵威科技有限公司;没食子酸丙酯(propyl gallate,PG) 上海瑞永生物科技有限公司。
1.2 仪器与设备
DS-1高速组织捣碎机 无锡沃信仪器有限公司;AUY120电子分析天平 日本岛津公司;STARTER2100 pH计 奥豪斯仪器有限公司;DJ-1磁力搅拌器 常州荣华仪器有限公司;奥氏黏度计 沈阳腾龙玻璃仪器公司;Cary 50紫外-可见光分光光度计 美国Varian公司;5804R高速冷冻离心机 德国Etsppendorf公司;Zeta Sizer Nano series激光粒度仪 马尔文仪器有限公司;HT 7700透射电子显微镜 日立高新技术公司;GE-250电泳仪、AI600 UV超灵敏多功能成像仪 美国通用电气公司。
1.3 方法
1.3.1 肌动球蛋白提取
根据Perry等[17]的方法,将10 倍体积的Weber溶液(0.6 mol/L KCl、0.01 mol/L Na2CO3、0.04 mol/L NaHCO3)加入猪外脊肉中,采用高速组织捣碎机以12 000 r/min转速于4 ℃匀浆。将匀浆液密封放入冰盆中,置于磁力搅拌器上低速搅拌24 h后,用100 目绢布过滤。在滤液中加入蒸馏水,将KCl浓度稀释到0.2 mol/L,12 000 r/min、4 ℃离心20 min,所得沉淀中加入0.2 mol/L KCl溶液于4 ℃、12 000 r/min匀浆,12 000 r/min离心20 min,沉淀即为肌动球蛋白。提取出来的肌动球蛋白密封放在4 ℃冰箱中,18 h内用完。蛋白浓度采用双缩脲法测定[18],以牛血清蛋白作为标准蛋白。
1.3.2 肌动球蛋白TSPP处理
5 mg/mL肌动球蛋白分散于含有1 mmol/L TSPP、2 mmol/L MgCl2、0.6 mol/L NaCl的15 mmol/L PIPES缓冲液(pH 6.25)中,于4 ℃反应2 h。未加TSPP和MgCl2的蛋白溶液作为空白对照。
1.3.3 肌动球蛋白氧化处理
经TSPP处理(+TSPP)和未经TSPP处理(-TSPP)的肌动球蛋白溶液(5 mg/mL)中,添加Fenton试剂(0.01 mmol/L FeCl3,0.1 mmol/L抗坏血酸,1、5、10、20 mmol/L H2O2)于4 ℃氧化2 h,添加PG、Trolox和EDTA-2Na(终浓度各1 mmol/L)终止氧化反应。不加氧化剂(FeCl3/抗坏血酸/H2O2)且在相同条件下处理的蛋白作为空白对照。
1.3.4 羰基含量测定
将5 mg/mL肌动球蛋白溶液与含10 mmol/L DNPH的2 mol/L HCl溶液以1∶5的比例混合,按照Levine等[19]的方法测定羰基含量。反应后的样品在370 nm波长处测定羰基含量,280 nm波长处测定蛋白含量,用摩尔吸光系数为22 000 L/(mol·cm)计算羰基含量。
1.3.5 总巯基含量测定
肌动球蛋白用含0.6 mol/L NaCl的15 mmol/L PIPES缓冲液(pH 6.25)稀释为2 mg/mL,根据Liu等[20]的DTNB法测定总巯基含量。反应后的样品于412 nm波长读数,根据摩尔吸光系数13 600 L/(mol·cm)计算巯基含量。
1.3.6 完全解离处理
将TSPP和氧化处理的肌动球蛋白分散于含有5 mmol/L ATP、0.6 mol/L NaCl的15 mmol/L PIPES缓冲液(pH 6.25)中使其完全解离,未加ATP的蛋白溶液作空白对照。
1.3.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
参考Li Chunqiang[21]的方法并稍加改动。采用12%分离胶和5%浓缩胶分析TSPP、氧化处理后肌动球蛋白的聚集变化。4 mg/mL样品与等体积含或不含10%β-ME的上样缓冲液混合,置于沸水中煮沸3 min,每孔进样量为20 μg蛋白。电泳凝胶用含1 mg/mL考马斯亮兰R250、50%甲醇和6.8%冰乙酸的溶液染色40 min,随后用含5%甲醇和7.5%冰乙酸的脱色液脱色过夜。脱色后的胶片拍照,并用自带软件对条带密度进行分析。
1.3.8 黏度的测定
为了解TSPP对不同氧化程度的肌动球蛋白解离情况的影响,根据Granicher等[22]采用黏度法(特性黏数)反映此过程的变化趋势。将1.5 mg/mL蛋白加入到奥氏黏度计中,竖直放置黏度计并记录不同处理的蛋白溶液的流出时间。特性黏数的计算公式如下:
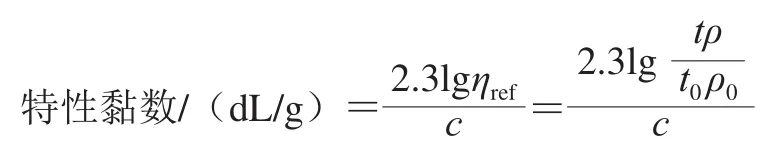
式中:ηref为相对黏度(无量纲);t和ρ分别为肌动球蛋白的流出时间和密度;t0和ρ0分别为溶剂的流出时间和密度;c为蛋白质量浓度/(g/dL)。
1.3.9 粒径分布测定
1.5 mg/mL肌动球蛋白样品分散于含有0.6 mol/L NaCl的15 mmol/L PIPES缓冲液(pH 6.25)中,分别使用激光粒度仪测量不同条件下处理样品的粒径分布,其中激光波长为633 nm,散射光强检测器角度为173°。结果用3 次测定的平均粒径表示[23]。
1.3.10 肌动球蛋白形态观察
将0.1 mg/mL肌动球蛋白直接滴在铜网上,另滴加一滴负染液(2%磷钨酸)染色10 min。采用透射电子显微镜观察肌动球蛋白的形态变化,加速电压采用100 kV[24]。
1.4 统计分析
本实验所有数据均为至少3 次重复的平均值。使用Statistix 9软件进行方差分析和显著性分析(最小显著性差异法),定量分析统计图使用Origin 8.5绘制。
2 结果与分析
2.1 TSPP对肌动球蛋白氧化程度的影响
2.1.1 羰基含量
有研究表明,蛋白氧化会引起氨基酸侧链修饰和肽链断裂,均生成羰基衍生物,所以羰基是描述蛋白氧化程度的标志物之一[13]。如图1所示,对于-TSPP样品,羰基含量随着H2O2浓度的升高而显著升高(P<0.05)。当H2O2浓度为20 mmol/L时,羰基含量是未氧化蛋白的4 倍左右。虽然在相同氧化程度下+TSPP样品与-TSPP样品的羰基含量差异不显著(P>0.05),但是-TSPP样品在未氧化和1 mmol/L H2O2时均比+TSPP样品的羰基含量稍高,并且经过多次重复实验均得到同样结果,这说明在1 mmol/L H2O2条件下,TSPP能抑制羰基衍生物的生成。然而,在H2O2浓度大于5 mmol/L时,+TSPP样品的羰基含量稍高,但与-TSPP样品的蛋白羰基含量没有显著差异(P>0.05),说明TSPP并不能抑制肌动球蛋白中羰基的生成。
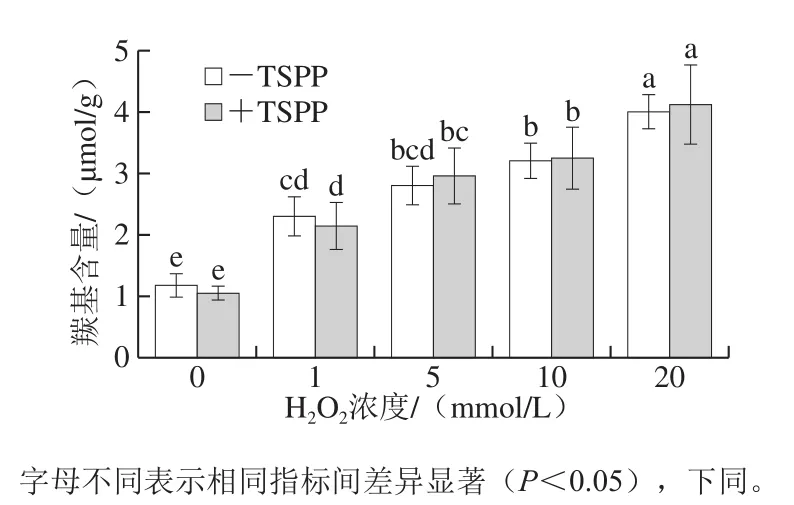
图1 TSPP对肌动球蛋白羰基含量的影响Fig. 1 Effect of TSPP on carbonyl content of actomyosin
2.1.2 巯基含量
肌动球蛋白是由肌动蛋白和肌球蛋白组成的,而每个肌动蛋白中大约含有5 个巯基,每个肌球蛋白中大约含有40 个巯基,并且这些巯基易受羟自由基的攻击而转换成分子内或分子间的二硫键,从而导致蛋白氧化发生交联[25-26]。因此,巯基含量的变化可以直接反映肌动球蛋白的氧化程度。由图2所示,巯基含量随着H2O2浓度增大而显著降低(P<0.05)。-TSPP样品和+TSPP样品在未氧化时巯基含量分别为52.07 μmol/g和54.81 μmol/g,当H2O2浓度为5 mmol/L时,巯基含量分别下降了56.54%和47.27%,当H2O2浓度升高至20 mmol/L时,巯基含量分别下降了84.82%和84.36%,说明1~5 mmol/L H2O2时,TSPP对肌动球蛋白中巯基的氧化起到一定的保护作用,而10~20 mmol/L H2O2时保护作用不明显。
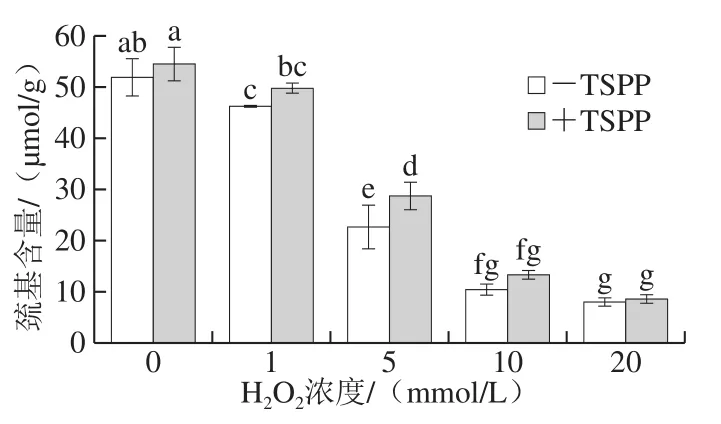
图2 TSPP对肌动球蛋白巯基含量的影响Fig. 2 Effect of TSPP on sulfydryl content of actomyosin
2.1.3 SDS-PAGE分析
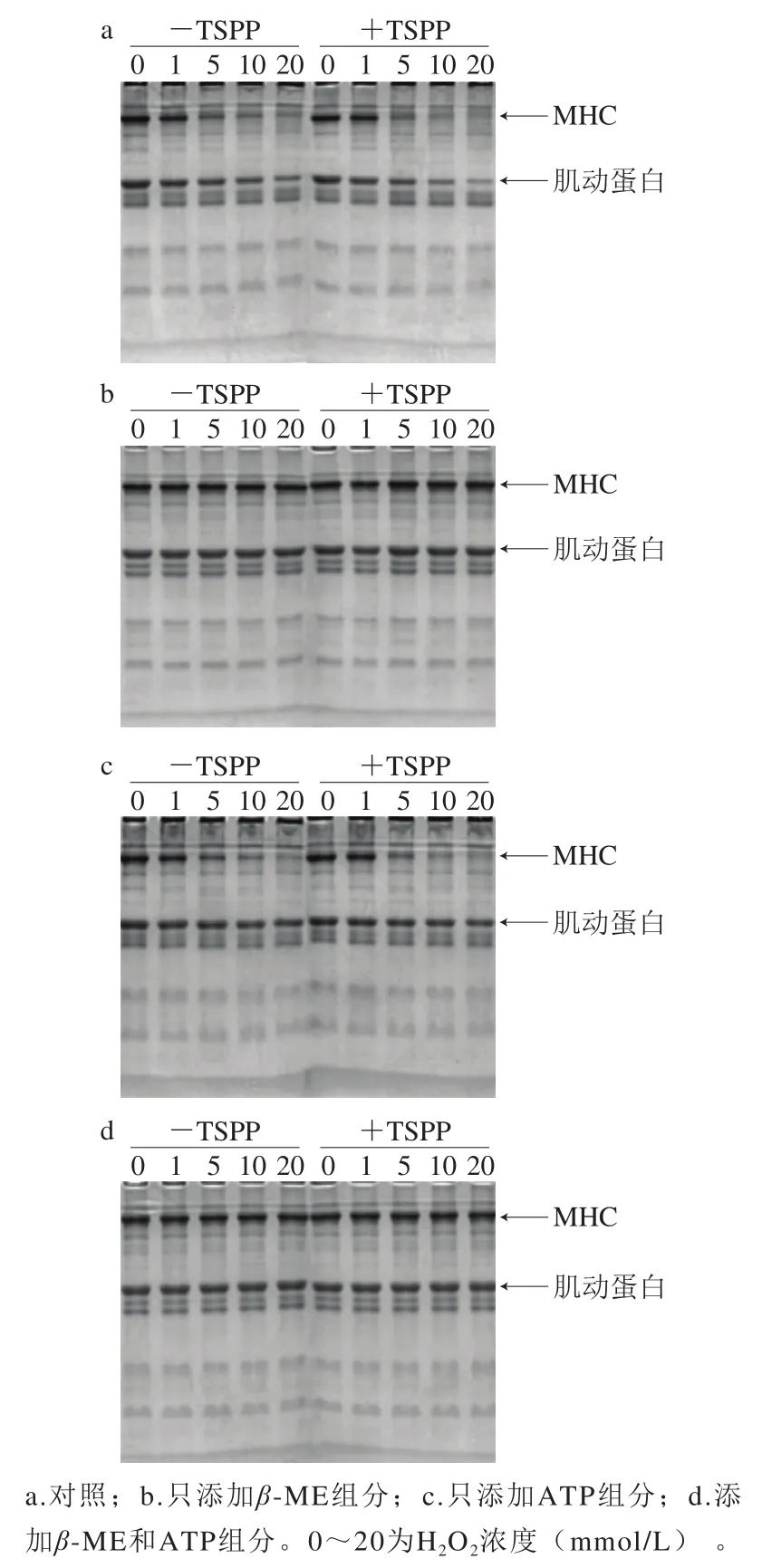
图3 TSPP处理后肌动球蛋白的SDS-PAGE模式Fig. 3 SDS-PAGE patterns of actomyosin treated with TSPP
如图3a所示,与未氧化样品相比,随着H2O2浓度的增加,-TSPP样品和+TSPP样品中的肌球蛋白重链(myosin heavy chain,MHC)和肌动蛋白均逐渐降低,当H2O2浓度增加到20 mmol/L时,MHC几乎完全消失,肌动蛋白条带也明显减少。但是随着氧化程度的增加,相对于未氧化的MHC和肌动蛋白,MHC条带减少幅度远大于肌动蛋白,说明肌球蛋白比肌动蛋白更易于氧化,与Li Chunqiang等[21]结果相符。这说明,肌动球蛋白氧化时,主要是其中的肌球蛋白发生氧化。在肌球蛋白和肌动蛋白条带减少的同时,在浓缩胶上部出现大分子聚合物,但加入还原剂β-ME后,几乎所有聚集体都消失,同时减少的MHC和肌动蛋白大部分恢复,说明这些大分子聚集体主要是通过二硫键形成的。Xiong[26]和Li Chunqiang[21]等指出羟自由基攻击肌球蛋白时,二硫键主要通过肌球蛋白尾部-尾部模式进行交联。然而,肌动蛋白中二硫键交联模式研究较少,目前尚不明确。
利用AI600超灵敏多功能成像仪对图3a、c中的MHC和肌动蛋白条带进行扫描,获得条带密度,如图4所示。对于未氧化蛋白,+TSPP和-TSPP样品的MHC条带密度之间没有明显差异。在H2O2浓度1 mmol/L时,+TSPP样品的MHC条带密度明显高于-TSPP样品,说明TSPP对MHC的氧化具有较好的抑制作用。然而,当H2O2浓度为10~20 mmol/L时,+TSPP样品的MHC条带密度只是稍高于-TSPP样品,对MHC氧化的抑制作用不明显。
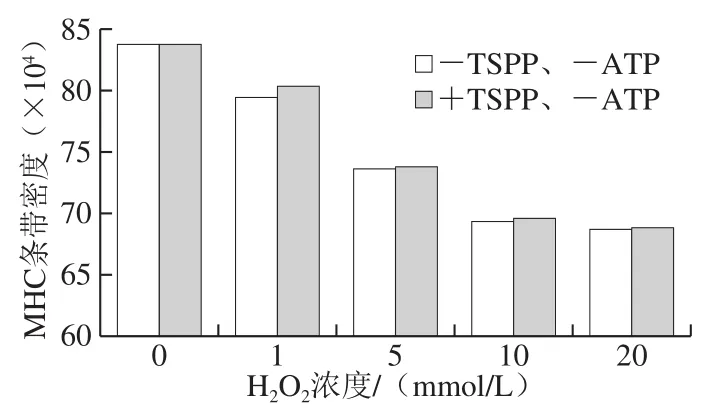
图4 TSPP对MHC条带密度的影响Fig. 4 Effect of TSPP on the density of MHC band
当受到羟自由基攻击时,肌肉蛋白会发生多种变化,如氨基酸修饰、肽链断裂和蛋白交联等[13],故TSPP对肌动球蛋白氧化的影响需要根据多个指标进行综合判定。综合分析羰基、巯基和SDS-PAGE结果可以看出,在H2O2浓度为1 mmol/L时,TSPP抑制肌动球蛋白的氧化;而H2O2浓度为5~20 mmol/L时,TSPP对肌动球蛋白的氧化无抑制作用。刘泽龙[15]研究发现,在0.01 mmol/L FeCl3、0.1 mmol/L抗坏血酸和0.5 mmol/L H2O2条件氧化肌球蛋白,TSPP对肌球蛋白头部S1和S2颈部起到保护作用,减弱羟自由基攻击作用。这说明在一定氧化条件下,TSPP对肌肉蛋白确实存在一定的氧化保护作用。
2.2 TSPP对ATP解离作用的影响
2.2.1 黏度
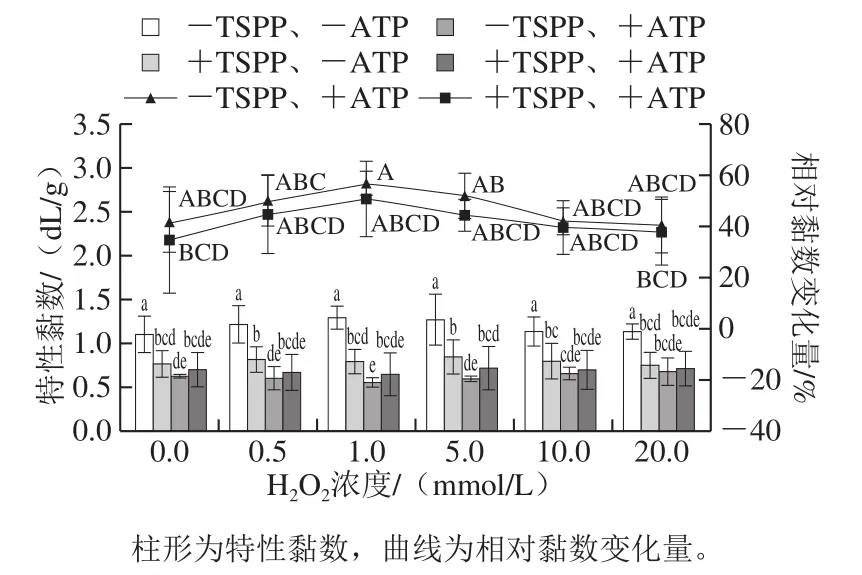
图5 TSPP和ATP相继处理后肌动球蛋白特性黏数的变化Fig. 5 Changes in intrinsic viscosity of actomyosin after being treated with TSPP and then completely dissociated with ATP
如图5所示,相对于其他3 组样品(+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),未经TSPP和ATP处理(-TSPP、-ATP)样品的特性黏数最大,为1.10~1.29 dL/g,说明该组样品的黏度最大,随着H2O2浓度的增加,-TSPP、-ATP样品的特性黏数出现先增高后降低的趋势,但是差异并不显著(P>0.05),说明蛋白氧化对黏度影响不大。在TSPP条件下,肌动球蛋白的特性黏数显著下降(P<0.05),鉴于氧化对肌动球蛋白的黏度影响不大,推测黏度显著下降是由肌动球蛋白发生部分解离[4]引起的。当加入ATP后,不管是否经过TSPP处理,特性黏数均继续下降,说明肌动球蛋白发生进一步的解离,但是+TSPP肌动球蛋白的特性黏数却稍高于-TSPP肌动球蛋白,说明TSPP的加入不利于ATP的解离作用,一种推测可能是由于焦磷酸盐的结合位点与ATP的结合位点相同,存在竞争关系。有研究表明,焦磷酸盐和ATP在肌球蛋白上的结合位点相同或相近[8-9],而本研究证明二者的结合位点是相同的。另一种推测可能是由于焦磷酸盐结合到肌球蛋白头部S1后,改变了ATP结合位点的结构,从而影响ATP的解离作用。对于未氧化肌动球蛋白,TSPP和ATP单独作用下特性黏数分别下降了30.4%和41.9%,说明TSPP解离效果是ATP的72.6%,表明焦磷酸盐可使大部分肌动球蛋白解离,但仍有部分肌动球蛋白无法解离。
为了排除氧化自身对特性黏数的影响,以-TSPP、-ATP样品为对照,计算-TSPP、+ATP和+TSPP、+ATP样品中由ATP解离引起的相对黏数变化量。如图5所示,在-TSPP和+TSPP条件下,氧化样品的相对黏数变化量几乎都稍高于未氧化样品。而且,随着氧化程度的增加,-TSPP和+TSPP样品的相对黏数变化量均先上升后下降,在H2O2浓度1 mmol/L时相对黏数变化量最大。虽然1 mmol/L H2O2样品与其他氧化程度样品的相对黏数变化量差异不显著,但是在每次重复实验中均出现此趋势,说明无论是否存在TSPP,适度蛋白氧化都有利于ATP的解离作用,且氧化程度与TSPP和ATP的解离作用之间确实存在一定关系,推测可能是氧化修饰改变了肌球蛋白头部与肌动蛋白结合位点的化学变化,也可能是氧化引起的蛋白结构展开更有利于ATP接近解离结合位点。刘泽龙[15]在低盐(0.1 mol/L)条件下利用1 mmol/L H2O2羟自由基氧化系统氧化5 mg/mL肌动球蛋白6 h和12 h,采用与本实验相同的方法测定黏度,发现氧化对ATP的解离作用没有显著影响,但若观察相对黏数变化量,可以看出氧化样品的相对黏数变化量明显小于未氧化样品,跟本研究得到的结果有一些差异。分析这2 种结果的差异,推测与盐浓度有关,因为肌原纤维在低盐和高盐时,结构存在很大差异,例如高盐更有利于肌原纤维膨胀和肌球蛋白的溶出[12,27]、增加肌原纤维静电斥力等[28],可能会弱化ATP与肌球蛋白头部的结合。
2.2.2 平均粒径
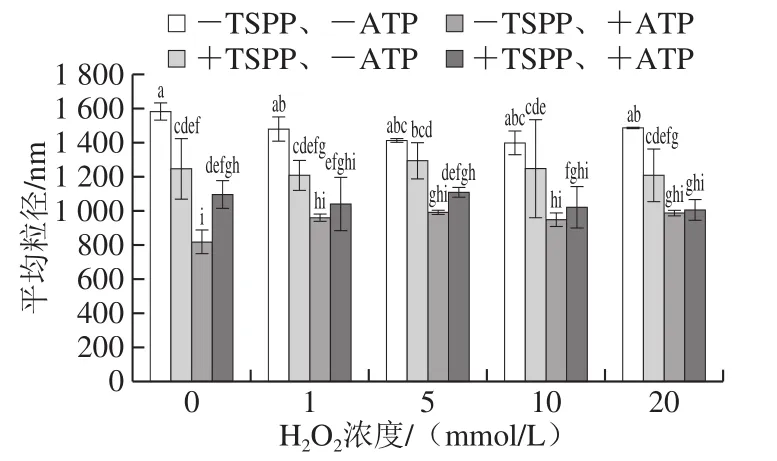
图6 TSPP和ATP相继处理后肌动球蛋白平均粒径的变化Fig. 6 Changes in average particle size of actomyosin after being treated with TSPP and then completely dissociated with ATP
由于肌动球蛋白解离生成肌动蛋白和肌球蛋白,粒径会随解离进行而发生改变,所以可通过测量平均粒径评判解离程度的高低[15]。TSPP和ATP处理后,不同氧化程度肌动球蛋白的平均粒径变化如图6所示。可以看出,-TSPP、-ATP肌动球蛋白的平均粒径最大。TSPP处理后,肌动球蛋白的平均粒径均显著减小(P<0.05),说明部分肌动球蛋白在TSPP作用下解离为肌球蛋白和肌动蛋白,导致平均粒径变小。加入ATP后,平均粒径进一步显著减小(P<0.05),说明肌动球蛋白进一步发生解离,但是+TSPP、+ATP肌动球蛋白的平均粒径却高于-TSPP、+ATP肌动球蛋白,间接说明TSPP的加入不利于ATP的解离作用。TSPP和ATP单独作用时,未氧化肌动球蛋白的平均粒径分别下降了21.2%和48.4%,TSPP处理样品平均粒径的下降幅度是ATP处理样品的43.8%。对于4 组样品(-TSPP、-ATP;+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),每一组样品随H2O2浓度的变化差异均不显著,说明TSPP和ATP对粒径的影响远大于蛋白氧化。总体来看,平均粒径和黏度的变化趋势非常相似,进一步印证了TSPP和ATP的解离作用。
2.2.3 微观结构
应用透射电子显微镜观察TSPP及ATP处理后不同氧化程度的肌动球蛋白的解离情况,如图7所示。未经TSPP和ATP处理时,未氧化的肌动球蛋白呈较长的纤维状,此时肌球蛋白头部与丝状结构的F-肌动蛋白[29]呈结合状态。单独加入TSPP或ATP后,肌动球蛋白解离,导致蛋白的结构相对松散,生成较短的纤维簇,而且+ATP样品中蛋白纤维长度比+TSPP样品更短,说明ATP解离效果更好。此外,还可以看出相对于单独+TSPP样品,单独+ATP样品中出现更多离散的纤维结。张军等[30]报道在含有2 mmol/L MgCl2、100 mmol/L KCl、1 mmol/L DTT和1 mmol/L ATP的5 mmol/L Tris-Cl缓冲液(pH 7.5)中及没有微丝稳定剂(鬼笔环肽)存在的条件下,肌动蛋白微丝之间会相互缠绕或者形成多级螺旋的纤维结构,自组装成离散的、大尺度的复杂聚集结构。在TSPP处理样品中加入ATP,可以看出肌动球蛋白解离效果不如单独使用ATP,存在一些稍长的纤维,这与图5和图6结果相符,说明TSPP的加入反而会在一定程度上抑制ATP的解离效果。
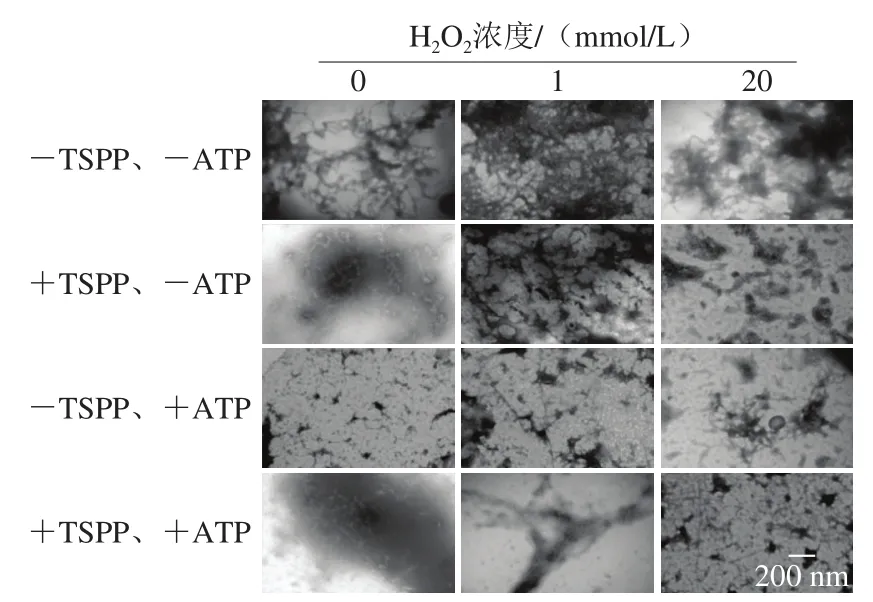
图7 TSPP和ATP相继处理后肌动球蛋白形态变化Fig. 7 Morphological changes of actomyosin after being treated with TSPP and then completely dissociated with ATP
4 组样品(-TSPP、-ATP;+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),随着H2O2浓度的增加,均发生蛋白聚集现象。对于-TSPP、-ATP样品,当H2O2浓度为1 mmol/L时,纤维状的肌动球蛋白聚集成空洞比较疏松的网状结构;当H2O2浓度继续增加为20 mmol/L时,疏松的网状结构被破坏,大量肌动球蛋白聚集成致密的蛋白团块。对于其他3 组解离样品(+TSPP、-ATP;-TSPP、+ATP;+TSPP、+ATP),由于肌动球蛋白解离成肌球蛋白和肌动蛋白,虽然氧化程度增加,但是蛋白聚集程度比-TSPP、-ATP样品弱,结构较松散。总体来说,3 组样品的聚集程度由强到弱依次是:+TSPP、-ATP>+TSPP、+ATP>-TSPP、+ATP。其中+TSPP、-ATP和+TSPP、+ATP样品中存在不同程度的蛋白网络结构,而-TSPP、+ATP样品中几乎很少有密集的网络状蛋白聚集结构,这应该是因为3 种处理条件下,肌动球蛋白解离程度不同所致。
3 结 论
适度氧化(例如1 mmol/L H2O2Fenton试剂氧化2 h)时,TSPP对肌动球蛋白的氧化起到一定的抑制作用,而氧化程度加深时(例如20 mmol/L H2O2),TSPP的抑制作用不明显。蛋白氧化在某种程度上有利于ATP的解离作用,然而,这种作用会被TSPP弱化,可能与TSPP与ATP结合位点相同有关。利用TSPP可使大部分肌动球蛋白解离的性质,结合滚揉腌制可提高肌肉的嫩度。然而,TSPP处理后,仍有部分蛋白无法解离。当遭受氧化时,未解离的肌动球蛋白仍会形成大的蛋白聚集物,不利于肌肉嫩度的提高。此外,由于肉制品加工(例如滚揉按摩、斩拌)时肌肉蛋白不可避免的发生氧化,且氧化形成的蛋白聚集物对肌肉蛋白在脂肪表面的分布及蛋白凝胶网络结构的形成均有一定影响,故TSPP处理对肉制品品质(如质地、嫩度和多汁性等)的提高作用并不能达到最佳效果。因此,有必要进一步研究提高TSPP解离效果的方法及措施。
