腊肉拮抗菌分离及抗真菌脂肽特性分析
2021-05-19高兆建秦宸锴黄亮浩朱劲虎赵宜峰
高兆建,秦宸锴,黄亮浩,朱 双,朱劲虎,赵宜峰
(1.徐州工程学院食品与生物工程学院,江苏 徐州 221018;2.长江桂柳食品睢宁有限公司,江苏 徐州 221000)
随着全球对食品安全的日益重视,食品防腐剂作为一种食品工业中重要的添加剂逐渐得到广泛关注。为防止食品腐败变质延长货架期,向加工食品中添加防腐剂是最常用的方法。食品防腐剂按来源分为化学合成防腐剂和天然防腐剂,其中化学防腐剂如亚硝酸钠、苯甲酸钠、苯甲酸等使用最多。然而,化学防腐剂存在潜在危害。发掘并使用天然无毒的抗菌剂是目前研究的热点。近年来,抗菌脂肽作为一种天然抗菌物质,有望成为化学防腐剂的理想替代品。
芽孢杆菌属菌株是一类分布广泛并能在极端环境下生存的革兰氏阳性细菌[1],可以分泌多种抗菌活性的环状脂肽。它们通过非核糖体基因编码多酶复合催化合成,包括表面活性素[2]、伊枯草菌素(Iturin)[3]、芬芥素[4]和库斯塔克素[5]4 大类。其中伊枯草菌素家族成员包括伊枯草菌素A、B、C、D、E,芽孢菌素D、F、L以及抗霉枯草菌素等,它们都是由7 个氨基酸残基组成的一个肽环和连接一个C14~C17的β-氨基脂肪酸组成,其主要通过离子空隙进行渗透干扰。抑菌方面,对病原真菌的作用较强,对病原细菌及病毒的作用强度较弱[6]。抗菌脂肽具有抗细菌、抗真菌、抗肿瘤、抗病毒、抗支原体[7-8]等功能,并且抗菌谱广、安全无毒、不易产生耐药性、易被生物降解等特点,其在农业、食品、医药、化妆品、环保、畜牧业等领域备受关注[9]。目前,关于芽孢杆菌分泌的抗菌脂肽理论和应用研究主要集中在植物病害的防治方面[10],而有关抗菌脂肽用于食品防腐的报道较少,而且来源不同的菌株所分泌的抗菌脂肽也有较大差异[11]。
本实验从传统腊肉中分离产生广谱抗菌物质的芽孢杆菌。通过酸沉淀、硅胶柱层析和反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)等方法从发酵液分离纯化抗菌物质,进一步通过傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)、基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-offlight mass spectrometry,MALDI-TOF-MS)对分离得到的抗菌组分及成分进行分析鉴定,旨在为开发新型、安全、高效的食品防腐剂或抗菌药物提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与样品
用于检测抑菌活性的参考菌株部分购自中国普通微生物菌种保藏管理中心,部分由徐州工程学院江苏省重点建设实验室保存。
产脂肽菌株分离自江苏省徐州传统农家自制腊肉样品。取回的样品临时4 ℃冰箱保存后及时处理。
1.1.2 试剂
聚合酶链式反应(polymerase chain reaction,PCR)试剂盒 日本TaKaRa公司;PCR引物 南京金斯瑞生物技术有限公司;蛋白酶K、胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶 上海源叶生物科技有限公司;标准品Iturin A美国Sigma公司。
1.1.3 培养基
菌株初筛培养基:营养肉汤琼脂(nutrient broth medium,NB)培养基;抗菌谱检测培养基:NB培养基、马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA);种子培养基及发酵培养基:葡萄糖15 g/L,蛋白胨15 g/L,酵母粉10 g/L,NaCl 5 g/L,NH4NO32 g/L,KH2PO41 g/L,MgSO4·7H2O 0.5 g/L,pH 7.2~7.5。以上培养基均经过121 ℃灭菌15 min。
1.2 仪器与设备
3k15型冷冻离心机 德国Sigma公司;GeneAmp 9700型PCR仪 美国应用生物系统公司;JS-680D型凝胶成像系统 上海培清科技有限公司;1260半制备HPLC仪、Zorbax SB-C18(4.6 mm×250 mm,5 μm)HPLC半制备柱 美国安捷伦公司;Qexactive Orbitrap型高分辨质谱仪 美国Thermo Fisher公司;CascadaTMAN型超纯水系统 美国PALL公司;UV-2450紫外-可见光分光光度计 日本岛津公司。
1.3 方法
1.3.1 产脂肽菌株的分离筛选与抑菌活性测定
采用抑菌圈法初筛产生抗菌物质的细菌菌株,以金黄色葡萄球菌为指示菌株。产生抑菌圈的菌株进一步以大肠杆菌、金黄色葡萄球菌及黑曲霉为指示菌株进一步初筛。对以上3 种指示菌均有抑制作用的菌株挑选出液态发酵复筛。按照8%的接种量接种种子液至发酵培养基,37 ℃条件下180 r/min振荡培养60 h。发酵液4 ℃、10 000 r/min离心10 min,获得发酵上清液,用0.22 μm滤膜过滤除菌,得到除菌后的发酵上清液。
通过琼脂孔扩散法[12]测定抑菌活性,制备对应不同指示菌的琼脂培养基平板,将活化好的各指示菌活菌数(霉菌为孢子)调整到2.0×106CFU/mL并在平板上涂布150 μL,表面晾干后在培养基上打孔。将100 μL过滤除菌后的发酵液上清注入到不同指示菌对应的培养基平板孔中,指示菌在最适作用温度下培养1~5 d,检查平板抑菌圈情况,测定抑菌圈直径大小,并以直径大小表示抗菌活性高低。
1.3.2 拮抗菌株分类鉴定
形态学观察:复筛获得的优质菌株在NB固态培养基上37 ℃培养48 h,观察菌落形态并革兰氏染色,在光学显微镜下观察菌体形状、排列方式等形态特征。
16S rDNA的扩增与序列分析:提取分离菌株总DNA,16S rDNA序列PCR扩增。扩增引物[12]如下:上游引物(5′-AGAGTTTGATCCTGGCTCAG-3′),下游引物(5′-ACGGCTACCTTGTTACGACTT-3′)。PCR扩增条件:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,30 次循环;最后72 ℃延伸7 min。扩增序列测序结果运用BLAST软件进行序列比对,选择相似度较高的菌株序列,用ClustalX1.83与MEGA5.1软件,采用Neighbor-joining法构建系统发育树[13]。
1.3.3 菌体生长动力学及脂肽合成
将活化过的分离筛选到的菌株按照1%(V/V)接种量接种到发酵液体培养基中,培养温度为37 ℃,培养72 h,每隔6 h取样测定其600 nm波长处吸光度及抑菌圈直径,以金黄色葡萄球菌为指示菌株[14]。
1.3.4 脂肽分离与鉴定
1.3.4.1 脂肽酸沉淀分离
盐酸沉淀法提取抗菌活性物质[15]。发酵60 h后的发酵液10 000 r/min离心10 min,收集上清液,用0.22 μm滤膜过滤除菌。用6 mol/L盐酸调pH值至2.0,4 ℃静置过夜后10 000 r/min、4 ℃离心15 min。沉淀部分甲醇抽提5 次,合并抽提液,冻干后用0.02 mol/L pH 7.0磷酸盐缓冲液溶解,得脂肽粗提物。
1.3.4.2 脂肽硅胶柱纯化
粗提物用硅胶柱层析分段分离[16],色谱柱为77 mm×93 mm硅胶柱,上样后依次用二氯甲烷-甲醇体积比100∶0、90∶10、80∶20、70∶30、50∶50、40∶60、30∶70、20∶80和0∶100梯度洗脱,每个梯度冲3~4 个柱体积。减压快速洗脱后,收集各洗脱液于40~45 ℃减压旋蒸去除溶剂,并对各组分抑菌活性检测。
1.3.4.3 RP-HPLC纯化
采用RP-HPLC分离经硅胶柱纯化的抗菌活性强的组分[17]。流动相A为含0.1%三氟乙酸水溶液,流动相B为含0.1%三氟乙酸-乙腈溶液;流速为1 mL/min。上样前用流动相A平衡3 个柱体积,上样,再用流动相B线性梯度洗脱,45 min内从0%增加到90%,214 nm波长吸光度检测,柱温25 ℃。收集抗菌活性峰,合并后冻干备用。
1.3.5 FTIR扫描
把经过纯化的脂肽用KBr压片法测红外吸收光谱[15]。光谱范围4 000~350 cm-1;分辨率4 cm-1,扫描累加次数16 次。
1.3.6 脂肽质谱分析鉴定
采用MALDI-TOF-MS对纯化的活性组分进行脂肽类型初步确定[18]。应用MALDI-TOF-MS技术及Data Explorer软件准确分析其分子质量。分析条件为:基质DHB,激光束强度5 500,电压1 560 kV,检测范围700~1 600 Da。
1.3.7 脂肽抑菌稳定性测定
脂肽酸碱稳定性[19]:部分纯化的脂肽用HCl和NaOH分别调节其pH值为2、4、6、8、10和12,以蒸馏水为对照,于37 ℃作用12 h,然后将pH值调至7.0,金黄色葡萄球菌为指示菌,采用琼脂扩散法测试不同pH值下抗菌脂肽的抑菌活性。
脂肽热稳定性[19]:部分纯化的脂肽溶液分别在25、40、60、80、100 ℃处理30 min,121 ℃处理20 min,以金黄色葡萄球菌为指示菌,采用琼脂孔扩散法测试处理后的脂肽残留抗菌活性。
蛋白酶敏感性[19]:部分纯化的脂肽溶液分别添加终质量浓度为1 mg/mL的胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、蛋白酶K和木瓜蛋白酶,缓冲溶液调节各酶反应体系至各酶最适作用pH值,于37 ℃孵育2 h,然后80 ℃处理15 min灭活各酶活性。琼脂孔扩散法测定对金黄色葡萄球菌的抗菌活性。以去离子水代替蛋白酶作为空白对照。
1.4 数据统计与分析
2 结果与分析
2.1 产脂肽菌株分离筛选与鉴定
传统腊肉切碎后,经生理盐水浸泡,富集培养后,梯度稀释涂布于初筛平板上,共分离得到具有抗菌活性的菌株12 株。通过菌落形态和细胞形态分析,初步确定从培养基上分离到的微生物主要是细菌、酵母菌和放线菌。琼脂孔扩散法检测初步筛选出的菌株发酵液对不同细菌和真菌的抑菌效果,其中一株细菌XLP27对多种指示菌有广谱抑菌活性,结果如图1所示,其发酵液对革兰氏阳性菌(金黄色葡萄球菌、蜡状芽孢杆菌)、革兰氏阴性菌(大肠杆菌)及酵母菌(酿酒酵母)均有显著抑菌活性,检测平板上显示清晰透明的抑菌圈。霉菌检测显示,对米曲霉、尖孢镰刀菌、黑曲霉及短密青霉亦有明显抑制作用,靠近1号样品孔一侧菌丝生长受到明显抑制,而空白对照一侧菌丝生长完全无影响。表明菌株XLP27发酵液中抗菌物质对细菌和真菌均有显著抑制作用,故将其作为深入研究出发菌株。在牛肉膏蛋白胨培养基上37 ℃划线培养24 h,菌株菌落呈圆形,表面光滑湿润,乳白色,不透明,边缘整齐,质地中等。革兰氏染色镜检,菌体杆状呈紫红色,为革兰氏阳性菌。菌株XLP27生理生化实验的结果见表1。根据形态学及生理生化特性比较,参考文献[21],菌株初步鉴定为短小芽孢杆菌(Bacillus pumilus)。
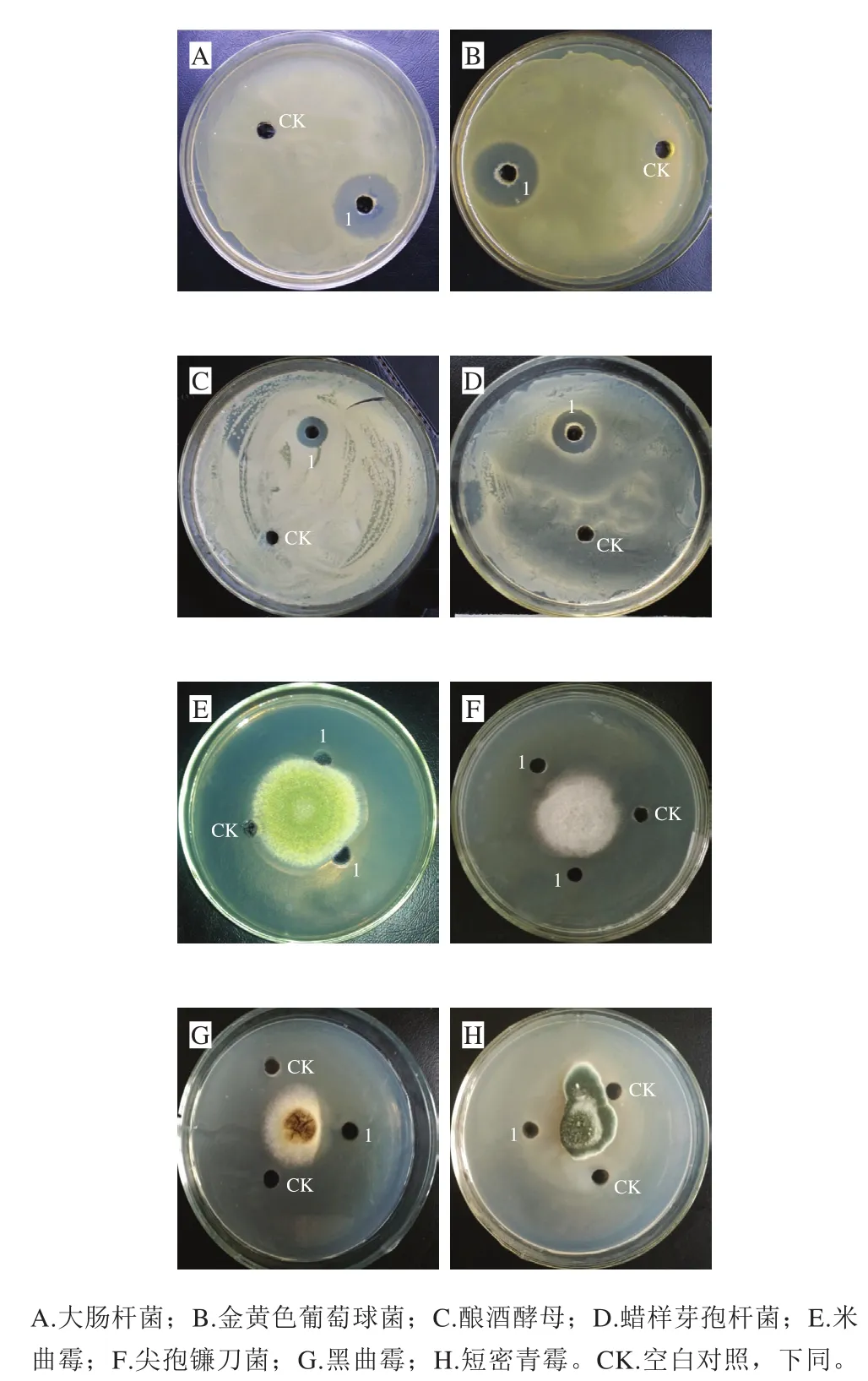
图1 菌株XLP27无菌发酵液的抑菌作用Fig. 1 Antifungal and antibacterial activities of lipopeptide from strain XLP27

表1 菌株XLP27形态及生理生化特征Table 1 Morphological and biochemical characteristics of strain XLP27
将菌株XLP27的16S rDNA序列进行BLAST比对分析发现与GenBank数据库中公布的B. pumilus不同菌株16S rDNA序列的相似度高达99%,系统进化树分析结果见图2,分离菌株XLP27与短小芽孢杆菌(登录号:NR074977.1)亲缘关系最近,结合菌株XLP27的形态学特征和生理生化特性,可再次确定菌株XLP27为B. pumilus。芽孢杆菌属菌株因其可产生广泛的有益代谢产物如抗菌物质和酶,如淀粉酶、蛋白酶、纤维素酶和脂肪酶,如今已经成为发酵工业领域最为常用的菌株之一,特别是已经证明芽孢杆菌属[22]中的很多不同种株可以产生对食源性腐败菌及致病菌等细菌和真菌有抑制作用的抗菌物质,如B. amyloliquefaciensPPCB004[23]和B. velenzensisS3-1[24]可产生伊枯菌素;B. licheniformisstrain P40[25]和B. subtilisSN7[26]可产生细菌素类抗菌物质;B.amyloliquefaciensfiply 3A[27]可产生抗癌细胞的脂肽类杆菌霉素D。目前为止,以往B. pumilus脂肽文献的报道主要涉及脂肽的表面活性功能,而对其抗菌特性并未见细致研究,如Fooladi等[28]分离了一株来自伊朗油田的B. pumilus2IR菌株,并对该菌株产生的表面活性特性脂肽做了发酵条件优化和表面活性特性研究;Slivinski等[29]报道了B. pumilusUFPEDA 448固态发酵法生产表面活性素脂肽。本研究是首次从腊肉中分离到产脂肽的B. pumilus菌株。
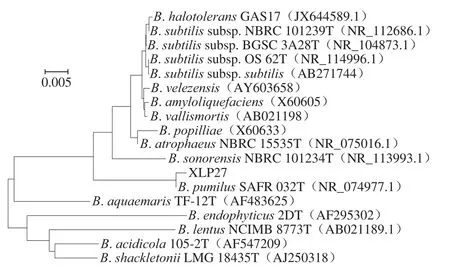
图2 基于16S rDNA序列构建的菌株XLP27的系统发育树Fig. 2 Phylogenetic tree of strain XLP27 based on 16S rDNA gene sequence
2.2 B. pumilus XLP27生长动力学及脂肽合成
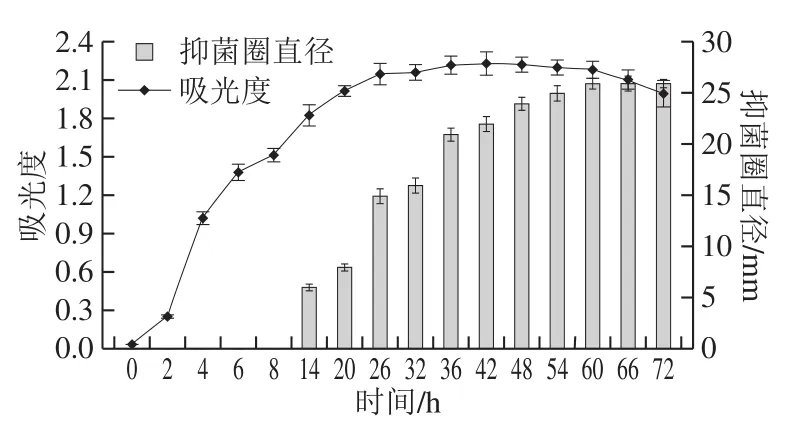
图3 B. pumilus XLP27生长动力学及脂肽合成Fig. 3 Growth kinetic curve of B. pumilus strain XLP27 and lipopeptide production as a function of culture time
如图3所示,0~2 h处于生长延迟期;2~8 h时,吸光度快速升高,处于对数生长期;8~26 h吸光度继续增加但是缓慢,处于对数生长期的后期;26~60 h吸光度基本恒定,菌体处于稳定期;60 h后吸光度出现下降趋势,表明菌体开始进入衰亡区。14 h开始出现抑菌圈,直径为6 mm,表明脂肽从对数期的后期开始合成;14~48 h内,抑菌圈直径不断变大,此时脂肽抗菌活性不断提高;60 h后抑菌圈直径大小基本不变,表明脂肽抗菌活性达到最大稳定值,且最大直径为26 mm。对照菌体浓度增长曲线,脂肽合成在指数期的末期开始,主要合成在稳定期,由此判断该菌株合成的抗菌脂肽属于次级代谢产物,且最佳培养时间为60 h。这与Fannei等[14]报道莫海威芽孢杆菌曲线基本一致,10 h即开始合成脂肽,20 h后产量不断增加;冯涛等[30]报道的纳豆芽孢杆菌生长曲线呈“S”形,在11 h开始合成脂肽,50 h后基本保持稳定;Lee等[19]报道的芽孢杆菌LM7稳定期开始合成脂肽,主要在发酵34~50 h合成,以后发酵产量基本恒定;黄翔峰等[31]研究发现不同的发酵条件也会引起合成脂肽时间变化。
2.3 B. pumilus XLP27脂肽纯化
菌株XLP27发酵液经酸沉淀和快速硅胶柱层析后得到5 个组分,分别对每个组分检测抗菌活性,显示一个组分对尖孢镰刀菌有显著抑制作用,该组分进一步通过RPHPLC分离,色谱层析如图4所示。在保留时间0~45 min内洗脱得到多个大的洗脱峰和很多小峰,说明HPLC柱效优良,分离效果显著,可将不同成分分开。洗脱40 min后,没有出现额外的峰,表明所有化合物都被从柱中洗脱出。对每个主洗脱峰检测抗菌活性,在出峰时间19.2 min的洗脱峰即P3峰具有明显的抑菌活性,靠近样品孔一侧的菌丝受到抑制不能延伸生长,而其他收集峰样品对菌丝生长无影响(图5)。将P3出峰保留时间同标准样品Ituri(19.76 min)对比,显示两者保留时间相接近,推测P3抗菌物质为Ituri类脂肽。RP-HPLC能够有效将杂质同脂肽分离,进一步说明前期脂肽酸沉淀、硅胶柱分段分离虽不能分离出单一成分的脂肽,但能去除影响RP-HPLC分离的大量杂质,为RP-HPLC发挥良好的分离效果奠定基础。国内外已报道了不同来源脂肽的分离纯化,Nanjundan等[12]通过微型切势流过滤、酸沉淀、RP-HPLC实现了表面活性素类脂肽的纯化;Arroyave-Toro等[32]通过树脂球吸附、C18固相萃取和RPHPLC纯化了对采收后果蔬致病真菌有抑制作用的脂肽;Lee等[19]用硫酸铵盐析和热处理方法对从韩国传统发酵豆中分离的Bacillussp. LM7脂肽进行纯化。与报道相比,本研究的脂肽纯化方法步骤简单、分离效果好,可作为脂肽纯化的借鉴。
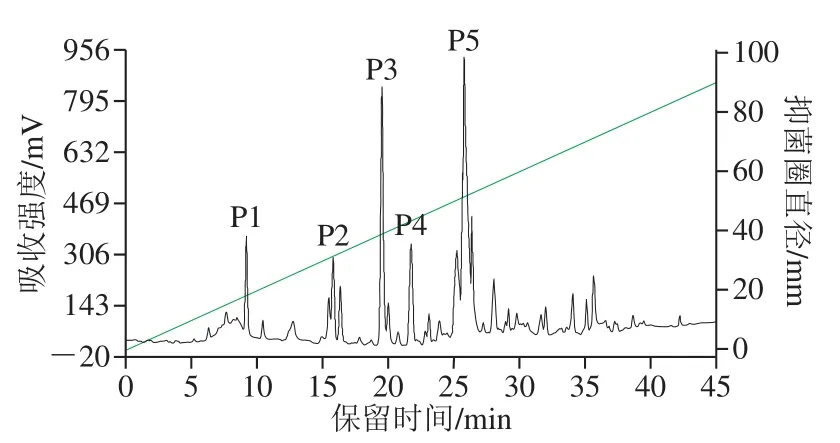
图4 B. pumilusXLP27脂肽RP-HPLC分离Fig. 4 RP-HPLC profile of antibiotics produced by B. pumilus XLP27 detected at 220 nm

图5 RP-HPLC分离各洗脱峰对尖孢镰刀菌抑菌作用Fig.5 Antifungal activity of elution peaks of lipopeptide from RP-HPLC against Fusarium oxysporum
2.4 纯化脂肽FTIR分析
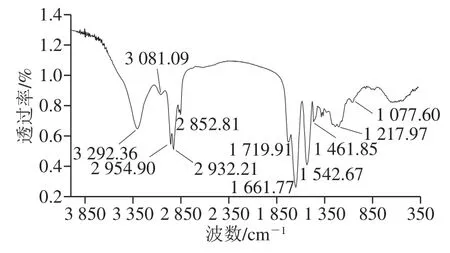
图6 B. pumilus XLP27脂肽FTIR分析Fig. 6 FTIR spectrum of lipopeptide from B. pumilus XLP27
经RP-HPLC纯化的样品FTIR分析结果见图6,3 292.36 cm-1是由分子间氢键引起的NH收缩振动谱带;3 081.09 cm-1是由NH基团的分子内部氢键引起的NH收缩振动谱带;1 661.77、1 542.67 cm-1分别为酰胺谱带I和II,上述的吸收特征表明,该表面活性剂分子的亲水基为一肽链。2 954.90~2 852.81 cm-1和1 461.85~1 719.91 cm-1的2 处吸收为脂肪族碳链的CH伸缩振动,1 719.91、1 217.97 cm-1为2 处内酯链的特征吸收,表明样品含有脂肪酸分子。综合以上特征,并参照文献报道的脂肽类抗菌物质FTIR数据[15,33],推测纯化的抗菌物质为环脂肽类。
2.5 抗菌脂肽MALDI-TOF-MS分析
经过RP-HPLC分离的活性组分MALDI-TOF-MS质谱分析,图7显示,有1 个m/z离子簇出现,该离子簇色谱峰包含5 个分子离子峰,其分子质量分别为1 046.182、1 060.213、1 074.198、1 088.201、1 102.175,推测由5 种不同脂肪酸链的同系物组成,并且分子质量依次相差14 Da,恰好与脂肪酸链长度C14~C18的Iturin A分子质量相对应,推测为Iturin A,这与文献报道的Iturin A质谱分析数据基本一致,Rodríguez-Chávez等[15]报道的B. subtilisQ11脂肽MALDI-TOF-MS检测到m/z分别为1 046.48、1 060.558、1 074.58和1 088.51四个离子峰,对应脂肪链长度为14、15、16、17 个—CH2—长度的Iturn A同系物;El Arbi等[34]研究的抗真菌脂肽混合物中Iturin MALDI-TOF-MS检测到m/z为1 106.7、1 122.7、1 134.8和1 150.8的4 个离子峰。
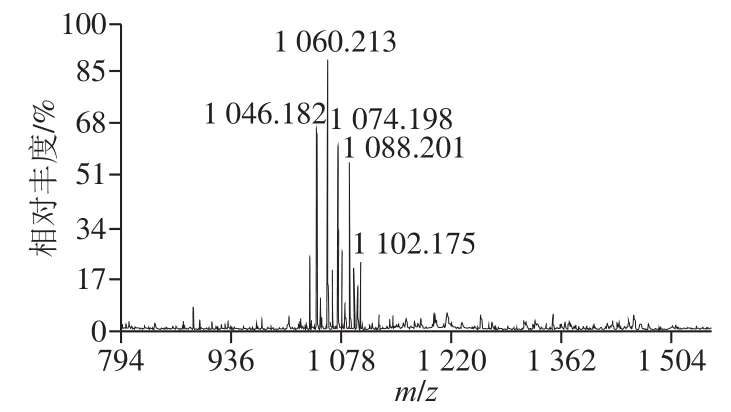
图7 B. pumilusXLP27脂肽类物质MALDI-TOF-MS分析Fig. 7 MALDI-TOF mass spectrum of lipopeptide from B. pumilus XLP27
2.6 B. pumilusXLP27脂肽抗菌谱
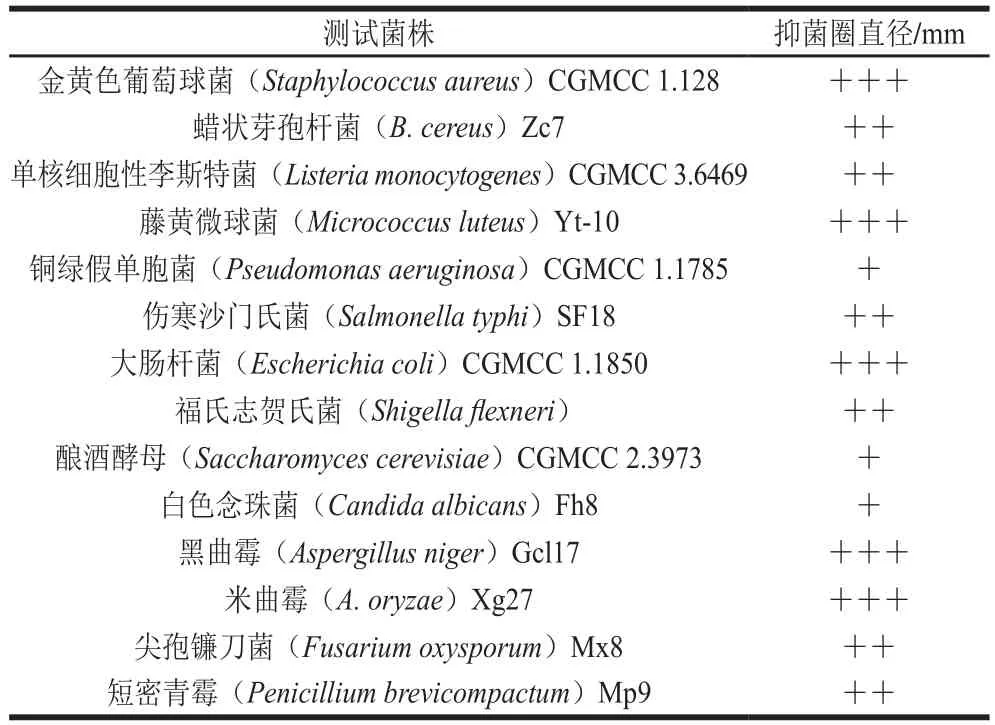
表2 B. pumilus XLP27脂肽对不同指示菌的拮抗作用Table 2 Antifungal and antibacterial activities of lipopeptide from B. pumilus strain XLP27
部分纯化的脂肽抑菌谱如表2所示,脂肽对革兰氏阳性菌如金黄色葡萄球菌、藤黄微球菌、蜡状芽孢杆菌、单核细胞性李斯特菌都有较强的抑菌活性;对革兰氏阴性菌大肠杆菌、福氏志贺氏菌、伤寒沙门氏菌也有较好的抑菌作用,对铜绿假单胞菌抑菌作用稍弱。脂肽对酵母菌如酿酒酵母和白色念珠菌有稍弱的抑菌活性,但对霉菌黑曲霉、米曲霉、尖孢镰刀菌和短密青霉抑菌作用较强。整体看出,脂肽有广谱抑菌活性,特备是对革兰氏阳性细菌和霉菌有强烈的抑菌作用。近年有很多芽孢杆菌脂肽的报道,但不同菌株脂肽特性往往不同,Cao Yun等[20]分离出的枯草杆菌SQR抗菌脂肽、Arroyave-Toro等[32]发现的B. subtilisEA-CB0015脂肽以及Nanjundan等[12]从湿地土壤中分离出的B. amyloliquefaciensSR1抗菌脂肽均对多种植物病源具有良好的抑制作用,但均未见其对细菌的抑菌报道;Zheng Dehong等[17]发现的B. thuringiensisBMB171除了能产生对致病菌有良好的抑制作用的脂肽外,还可以产生拮抗线虫的抗菌物质;Balan等[18]分离的Aneurinibacillus aneurinilyticusSBP-11对多种病源细菌有良好的抑菌作用,而未见对真菌的抑菌性能报道。本研究的B. pumilusXLP27脂肽不仅对细菌表现良好的抑菌特性,对所试的多种丝状真菌也有显著的抑菌效果。针对脂肽Iturin对真菌的抑菌作用机理,据研究,Iturin与真菌细胞膜的主要成分麦角甾醇相互作用,产生Iturin-磷脂或Iturin-磷脂-甾醇聚集复合物,从而使细胞膜的形状改变,导致在脂质双层膜中形成大的离子通道,使K+被释放出来[15]。脂肽对细菌的抑菌作用机理,研究认为脂肽锚定到细胞表面,导致细胞膜形成孔洞;由此电子传递链超活化、氧化磷酸化解偶联,致使形成大量超氧阴离子自由基,这些自由基使细胞膜中的脂类过氧化,由此增加了细胞膜的渗透性,导致胞内蛋白渗漏,最终细胞死亡[18]。接下来将通过扫描电镜观察细胞表面情况,探索脂肽对真菌和细菌的抑菌机理。
2.7 B. pumilus XLP27脂肽稳定性
热稳定性是评价脂肽能否应用生产的一个重要指标,在食品、饲料加工工艺中,都会涉及加热处理。如图8所示,脂肽经25~80 ℃处理后其抑菌活性基本无变化,稳定性保持在95%以上;在100 ℃下加热后,其抑菌活性也保持在80%左右;当在121 ℃条件下加热20 min(高温高压灭菌),抑菌活性显著降低,但没有完全丧失抑菌活性,扔具有43%的抑菌活力。整体说明脂肽热稳定性好。Lee等[19]报道的Bacillussp. LM7脂肽Anti-LM7也具有相似的耐高温特性。在食品工业中,使用单一的抗菌物质很难确保食品不会腐败变质,通常将单一的抗菌物质和其他类型的抗菌剂或者除菌技术如加热、辐射、脉冲电场等联合使用,以确保食品在保藏期内不会腐败变质[19]。本研究的脂肽高温耐受性好,能够承受食品加工工艺中的高温处理,故有潜力作为天然食品防腐剂在食品中使用。
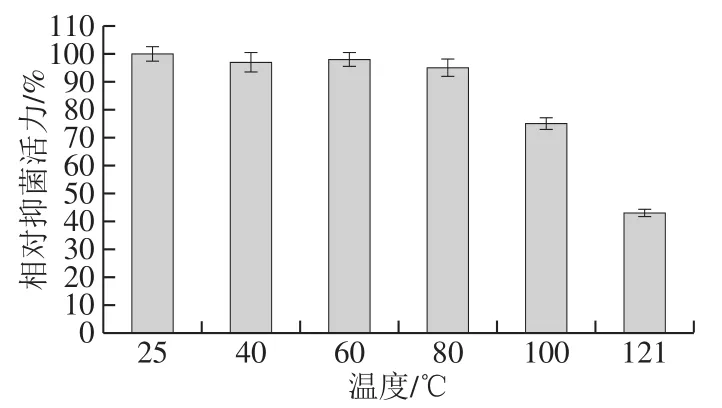
图8 温度对B. pumilus XLP27脂肽抑菌活性的影响Fig. 8 Effect of temperature on the antibacterial activity of lipopeptide from B. pumilus XLP27
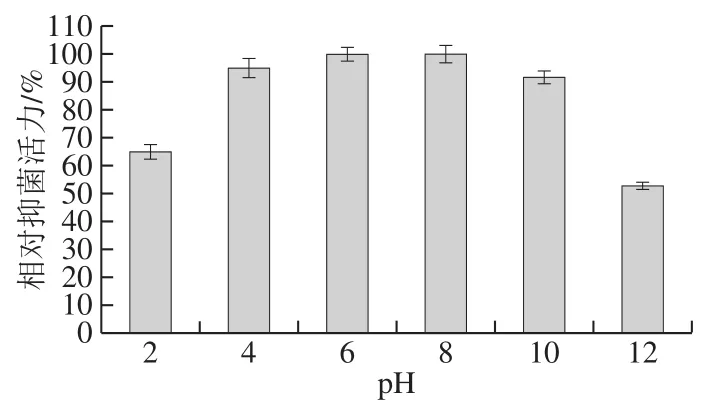
图9 pH值对B. pumilus XLP27脂肽抑菌活性的影响Fig. 9 Effect of pH on the antibacterial activity of lipopeptide from B. pumilus XLP27
由图9可知,在pH 4.0~10之间脂肽稳定性最佳,抑菌活性均保持90%以上,在pH 2.0及pH 12时其抑菌活性略低,但抑菌活性仍然保持65%及52%。由此看出,本研究脂肽在弱酸、弱碱及中性条件下均具有良好的稳定性,这与多黏类芽孢杆菌脂肽[35]稳定性相似,其在中性条件下比较稳定,强酸性和强碱性条件下不稳定;Lee等[19]报道的Bacillussp. LM7脂肽Anti-LM7在pH 4~9范围内稳定,pH 3.0或11.0时约损失50%的抑菌活性。国内外文献报道具有酸碱稳定性的抗菌脂肽大多为表面活素类脂肽,虽然也有良好的酸碱稳定性,但以脂肽表面延展性为指标,以抗菌性能为指标的鲜见报道。脂肽良好的酸碱稳定性使其可以在不同类型的食品中作为天然防腐剂广泛应用。
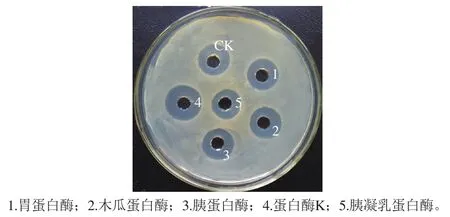
图10 不同蛋白酶对B. pumilus XLP27脂肽的作用Fig. 10 Resistance to different proteases of lipopeptide from B. pumilus XLP27
如图10所示,与空白对照相比,蛋白酶K、胃蛋白酶、胰蛋白酶和木瓜蛋白酶几乎对脂肽活性无任何影响,进一步证明本研究分离纯化到的抗菌物质为脂肽类,而不是容易受到蛋白酶降解而完全失活的细菌素类。胰凝乳蛋白酶有轻微的抑制作用,推测构成脂肽的环状多肽链中含有胰凝乳蛋白酶所识别的氨基酸基团。据研究,胰凝乳蛋白酶可以水解酪氨酸、色氨酸、苯丙氨酸和亮氨酸的羧基侧肽酰胺键,脂肽中可能存在这几种氨基酸中的一种或几种[19]。脂肽对蛋白酶的低敏感性与报道的多数脂肽一致[36],研究认为脂肽之所以对各种蛋白酶不敏感主要是因为在脂肽环状肽链中广泛存在非正常的氨基酸如D型氨基酸,由此导致脂肽对肽链内切蛋白酶有强的抵抗性[37]。由此说明本研究脂肽可以不受消化道中蛋白酶的影响而稳定存在,可以作为饲料添加剂使用。
3 结 论
从传统腊肉中分离筛选得到1 株产脂肽的B. pumilusXLP27。该菌株脂肽目前研究主要涉及表面活性剂特性,针对B. pumilus脂肽抗菌特性的研究鲜见报道。B. pumilusXLP27脂肽主要在稳定期合成。通过酸沉淀、硅胶柱层析及RP-HPLC纯化得到单一组分抗菌物质。FTIR及MALDI-TOF-MS鉴定抗菌物质为环状脂肽Iturin A。该脂肽具有广谱抗菌特性,对G+、G-细菌有良好的抑菌作用,对丝状真菌及酵母菌也显示优良的抑制特性。脂肽在100 ℃的高温及广泛的pH值范围内稳定性良好。鉴于以上特性,B. pumilusXLP27所产脂肽有潜力在植物病源真菌生物防治、饲料添加剂,特别是在新型天然食品防腐剂方面开发应用。
