桑叶生物碱对氧化应激小鼠糖脂代谢异常及肝损伤的改善作用
2021-05-19杨忠敏沈以红黄先智王祖文丁晓雯
杨忠敏,沈以红,黄先智,王祖文,丁晓雯,
(1.西南大学食品科学学院,重庆市农产品加工及贮藏重点实验室,食品科学与工程国家级实验教学示范中心,重庆 400716;2.西南大学科技处,重庆 400716)
长时间连续大量摄入D-半乳糖(D-galactose,D-Gal)会造成机体细胞内D-Gal大量堆积,D-Gal在半乳糖氧化酶的作用下生成醛糖和活性氧(reactive oxygen species,ROS)等,这些物质不能被细胞代谢,进而导致机体氧化应激-自由基损害[1]作用的发生。肝脏是D-Gal的主要代谢器官,也是机体最重要的解毒器官,大量D-Gal产生的有毒物质(如醛类)会直接损害肝细胞[2]。研究表明,氧化应激参与糖尿病的发生或发展,是糖尿病发生的重要环节[3]。氧化应激会损害胰岛β细胞,导致细胞内抗氧化酶水平降低,抗氧化能力下降,进而使得胰岛β细胞对ROS的敏感性增加[4]。过量的ROS不仅会直接促进胰岛β细胞凋亡,还可以作为信号分子参与调节胰岛素的分泌,从而间接抑制胰岛β细胞的功能[5-6]。胰岛β细胞受损使得胰岛素的分泌量降低,进而影响机体的糖代谢能力[7]。同时,氧化应激也会促进胰岛素抵抗的发生和进一步加剧脂代谢紊乱。脂代谢水平升高会增加耗氧量,进而产生大量ROS,过量的ROS又会导致脂肪、蛋白质等大分子变性,造成胰腺受损,进而反向影响脂代谢,发生脂代谢紊乱[8]。而糖尿病是以糖代谢紊乱为主的代谢性疾病,同时也会引发脂代谢异常,继而引发组织、器官以及消化系统病变[9]。因此,寻找能够改善机体氧化应激的物质,尤其是天然产物,对预防氧化应激导致的糖脂代谢异常和肝损伤的发生或发展具有重要意义。
桑叶是一种药食两用植物资源,味苦、甘,性寒,归肺、肝经,具有疏风清热、清肝明目等功效[10]。研究表明,桑叶中含有丰富的活性成分如黄酮、多糖和生物碱等,在抗高血压[11]、抗凝血[12]、降血糖[13]、降脂[14]、抗肿瘤转移[15]等方面有重要利用价值。桑叶生物碱所含的特殊羟基结构使其具有许多生理功能。王祖文等[16]研究表明,桑叶生物碱对四氯化碳联合高脂饮食诱导的小鼠肝损伤具有较好的改善作用;文晋等[17]初步证明了桑叶生物碱粗提液可以调节小鼠体内胆固醇代谢;王玲等[18]研究结果表明,桑叶生物碱的特征物质1-脱氧野尻霉素能较好改善肥胖小鼠脂代谢。此外,桑叶生物碱对机体血糖水平也具有较好的调控作用[19]。但桑叶生物碱对氧化应激伴随的糖脂代谢异常及肝损伤情况作用效果的研究鲜见报道。本课题前期研究结果表明,桑叶生物碱能较好地改善氧化应激小鼠机体DNA、脂质及蛋白质的氧化损伤,同时对氧化应激导致的肾脏损伤也具有明显的改善作用。因此,本研究采用D-Gal诱导小鼠建立氧化损伤模型,通过评价小鼠血糖、血脂水平及肝损伤指标的变化,探讨桑叶生物碱对氧化应激小鼠糖脂代谢异常与肝损伤的影响,旨在为开发桑叶生物碱相关保健食品提供理论依据,为氧化应激导致糖脂代谢紊乱及肝损伤的预防与治疗提供新方向。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性昆明种小鼠220 只(体质量18~20 g),4 周龄,购自重庆医科大学实验动物中心(生产许可证号:SCXK(渝)20180003;使用许可证号:SYXK(渝)2018 0003)。基础饲料购于重庆医科大学实验动物中心。
干燥桑叶粉由重庆市蚕业科学技术研究院提供;桑叶生物碱为实验室自制,采用硅钨酸法测定得到干燥桑叶粉样品中总生物碱质量分数为93.57%。
D-Gal(纯度≥99%)、还原型谷胱甘肽(glutathione,GSH)(纯度≥98%) 上海阿拉丁生化科技有限公司;总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)等检测试剂盒 南京建成生物工程研究所有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Symergy H1酶标仪 基因有限公司;RE52CS-1旋转蒸发仪 上海亚荣生化仪器厂;811DK高速冷冻离心机 德国Eppendorf AG公司;KQ5200DB超声波清洗仪 昆山市超声仪器有限公司;DW-HL438超低温冰箱 合肥美菱股份有限公司;XW-80A微型漩涡混合仪 上海精科实业有限公司;EG1105H型石蜡切片机德国Leica公司;包埋盒 江苏世泰实验器材有限公司;生物显微镜 日本Olympus株式会社;ONE TOUCHTMBasicTMPlus血糖监测仪 美国理康公司。
1.3 方法
1.3.1 动物饲养、造模及分组
小鼠按照西南大学实验动物保护和使用规则饲养,室温((23±2)℃)、相对湿度40%~60%,整个实验期间室内通风条件良好,12 h明暗交替(9∶00—21∶00),所有小鼠均饲喂基础饲料,自由觅食、饮水。
220 只雄性SPF级昆明种小鼠,饲养7 d适应环境后,随机选择40 只小鼠为正常对照组,腹腔注射与造模试剂等体积的生理盐水;其余180 只小鼠腹腔注射D-Gal(1 000 mg/kgmb),连续注射20 d后,颌下采血,测定造模组、正常对照组小鼠血清中丙二醛浓度、超氧化物歧化酶活力是否存在显著差异,若存在,则判定小鼠造模成功[19],用于后续实验。
保留正常对照组小鼠40 只。剔除造模未成功及造模过程中死亡的20 只小鼠,剩余造模成功的160 只小鼠,取10 只作为灌胃0 周实验小鼠,根据1.3.2节方法采样后用于相关指标测定;剩余150 只小鼠随机分为模型组(灌胃等体积生理盐水),阳性药物组(灌胃200 mg/kgmbGSH),桑叶生物碱低、中、高剂量组(分别灌胃50、100、200 mg/kgmb桑叶生物碱,灌胃剂量根据预实验结果确定),每组30 只。所有小鼠每天灌胃1 次,分别连续灌胃4、8、12 周。
1.3.2 样本采集
分别于灌胃第4、8、12周末,每次每组各取10 只小鼠,禁食不禁水16 h,眼球取血于含有肝素钠的真空采血管中,4 ℃、3 000 r/min离心15 min,收集上清液即为血浆,于-80 ℃保存备用。
1.3.3 血糖、血脂相关指标的测定
采用血糖监测仪测定小鼠空腹血糖浓度;按照试剂盒说明书操作步骤测定小鼠血浆TC、TG浓度及ALT、AST活力。
1.3.4 肝脏组织病理学观察
肝脏经体积分数10%福尔马林溶液固定48 h后,脱水,石蜡包埋,切片(厚度约为4 μm),苏木精-伊红染色,在光学显微镜下进行组织病理学观察。
1.4 数据统计分析
采用SPSS 20.0统计软件进行数据处理,每个样本平均测定3 次,结果以平均值±标准差表示,用单因素方差分析及多重比较进行显著性差异分析,P<0.05为差异显著,P<0.01为差异极显著。采用Origin 9.0软件作图。
2 结果与分析
2.1 桑叶生物碱对氧化应激小鼠空腹血糖水平的影响
机体的空腹血糖水平是糖尿病最常规的检查指标之一,可以反映胰岛β细胞功能,一般能表示基础的胰岛素分泌功能[20]。

表1 桑叶生物碱对氧化应激小鼠空腹血糖浓度的影响Table 1 Effect of mulberry leaf alkaloids on fast blood glucose in mice suffering from oxidative stressmmol/L
由表1可知,在实验周期内,正常对照组小鼠的空腹血糖浓度随灌胃时间的延长呈缓慢升高趋势,但变化不明显,基本保持稳定;灌胃0、4、8、12 周后,模型组小鼠空腹血糖浓度较相同灌胃时间的正常对照组小鼠分别增加了30.27%、29.48%、31.01%、24.96%(P<0.05),提示氧化应激小鼠机体空腹血糖浓度升高,糖代谢发生紊乱。随着桑叶生物碱灌胃剂量的增加,桑叶生物碱各剂量组小鼠空腹血糖浓度呈现逐渐降低的趋势。灌胃4、8、12 周后,相同灌胃时间下,与模型组小鼠相比,阳性药物组小鼠的空腹血糖浓度分别降低了21.73%、17.59%、20.58%(P<0.05),桑叶生物碱高剂量(200 mg/kgmb)组小鼠的空腹血糖浓度分别降低了24.58%、22.03%、17.92%(P<0.05)。桑叶生物碱中、高剂量组和阳性药物组小鼠的空腹血糖浓度接近,并且均与正常对照组小鼠空腹血糖浓度无显著差异(P>0.05),表明100 mg/kgmb剂量以上桑叶生物碱的降糖作用与实验剂量GSH作用效果相当,能够使氧化应激小鼠的空腹血糖浓度恢复到正常水平,其作用效果呈现较明显的剂量依赖效应,但无明显的时间依赖效应。
2.2 桑叶生物碱对氧化应激小鼠血脂水平的影响
血脂是血浆中中性脂肪的总称,是生命基础代谢的必需物质,TG、TC为血脂主要成分。由表2可知,在实验周期内,正常对照组小鼠的血浆TC浓度随灌胃时间的延长呈现逐渐增加的趋势,但变化不明显;与正常组对照组相比,灌胃0、4、8、12 周后,模型组小鼠的血浆TC浓度分别增加了57.75%、75.88%、70.86%、71.41%,差异极显著(P<0.01),提示氧化应激小鼠机体出现血脂紊乱现象,表现为高血浆TC浓度。相同灌胃时间下,桑叶生物碱各剂量组小鼠的血浆TC浓度均随灌胃剂量的增加呈现逐渐降低的趋势。灌胃4、8、12 周后,相同灌胃时间下,与模型组小鼠相比,阳性药物组小鼠的血浆TC浓度分别降低了46.88%、42.68%、40.17%(P<0.01),桑叶生物碱高剂量(200 mg/kgmb)组小鼠血浆TC浓度分别降低了41.73%、39.77%、40.80%(P<0.01)。桑叶生物碱高剂量组小鼠血浆TC浓度与阳性药物组接近,且两组均与正常对照组无显著差异(P>0.05),说明200 mg/kgmb桑叶生物碱对血浆TC浓度的降低作用达到实验剂量GSH的水平,能够使氧化应激小鼠血浆TC浓度恢复到正常水平,作用效果呈现剂量依赖效应,但无明显的时间依赖效应。
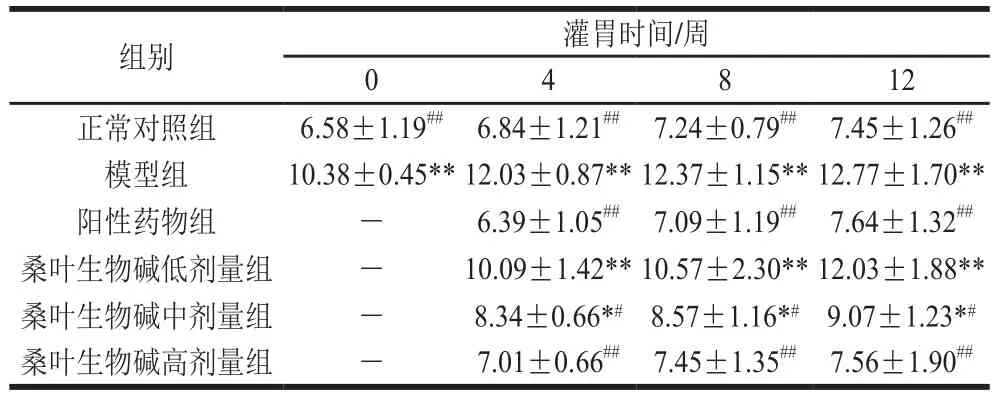
表2 桑叶生物碱对氧化应激小鼠血浆TC浓度的影响Table 2 Effect of mulberry leaf alkaloids on plasma TC in mice suffering from oxidative stressmmol/L

表3 桑叶生物碱对氧化应激小鼠血浆TG浓度的影响Table 3 Effect of mulberry leaf alkaloids on plasma TG in mice suffering from oxidative stressmmol/L
由表3可知,在实验周期内,正常对照组小鼠血浆TG浓度基本保持稳定;与正常组对照组相比,灌胃0、4、8、12 周后,相同灌胃时间下,模型对照组小鼠血浆TG浓度分别增加了36.84%、35.00%、38.10%、31.82%(P<0.01),提示氧化应激小鼠机体出现血脂紊乱现象。相同灌胃时间下,桑叶生物碱各剂量组小鼠的血浆TG浓度均随灌胃剂量的增加呈现逐渐降低的趋势。灌胃4、8、12 周后,相同灌胃时间下,与模型组小鼠相比,阳性药物组小鼠的血浆TG浓度分别降低了22.22%、24.14%、24.14%(P<0.01),桑叶生物碱高剂量(200 mg/kgmb)组小鼠血浆TG浓度分别降低了22.22%、31.03%、24.14%(P<0.01)。桑叶生物碱中、高剂量小鼠血浆TG浓度与阳性药物组接近,且3 组均与正常对照组无显著差异(P>0.05),说明100 mg/kgmb以上桑叶生物碱对血浆TG浓度的降低作用达到实验剂量GSH的水平,能够使氧化应激小鼠血浆TG浓度恢复到正常水平,其作用效果呈现剂量依赖效应,但无时间依赖效应。
2.3 桑叶生物碱对氧化应激小鼠肝损伤的影响
ALT、AST活力是评价肝功能的重要指标,通过肝脏病理切片能更直观地判断肝脏受损情况[21]。为考察桑叶生物碱对氧化应激小鼠肝损伤的影响,测定小鼠血浆ALT、AST活力并进行肝组织切片病理学观察。

表4 桑叶生物碱对氧化应激小鼠血浆ALT活力的影响Table 4 Effect of mulberry leaf alkaloids on plasma ALT activity in mice suffering from oxidative stressIU/L
由表4可知,在实验周期内,正常对照组小鼠血浆ALT活力随灌胃时间的延长呈逐渐增加趋势,但变化不明显;与正常组对照组相比,灌胃0、4、8、12 周后,相同灌胃时间下,模型组小鼠的血浆ALT活力分别增加了58.48%、56.76%、84.97%、86.14%(P<0.01),提示氧化应激小鼠机体出现肝损伤现象。相同灌胃时间下,桑叶生物碱各剂量组小鼠的血浆ALT活力均随灌胃剂量的增加呈现逐渐降低的趋势。灌胃4、8、12 周后,在相同灌胃时间下,与模型组小鼠相比,阳性药物组小鼠的血浆ALT活力分别降低了35.96%、49.26%、43.51%(P<0.01),桑叶生物碱高剂量(200 mg/kgmb)组小鼠血浆ALT活力分别降低了32.27%、41.27%、41.97%(P<0.01)。桑叶生物碱中、高剂量组小鼠血浆ALT活力较为接近,但均高于阳性药物组和正常对照组,桑叶生物碱高剂量组小鼠血浆ALT活力与正常对照组无显著差异(P>0.05),说明100 mg/kgmb以上的桑叶生物碱能够使氧化应激小鼠的血浆ALT活力恢复到正常状态,且作用效果接近实验剂量的GSH水平,呈剂量依赖性,但无明显时间依赖效应。
由表5可知,在实验周期内,正常对照组小鼠血浆AST活力呈现逐渐增加趋势,但变化较小;与正常对照组相比,灌胃0、4、8、12 周后,相同灌胃时间下,模型组小鼠血浆AST活力分别增加了170.94%、183.12%、216.07%、208.48%(P<0.01),提示氧化应激小鼠机体出现肝损伤现象。相同灌胃时间下,桑叶生物碱各剂量组小鼠的血浆AST活力均随灌胃剂量的增加呈现逐渐降低的趋势。灌胃4、8、12 周后,在相同灌胃时间下,与模型组小鼠相比,阳性药物组小鼠血浆AST活力分别降低了62.91%、66.78%、65.99%(P<0.01),桑叶生物碱高剂量(200 mg/kgmb)组小鼠血浆AST活力分别降低了62.09%、65.92%、65.77%(P<0.01)。桑叶生物碱高剂量组小鼠血浆AST活力与阳性药物组接近,与正常对照组无显著差异(P>0.05),说明200 mg/ kgmb桑叶生物碱降低血浆AST活力的作用达到实验剂量GSH水平,并能够使氧化应激小鼠血浆AST活力恢复到正常水平,其作用效果呈剂量依赖性,但无明显时间依赖效应。
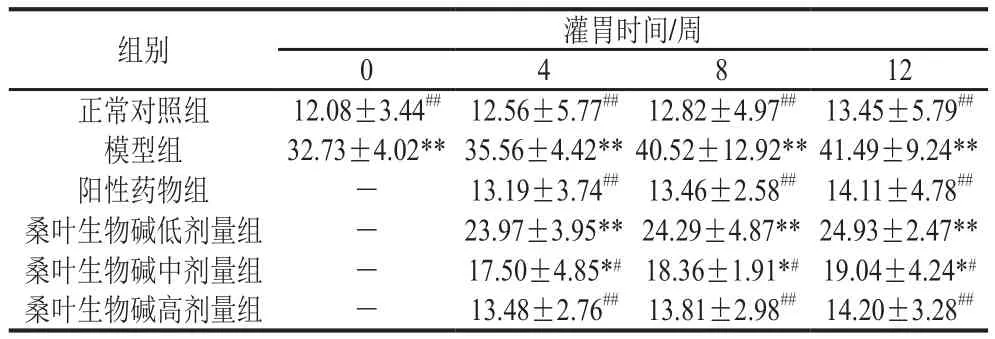
表5 桑叶生物碱对氧化应激小鼠血浆AST活力的影响Table 5 Effect of mulberry leaf alkaloids on plasma AST activity in mice suffering from oxidative stress IU/L
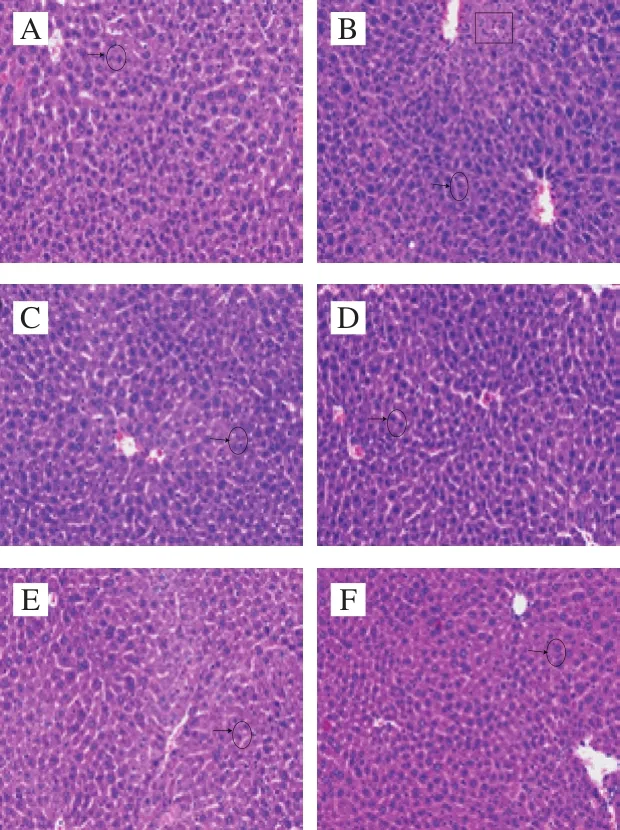
图1 不同组小鼠肝组织病理切片图(×200)Fig.1 Histopathological observation of liver tissue of mice in all groups (× 200)
由于桑叶生物碱能够显著降低ALT、AST活力,且无明显时间依赖效应,因此,选择实验灌胃周期结束(12 周)时进行小鼠肝脏病理学观察。由图1可知,正常对照组小鼠肝小叶结构规整,肝细胞呈多边形整体排列,细胞质丰富,清亮透明,细胞核大而圆;注射D-Gal后,与正常对照组相比,模型组小鼠肝小叶结构不规整,肝细胞存在点状坏死,细胞体积增大,细胞质可见明显疏松、肿胀;与模型组相比,阳性药物组和桑叶生物碱各剂量组小鼠肝损伤情况明显改善,且随着剂量的增大,肝损伤程度降低,桑叶生物碱高剂量组小鼠肝组织状态与阳性药物组和正常对照组类似。
3 讨 论
随着对桑叶活性成分的深入研究,发现桑叶中的重要活性成分生物碱类化合物对桑叶的药理作用具有关键作用。前期研究已证实桑叶生物碱对氧化应激造成的生物大分子氧化损伤具有较好的改善作用,但桑叶生物碱对氧化应激小鼠糖脂代谢、肝功能损伤的影响鲜有报道。本研究建立D-Gal诱导氧化应激小鼠模型,研究桑叶生物碱对氧化应激所致小鼠糖脂代谢与肝功能异常是否具有改善作用。
孙丰艳等[22]研究表明,随着年龄增长,机体中血糖、血脂(TG、TC)水平均呈现上升趋势。本研究中,随着喂饲时间的延长,正常对照组小鼠空腹血糖、TG、TC浓度及ALT、AST活力均增加。当机体发生氧化应激时,大量ROS导致糖脂代谢异常,血糖、血脂水平会有不同程度的升高[23-24]。本研究中模型组小鼠的测定结果也证实了此结论,并与Huang[25]、Do[26]等的研究结果一致。在本实验灌胃周期内,桑叶生物碱调节氧化应激小鼠血糖和血脂水平的作用不具有明显的时间依赖效应,其原因有待深入研究。提示可从抑制氧化应激的角度进一步探讨桑叶生物碱调节糖脂代谢异常的具体作用机理。
长期肝损伤通常会导致严重的肝脏病变以及不可逆的损伤,如肝纤维化、肝硬化,最终导致肝癌的发生[27]。研究证实,当肝细胞及肝细胞线粒体发生损伤时,ALT、AST会被释放进入血液,血液中ALT、AST水平显著升高,表明血液中ALT、AST水平与肝脏组织受损情况密切相关[28]。杨敏[29]的研究表明,正常组小鼠血浆ALT、AST活力呈基本稳定状态,随着桑叶生物碱粗提液灌胃剂量的增加和时间的延长,模型组小鼠血浆ALT、AST活力显著降低(P<0.05),且在实验剂量和周期范围内表现出显著的剂量依赖效应和时间依赖效应。本研究中,氧化应激导致小鼠肝脏发生损伤,血浆中ALT、AST活力极显著升高(P<0.01),随着桑叶生物碱灌胃剂量的增加和时间的延长,有效降低了模型组小鼠血浆ALT、AST活力,并且桑叶生物碱高剂量组小鼠的血浆ALT、AST活力恢复至正常水平,但在本实验剂量和周期范围内,仅表现出显著的剂量依赖效应,无明显时间依赖效应,这与杨敏[29]研究结果存在差异,原因有待进一步探讨。有研究表明,桑叶生物碱中的特征物质1-脱氧野尻霉素可通过促进血脂血糖的转运来改善小鼠肝损伤[30]。本研究结果表明,桑叶生物碱通过抑制氧化应激作用,从而调节糖脂代谢,改善肝损伤,但其具体作用的氧化应激信号转导通路尚不明确。
综上认为,桑叶生物碱可以改善氧化应激导致的糖脂代谢异常和肝损伤,其机制可能与抑制氧化应激的发生发展有关。该研究结果有助于为研究糖脂代谢异常的发生原因及改善糖脂代谢异常、保护肝功能提供新思路。
