不同提取方法对樱桃酒渣水溶性膳食纤维结构、理化与功能性质的影响
2021-05-19张启月张士凯郗良卿杜海云
张启月,张士凯,郗良卿,杜海云,吴 澎,
(1.山东农业大学食品科学与工程学院,山东 泰安 271018;2.泰安市食品药品检验检测研究院,山东 泰安 271000)
樱桃(Cerasusspp.)为樱属植物,主要包括樱桃亚属、酸樱桃亚属、桂樱亚属等。随着人民生活水平的提高,对樱桃的消费量也逐渐提升,致使其产量逐年上升,截至2016年,全球甜樱桃产量从2000年的190万 t增至232万 t[1]。樱桃除直接食用外,部分还可用于酿酒,在酿制过程中会产生大量副产物——樱桃酒渣,其主要由樱桃皮和内核组成,约占樱桃质量的20%[2],然而樱桃酒渣尚未得到大规模的价值化应用,这一方面对环境造成了一定的污染;另一方面对资源造成了一定的浪费。
膳食纤维由非淀粉多糖组成,它在小肠中既不被消化也不被吸收,但可以在大肠中完全或部分发酵[3]。根据溶解性质可将膳食纤维分为不溶性膳食纤维(insoluble dietary fiber,IDF)和水溶性膳食纤维(water-soluble dietary fiber,SDF)[4]。SDF主要包括寡糖、果胶、β-葡聚糖和半乳甘露聚糖[5],与IDF相比,SDF具有溶解性和黏度特性,更易形成凝胶[6],在保健及食品工业领域中存在巨大潜力。研究表明,SDF可增加饱腹感、降低消化率、维持血糖稳定,在预防肥胖、结肠癌及糖尿病等疾病中发挥着重要作用[7]。此外,SDF的溶解性、流动性、胶凝性及界面特性等功能性质赋予其较高使用价值[8],可作为食品胶凝剂、乳化剂等[9],或用于改善食品结构,提高食品品质[10]。植物中IDF比例很高,SDF比例却非常低,因此,寻求一种合适的SDF提取方法尤为重要。
SDF的提取方法有物理法、化学法、生物法及复合法。不同提取方法会造成SDF结构、理化及功能性质的差异,Gan Jiapan等[11]研究发现微波-氢氧化钠、微波-酶、微波-超声波提取的柚皮SDF结构疏松,具有更为丰富的单糖组成,较高的分子质量、结晶度及热稳定性;Niu Yuge等[12]研究发现,与原SDF相比,经碱性过氧化氢改性提取的番茄皮SDF分子质量和ζ电位最低,具有较强的Ca2+胶凝性与体外葡萄糖吸附能力,碱性过氧化氢与盐酸-乙醇改性提取的SDF胆汁酸结合力接近,高于酶法改性提取的SDF与原SDF。目前,关于樱桃酒渣SDF提取方法的研究鲜有报道。本实验采用酶法(纤维素酶)、酸法(柠檬酸)对樱桃酒渣SDF进行提取,比较两种提取方法下SDF表观结构、分子结构、单糖组成、流变学特性及吸附性、体外抗氧化性质的差异,探究不同提取方法对樱桃酒渣SDF结构、理化及功能性质的影响,为樱桃副产物的综合利用提供一定理论依据。
1 材料与方法
1.1 材料与试剂
红灯樱桃酒渣由山东泉灵酒庄提供,由果皮、果肉、籽及少量茎组成。
纤维素酶(10万 U/g) 宁夏和氏璧生物科技有限公司;木瓜蛋白酶(10万 U/g) 南宁庞博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、2,4,6-三吡啶基三嗪(2,4,6-tris(2-phyridyl)-s-triazine,TPTZ)、柠檬酸、氢氧化钠、盐酸、体积分数95%乙醇等试剂均为国产分析纯。
1.2 仪器与设备
TGL-20b R高速台式冷冻离心机 上海安亭科学仪器厂;扫描电子显微镜 德国ZEISS公司;VERTEX 70傅里叶变换红外光谱仪 德国Bruker公司;Ultimate 3000高效液相色谱仪 美国Agilent公司;DHR-1旋转流变仪 沃特世科技(上海)有限公司;UV-8000型紫外-可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1 原料处理
鲜樱桃酒渣在60 ℃烘箱内干燥24 h,粉碎,过60 目筛,贮存于干燥器待进一步分析。
1.3.2 樱桃酒渣SDF的制备
以料液比1∶20将樱桃酒渣粉加至去离子水中,调节pH值至5.4,添加7%(以樱桃酒渣粉质量计,下同)纤维素酶,55 ℃酶解1 h,煮沸5 min灭酶,冷却至室温后调节pH值至7,添加0.3%木瓜蛋白酶,55 ℃酶解30 min,煮沸5 min灭酶。离心取上清液,旋转蒸发浓缩后加入4 倍体积的体积分数95%乙醇溶液,4 ℃醇沉12 h。离心得沉淀,干燥,即得酶法制备的SDF,记为MSDF。
以料液比1∶60.8将樱桃酒渣粉加至5.2 g/100 mL的柠檬酸溶液中,73 ℃水解75 min,离心取上清液,旋转蒸发浓缩后加入4 倍体积的体积分数95%乙醇溶液,4 ℃醇沉12 h。离心得沉淀,干燥,即得酸法制备的SDF,记为SSDF。
1.3.3 扫描电子显微镜观察
样品放于双面胶带上并喷薄金层,以3.00 kV的加速电压于扫描电子显微镜观察台上收集图像,放大倍数为1 000。
1.3.4 傅里叶变换红外光谱分析
1 mg样品与150 mg KBr混合并充分研磨至均匀粉末,压片。于4 000~500 cm-1下扫描,扫描次数为64,分辨率为4 cm-1。
1.3.5 单糖组成分析
1.3.5.1 待测样品水解
精密称取10~20 mg样品至安瓿瓶中,加入2 mL 2 mol/L三氟乙酸,封管,110 ℃酸解8 h,挥干三氟乙酸,加2 mL去离子水复溶。
1.3.5.2 样品溶液衍生
精确吸取250 μL样品溶液到EP管中,加入250 μL 0.6 mol/L氢氧化钠溶液、500 μL 0.4 mol/L 1-苯基-3-甲基-5-吡唑啉酮-甲醇溶液,70 ℃反应1 h。冷水中冷却10 min,加入500 μL 0.3 mol/L盐酸溶液中和,再加入1 mL氯仿,漩涡振荡,3 000 r/min离心10 min,取上清液,氯仿萃取3 次。取上清液,即得衍生化样品溶液。
1.3.5.3 液相色谱条件
色谱柱:Xtimate C18柱(200 mm×4.6 mm,5 μm);柱温:30 ℃;流速:1 mL/min。
检测波长:250 nm;进样量:20 μL;流动相:0.05 mol/L磷酸二氢钾溶液(用0.05 mol/L氢氧化钠溶液调pH值至6.7)-乙腈(体积比83∶17)。
1.3.6 流变学特性测定
分别配制质量浓度为2、6、10 g/100 mL的样品溶液,于20 ℃、剪切速率1~100 s-1条件下使用流变仪测定不同质量浓度SDF的表观黏度。
1.3.7 吸附性分析
1.3.7.1 亚硝酸盐吸附量测定
亚硝酸盐吸附量测定参考Gan Jiapan等[11]的方法。0.1 g样品与5 mL 20 μg/mL亚硝酸盐溶液混合,分别调节pH值至2和7,室温放置2 h,4 800 r/min离心10 min。取0.4 mL上清液,定容至2 mL,加入2 mL 4 g/L对氨基苯磺酸和1 mL 2 g/L盐酸萘二酰胺溶液,黑暗中反应30 min,于538 nm波长处测定吸光度,并基于标准曲线进行定量。按式(1)计算亚硝酸盐吸附量。
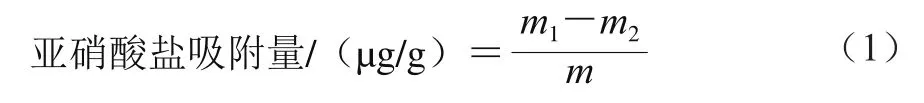
式中:m1和m2分别为吸附前后溶液中亚硝酸盐的质量/μg;m为SDF质量/g。
1.3.7.2 胆固醇吸附量测定
胆固醇吸附量测定参考Zhang Ning[13]和Park[14]等的方法并作适当修改。用去离子水以体积质量比10∶1稀释蛋黄,并搅打至完全乳化。取1 g样品与25 mL稀释的蛋黄溶液混合,分别调pH值至2和7,37 ℃连续振荡孵育2 h。取4 mL样品溶液,加入16 mL无水乙醇,4 000 r/min离心20 min,取上清液,浓缩并完全挥发乙醇,定容至25 mL,取0.4 mL溶液测定其胆固醇含量。具体检测方法为待测液加入4 mL 0.5 mg/mL的邻苯二甲酸并充分混合,加入2 mL浓硫酸漩涡混匀,20 min后在550 nm波长处测定吸光度,并基于标准曲线进行定量。按式(2)计算胆固醇吸附量。
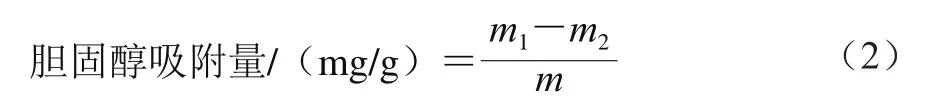
式中:m1和m2分别为吸附前后溶液中胆固醇的质量/mg;m为SDF质量/g。
1.3.8 体外抗氧化性分析
1.3.8.1 DPPH自由基清除能力测定
DPPH自由基清除能力参照Yan Xiaoguang等[15]的方法并作适当修改。用无水甲醇配制0.2 mmol/L的DPPH溶液,用去离子水将样品分别稀释为0.5、1、2、3、4、5 mg/mL,以VC溶液作为阳性对照。分别将2 mL样品溶液+2 mL DPPH溶液、2 mL样品溶液+2 mL无水甲醇、2 mL无水甲醇+2 mL DPPH溶液混合完成后,在室温下避光静置20 min,于517 nm波长处测定吸光度。按式(3)计算DPPH自由基清除率。
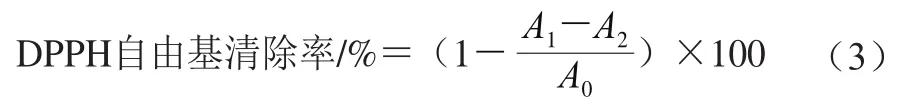
式中:A1为2 mL样品溶液+2 mL DPPH溶液吸光度;A2为2 mL样品溶液+2 mL无水甲醇吸光度;A0为2 mL无水甲醇+2 mL DPPH溶液吸光度。
1.3.8.2 ABTS阳离子自由基清除能力测定
ABTS阳离子自由基清除能力参照贾雨朦等[16]的方法并作适当修改。去离子水制备7.4 mmol/L的ABTS溶液,室温下与2.45 mmol/L过硫酸钾溶液混合,避光静置过夜。用无水甲醇稀释上述溶液直至在734 nm波长处吸光度为0.70±0.02,4 h内进行测定。用去离子水将样品分别稀释为1、2、3、4、5、6 mg/mL,以VC溶液作为阳性对照,取0.4 mL样品溶液与3.6 mL稀释的ABTS溶液混合,黑暗环境稳定20 min,734 nm波长处测定吸光度。按式(4)计算ABTS阳离子自由基清除率。
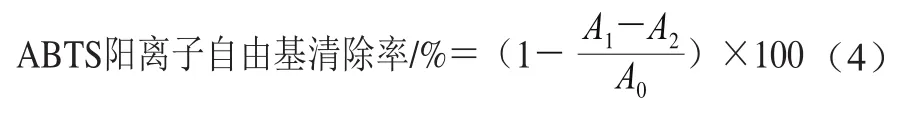
式中:A1为0.4 mL样品溶液+3.6 mL稀释的ABTS溶液吸光度;A2为0.4 mL样品溶液+3.6 mL无水甲醇吸光度;A0为0.4 mL无水甲醇+3.6 mL稀释的ABTS溶液吸光度。
1.3.8.3 羟自由基清除能力测定
羟自由基清除能力参照Cheng Li等[17]的方法。用去离子水将样品分别稀释为1、2、3、4、5、6 mg/mL,以VC溶液作为阳性对照,取1.0 mL待测样品溶液,加入试剂(0.5 mL 9 mmol/L硫酸亚铁溶液、5.0 mL体积分数0.5%过氧化氢溶液、0.5 mL 9 mmol/L水杨酸溶液),在37 ℃下水浴20 min,于510 nm波长处测定吸光度。按式(5)计算羟自由基清除率。
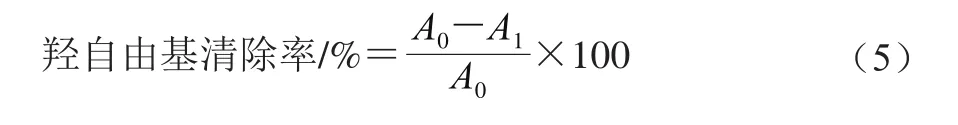
式中:A0为对照与试剂混合后在510 nm波长处的吸光度;A1为样品与试剂在510 nm波长处的吸光度。
1.3.8.4 总抗氧化能力测定
总抗氧化能力测定参照Benzie等[18]的方法并作适当修改。铁离子还原/抗氧化能力(ferric ion reducing antioxidant power,FRAP)测定溶液由乙酸钠-乙酸缓冲溶液(pH 3.6、300 mmol/L)、10 mmol/L TPTZ(40 mmol/L盐酸溶液溶解)和20 mmol/L氯化铁溶液以体积比10∶1∶1制备。用去离子水将样品分别稀释为1、2、3、4、5、6 mg/mL,取150 μL样品溶液加入4.5 mL FRAP测定溶液,37 ℃水浴10 min,于593 nm波长处测定吸光度。配制浓度范围0.2~0.8 mmol/L FeSO4标准液,绘制标准曲线,由标准曲线查得相同吸光度对应的FeSO4浓度,以此表征样品总抗氧化能力,单位为mmol/L。
1.4 数据统计与分析
所有实验均重复3 次,结果表示为平均值±标准偏差,使用SPSS 17.0统计软件进行差异显著分析,采用Duncan多范围检验方法,以P<0.05表示差异显著;使用Origin 9.0软件作图。
2 结果与分析
2.1 不同提取方法SDF扫描电子显微镜观察结果
由图1可知,MSDF表面疏松多孔,SSDF呈块状,表面光滑无孔洞。可能是纤维素酶破坏了MSDF的糖苷键及多糖链内与链间的氢键,从而暴露出更多活性基团,聚合度变小,使其结构变得疏松;SSDF可能具有较强的分子间相互作用,从而碎裂较少,呈现光滑表面。Wang Chaofan等[3]用纤维素酶对IDF进行改性,发现改性过的IDF结构不规则且松散;Yan Jingkun等[19]认为,柠檬酸提取的麦麸SDF表面光滑并有一些聚集体,存在不同形状和大小的线状结构,可能是柠檬酸使SDF表面部分解体造成的。Jia Mengyun等[20]认为经木霉发酵后的SDF具有疏松的空间结构,可能与持水力、持油力、水溶性和胆固醇吸附能力的提高有关。因此,表面疏松的MSDF理化性质可能更为优越。

图1 MSDF(A)、SSDF(B)扫描电子显微镜图Fig.1 SEM images of MSDF (A) and SSDF (B)
2.2 不同提取方法SDF傅里叶变换红外光谱分析结果
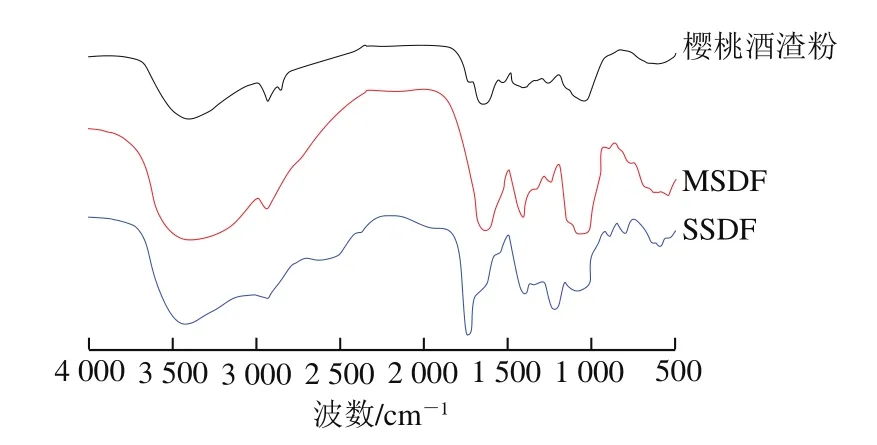
图2 樱桃酒渣粉、MSDF和SSDF的傅里叶变换红外光谱Fig.2 FTIR spectra of cherry wine dregs powder, enzyme-extracted SDF (MSDF) and acid-extracted SDF (SSDF)
由图2可知,两种SDF表现出典型碳水化合物结构。3 418 cm-1处的吸收峰是纤维素和半纤维素O—H伸缩振动产生的,主要来源于果胶(半乳糖醛酸)和半纤维素(木糖、甘露糖、半乳糖和阿拉伯糖),两种SDF较樱桃酒渣粉吸收峰强度增大,说明两种SDF处于缔合状态的氢键较多[21]。2 923 cm-1与2 850 cm-1处是多糖甲基和亚甲基C—H拉伸产生的两个弱吸收峰,是多糖化合物的典型结构峰,SDF峰强度的减小或消失说明提取造成了多糖甲基和亚甲基的部分降解。1 747 cm-1处是醛或酯中芳烃骨架及C=O的拉伸的吸收峰[22]。1 627 cm-1和1 405 cm-1附近的吸收峰代表酯羰基C=O和羧基COOH,说明存在多糖糖醛酸[23]。1 245 cm-1处是木质素和半纤维素中C—O甲氧基的振动吸收峰[24]。1 035 cm-1处是半纤维素中C—O、C—C和C—O—C的拉伸吸收峰,通常被报道存在于阿拉伯木聚糖和木聚糖中[25]。881、779 cm-1处分别是β-糖苷键、α-吡喃糖环的C—O—C的伸缩振动峰[14],两种SDF的吸收峰强度略微加强。580 cm-1处的吸收峰可能是β-C—H的混合振动所引起[26]。1 747、1 405、1 245 cm-1处通常认为是低甲基果胶的
吸收峰[27],SSDF的分子结构与Hosseini等[28]从酸樱桃果渣中提取的果胶结构相似,因此,两种SDF可能主要由果胶和半纤维素组成,但MSDF可能含有更多的半纤维素,SSDF含有更多的果胶。
2.3 不同提取方法SDF单糖组成分析结果

图3 MSDF液相色谱图Fig.3 Liquid chromatogram of MSDF
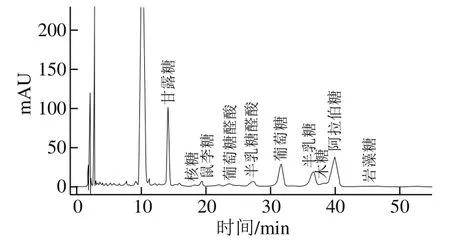
图4 SSDF液相色谱图Fig.4 Liquid chromatogram of SSDF
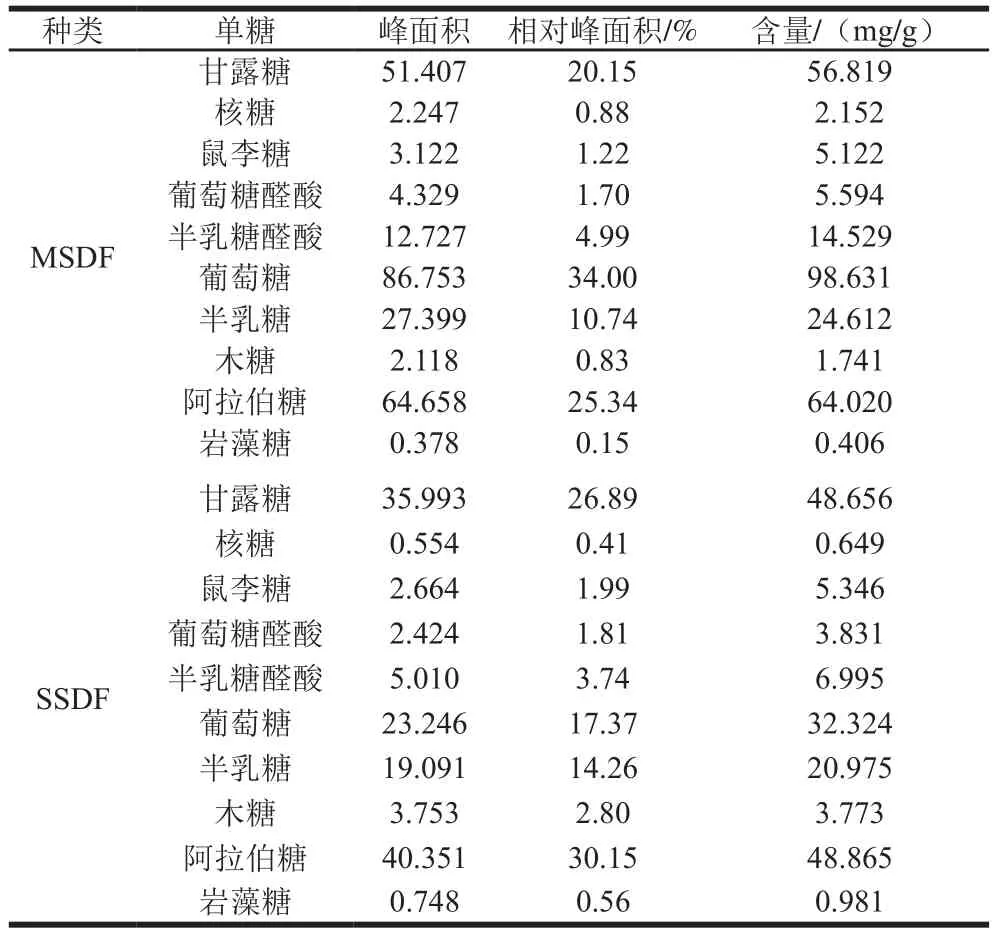
表1 两种SDF单糖含量Table 1 Monosaccharides contents of SDFs
由图3、4可知,两种SDF单糖种类未发生变化,主要的单糖依次为葡萄糖、阿拉伯糖、甘露糖、半乳糖、半乳糖醛酸、葡萄糖醛酸、鼠李糖等。由表1可知,MSDF中的葡萄糖(98.631 mg/g)、阿拉伯糖(64.020 mg/g)、甘露糖(56.819 mg/g)、半乳糖(24.612 mg/g)含量均高于SSDF,总单糖含量比SSDF增加58.7%,可能是因为纤维素是由葡萄糖通过β-1,4-糖苷键缩合而成的大分子,酒渣中的纤维素可被纤维素酶更为有效地水解成可溶性多糖,从而使单糖总量增加,这与曹龙奎等[29]通过超声-微波协同法对气爆预处理小米糠SDF改性的实验结果一致。
2.4 不同提取方法SDF流变学特性分析结果
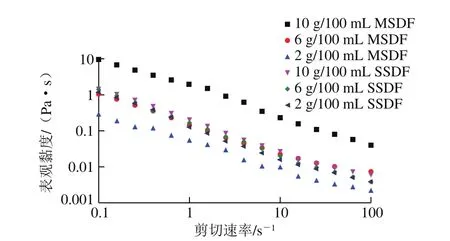
图5 不同提取方法及质量浓度SDF流变特性Fig.5 Rheological properties of SDFs at various concentrations
SDF可以在水中稳定分散,在肠道内与葡萄糖缠结形成具有一定黏度的胶体,可结合水分子、吸收矿物质阳离子,也可作为肠内微生物发酵的基质[30],SDF的功能性质很大程度上取决于其黏度。由图5可知,两种SDF为假塑性非牛顿流体,随着剪切速率的升高,各溶液的表观黏度逐渐降低,呈现剪切稀释现象,原因是随着剪切速率的升高,分子间相互作用力越来越小,结缠结构被破坏,导致黏度降低。SDF表观黏度随质量浓度升高而增大,与Feng Ziqian等[31]的实验结果一致,可能是因为高质量浓度SDF的分子链更容易发生强烈的分子间相互作用,形成更多的网络结构或聚集体[19]。此外,同等质量浓度下,不同提取方法的SDF流变特性不同,可能与分子质量、化学成分和结构、含水量、粒径有关。Cheng Li等[17]研究发现,经木聚糖酶处理的SDF表观黏度和稠度系数最高,剪切变稀效果最明显,与分子质量有关。因此,提取方法会影响SDF结构及理化组成,进而对SDF流变特性产生影响。
2.5 不同提取方法SDF吸附性分析结果
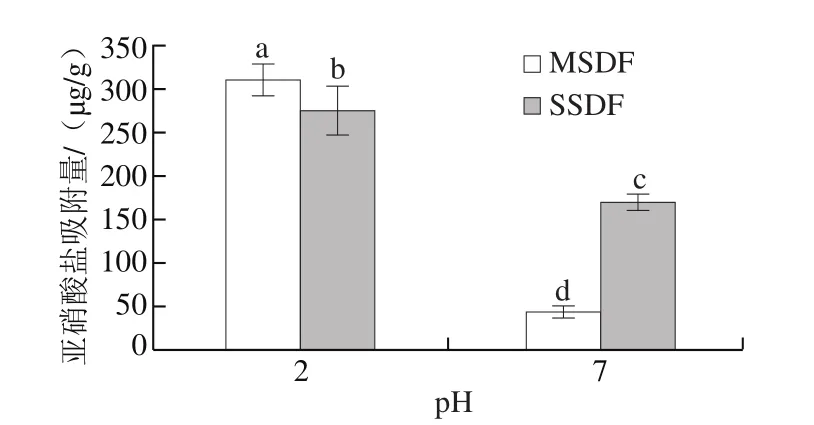
图6 不同提取方法SDF的亚硝酸盐吸附能力Fig.6 Nitrate adsorption capacity of SDFs
亚硝酸盐具有优异的防腐性,被广泛应用于食品加工中,但亚硝酸盐中的亚硝酸根离子易与血红蛋白结合形成高铁血红蛋白,引起蓝婴综合征;在胃酸环境中,亚硝酸盐与食物中的仲胺、叔胺和酰胺发生反应,形成强致癌物N-亚硝胺,容易引起食道癌和胃癌[32];因此,研究SDF对亚硝酸盐的吸附作用具有重要意义。图6表明两种SDF在胃环境中(pH 2)的吸附能力显著高于小肠环境(pH 7),这与Luo Xianliang等[33]对竹笋壳中所提取SDF进行的有关实验结果一致,可能与化学吸附机制有关。在酸性条件下,NO2-可与H+结合形成HNO2,HNO2之后可形成多种氮氧化合物,如强电子亲合性化合物N2O3,这些氮氧化合物可与膳食纤维酚酸基团中带负电荷的氧原子结合,从而被吸附[34];当pH值升高时,膳食纤维中的羧基被解离,使膳食纤维表面的负电荷密度增大,对NO2-的排斥力增强,从而降低吸附能力[35]。但在中性环境下,SSDF对亚硝酸盐的吸附能力高于MSDF,可能是在中性环境中,SSDF有更多的官能团可以与NO2-相互作用[10]。

图7 不同提取方法SDF的胆固醇吸附能力Fig.7 Cholesterol adsorption capacity of SDFs
胆固醇是人体细胞膜的重要组成部分,但机体胆固醇过高容易引起心肌梗塞、中风、动脉粥样硬化等心血管疾病[36],对机体胆固醇代谢进行平衡已成为当前研究热点之一。图7表明在酸性和中性环境中,MSDF的胆固醇吸附能力比SSDF分别提高了17.28%、27.26%,这可能是MSDF结构疏松,比表面积较大所致。Yan Ling等[37]证实,经高静水压处理过的梨渣结构变得疏松多孔,更易与水分子和胆固醇形成网络结构。pH值对SDF的胆固醇吸附能力影响很大,SDF在中性环境中的吸附能力高于酸性环境,与罗磊等[38]的实验结果一致。这可能是因为酸性环境存在较多H+,使MSDF、SSDF与胆固醇均带有部分正电荷,产生排斥力,减弱了SDF与胆固醇的结合力[39],从而降低吸附能力。
2.6 不同提取方法SDF体外抗氧化性分析结果

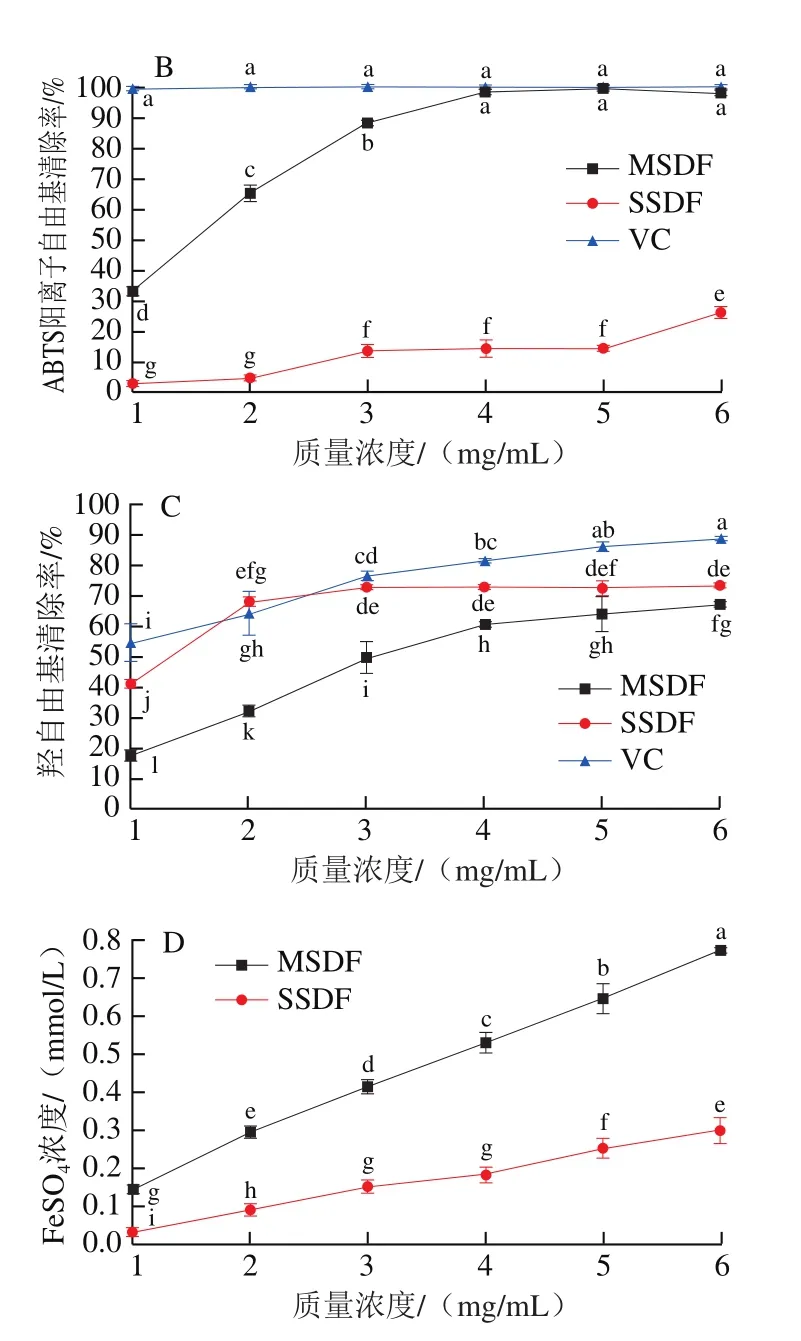
图8 两种SDF体外抗氧化能力Fig.8 Antioxidant capacity in vitro of SDFs
本实验通过测定DPPH自由基、ABTS阳离子自由基、羟自由基清除能力以及总抗氧化能力,比较两种SDF体外抗氧化活性差异。分析图8A、B可知,DPPH和ABTS阳离子自由基清除率从高到低依次为VC、MSDF和SSDF,其中VC在低质量浓度时已达到最高抑制率,当质量浓度最高时,MSDF和SSDF的DPPH自由基清除率最高,分别为90.08%、52.24%(P<0.05),ABTS阳离子自由基清除率最高分别为99.83%、26.26%(P<0.05),这可能是因为MSDF含有较多的还原糖和糖醛酸,同时结构疏松、空隙较大,更有利于其羟基提供电子和氢原子。Yan Jingkun等[19]认为SDF的抗氧化活性与碳水化合物中的还原糖、糖醛酸含量,分子质量以及结构有关。羟自由基清除能力实验结果表明,VC、MSDF、SSDF抗氧化能力呈质量浓度依赖性,质量浓度最高时,VC、MSDF、SSDF的羟自由基清除率分别为88.31%、66.67%、72.53%(图8C),SSDF羟自由基清除能力高于MSDF,可能与样品中氨基酸基团含量有关[40]。总抗氧化能力测定结果表明,当质量浓度最高时,MSDF与SSDF组所测吸光度对应的FeSO4浓度分别为0.77、0.30 mmol/L,MSDF的总抗氧化能力显著高于SSDF(图8D),可能与岩藻糖和半乳糖的含量有关。Su Yue等[23]证实4 种木耳多糖的岩藻糖和半乳糖含量会同时影响样品的总抗氧化能力,并且总抗氧化能力与岩藻糖含量显著负相关,与半乳糖含量负相关。
3 结 论
本实验对比了酶法与酸法所提取樱桃酒渣SDF的结构、理化及功能性质差异。结构方面,MSDF表面疏松多孔,SSDF光滑无孔洞;两种SDF表现出典型碳水化合物结构,MSDF与SSDF可能分别含有较多的半纤维素与果胶。理化性质方面,两种SDF单糖组成相同,主要由葡萄糖、阿拉伯糖、甘露糖、半乳糖等组成,MSDF单糖含量较SSDF提高58.7%;流变性分析结果表明两者均为假塑性非牛顿流体,表观黏度随质量浓度升高而增大,随剪切速率升高而减小。功能性质方面,两种SDF具有良好的吸附性,在酸性条件下对亚硝酸盐的吸附力较强,在中性环境下对胆固醇的吸附力较强,且MSDF的吸附力强于SSDF;体外抗氧化实验结果表明,MSDF具有较好的DPPH自由基清除能力、ABTS阳离子自由基清除能力、总抗氧化能力,但SSDF的羟自由基清除能力较强。综上,MSDF结构疏松,单糖含量更为丰富,吸附性、抗氧化能力较强,性质优于SSDF。所以,酶法降解可作为酿酒工业产业链废料的一种处理方法,在功能强化型食品及保健品开发等方面具有广阔前景。
