电针联合经颅磁刺激对脑缺血-再灌注损伤大鼠神经元的保护作用及机制*
2021-05-19雷鹏飞李卫春单爱军
雷鹏飞, 高 杉, 王 进, 李卫春, 汪 浩, 杜 飞, 单爱军△
深圳市人民医院 1麻醉科 3急诊科,深圳 5180202深圳大学总医院手术室,深圳 5180554郑州大学第二附属医院神经内科,郑州 450014
缺血性脑卒中作为神经内科常见的危重症,近年来发病率呈逐年升高趋势,是导致中老年人群死亡和残疾的重要原因[1]。研究表明,缺血性脑卒中血管再通后,会发生缺血-再灌注损伤而引发一系列级联反应,致使大量的神经元发生程序性死亡,是缺血脑卒中神经损伤的重要机制[2-3]。动物实验表明,电针联合经颅磁刺激作为目前应用于缺血性脑卒中治疗的有效方法,可有效减少缺血灶周围神经元的凋亡,保护神经功能[4]。但其作用机制尚未完全明确。PTEN作为一种具有磷酸酶活性的抑癌基因,其蛋白具有蛋白磷酸酶及脂质磷酸酶活性[5]。有研究指出,3,4,5-三磷酸脂酸肌醇(phosphatidylinositol-3 kinase,PIP3)是PTEN最常见的底物,PTEN可促使PIP3去磷酸化,负向调控磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,Akt)信号通路[6]。而PI3K/Akt信号通路与细胞代谢、生长及凋亡等过程密切相关[7]。本研究通过构建脑缺血/再灌注损伤大鼠模型,观察电针联合经颅磁刺激对脑缺血/再灌注损伤大鼠神经元凋亡的影响,探讨其与PTEN/PI3K/Akt信号通路的相关性,以期为电针联合经颅磁刺激治疗急性缺血性脑卒中的机制研究提供实验证据。
1 材料与方法
1.1 实验动物及分组
60只健康雄性SD大鼠,12周龄,体质量(280±20)g,购自上海斯莱克实验动物有限公司[动物合格证号:SCXK(沪)2012-0002],饲养于标准条件下,自由进食、饮水,适应性喂养7 d。采用随机数字表法将实验大鼠随机分为假手术组、模型组、电针组、磁刺激组和联合组,每组12只。
1.2 主要试剂和设备
3%戊巴比妥购自山东新华制药股份有限公司(批准文号:国药准字H37020350),TUNEL细胞凋亡试剂盒购自南京建成生物工程研究所,RIPA蛋白裂解液购自武汉博士德生物工程有限公司,BCA蛋白定量检测试剂盒购自上海研谨生物科技有限公司,兔抗大鼠PTEN单克隆抗体购自美国CST公司,兔抗大鼠Akt和磷酸化-Akt(p-Akt)多克隆抗体均购自美国Santa Cruz公司,兔抗大鼠哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)和p-mTOR多克隆抗体均购自美国Abcam公司,HRP标记二抗购自上海瑞齐生物科技有限公司,SDS-聚丙烯酰胺凝胶电泳试剂购自上海一基实业有限公司。G6805-Ⅰ型电针治疗仪购自常州英迪电子医疗器械有限公司,经颅磁刺激仪购自丹麦Dantec公司,凝胶电泳成像分析系统购自美国Bio-Rad公司。
1.3 构建动物模型
参照改良的线栓法[8]构建大鼠脑缺血-再灌注损伤模型:各组大鼠禁食不禁水10 h,腹腔注射麻醉,固定,取颈正中切口,对左侧颈总动脉、颈外动脉和颈内动脉进行钝性分离,将颈外动脉离断游离,将颈总动脉和颈内动脉用血管夹夹闭,用眼科剪在颈总动脉近分叉处剪一小口,将直径为0.26 mm的尼龙线栓插入并推至颈内动脉,继续推进至中动脉起始部,直到遇到阻力时停止。120 min后,将尼龙线栓取出,恢复血液灌流。假手术组大鼠仅分离血管而不将尼龙线栓插入。术后缝合切口,给予20万U青霉素肌注以防感染。模型构建过程中各组大鼠均未出现死亡。待各组大鼠清醒后,按照Longa评分标准[9]对大鼠神经功能进行评分:0分,活动自主,无神经功能缺损;1分,右侧肢体伸展不完全;2分,向右侧追尾转圈;3分,向右侧倾倒;4分,意识不清,不能行走。将1~3分的大鼠纳入后续实验,并对剔除的大鼠进行补充,维持各组数量不变。
1.4 干预方法
参照文献[4]的方法进行干预。成功建模24 h后,电针组大鼠进行电针治疗,按照《实验针灸学》对大鼠百会穴和大椎穴进行定位,用28号针分别刺入穴位,深度分别约为10 mm和5 mm,连通电针治疗仪,参数设置:电压2~4 V,电流2 mA,密波30 Hz,疏波2 Hz。电针治疗30 min/次,1次/d,连续2周。磁刺激组接受经颅磁刺激,将大鼠头部固定,磁刺激线圈紧贴着头皮,并与大鼠右大脑半球相切,参数设置:磁场峰值强度1.44 T,频率0.5 Hz。60个磁脉冲/次,1次/d,连续2周。联合组则在电针治疗的基础上,接受经颅磁刺激,方法同上。假手术组、模型组大鼠在相同时间给予头部固定但不行电针及经颅磁刺激。
1.5 大鼠神经功能评分
分别于成功建模24 h和16 d时,按照Longa评分标准[9]对各组大鼠神经功能进行评分,得分越高表示神经功能损伤越严重。
1.6 TUNEL法检测大鼠缺血区组织中神经元凋亡指数
各组在末次神经功能评分后,随机取6只,麻醉处死,取脑,4%多聚甲醛固定,脱水、透明、石蜡包埋,按5 μm厚度连续切片,脱蜡至水,浸入3%过氧化氢液10 min,滴加蛋白酶K,室温孵育20 min,室温下滴加BSA封闭液,按TUNEL细胞凋亡试剂盒操作步骤染色,用DAPI复染,封片。荧光显微镜下观察,正常细胞核为蓝色,凋亡细胞核为绿色。随机取5个视野,计算细胞凋亡指数(AI)=凋亡细胞数/总细胞数×100%。
1.7 Western blot法检测大鼠脑缺血组织中PTEN、Akt和p-Akt蛋白表达
将各组剩余的6只大鼠,麻醉后处死,取脑,留取左侧梗死区大脑皮质组织,保存于-80℃冰箱。取50 mg脑组织,加入RIPA蛋白裂解液和磷酸化酶抑制剂,离心取上清,按BCA蛋白定量检测试剂盒说明测定蛋白浓度。行SDS-聚丙烯酰胺凝胶电泳分离,电转至PVDF膜,用5%脱脂奶粉封闭120 min,将一抗兔抗大鼠PTEN单克隆抗体、兔抗大鼠Akt和p-Akt多克隆抗体(稀释比例1∶500、1∶800、1∶1000)加入,4℃过夜孵育,TBST冲洗3次,加入二抗,室温孵育120 min,TBST冲洗3次,加入发光试剂,利用Image J图像分析软件分析,以GAPDH蛋白为内参,计算缺血脑组织中PTEN、Akt和p-Akt蛋白相对表达量,每个样品设6个重复样本。
1.8 统计学方法

2 结果
2.1 各组大鼠神经功能评分
假手术组大鼠在建模24 h和16 d时神经功能评分均为0分,模型组、电针组、磁刺激组和联合组大鼠在建模24 h和16 d时神经功能评分均高于假手术组,差异有统计学意义(均P<0.05),模型组、电针组、磁刺激组和联合组大鼠在建模24 h时神经功能评分差异无统计学意义(均P>0.05);与模型组比较,电针组、磁刺激组和联合组大鼠在建模16 d时神经功能评分降低(均P<0.05),与电针组和磁刺激组比较,联合组大鼠在建模16 d时神经功能评分降低(均P<0.05),见表1。

表1 各组大鼠神经功能评分分,n=12)Table 1 Neurological function scores of rats in
2.2 各组大鼠缺血脑组织中神经元凋亡指数
假手术组、模型组、电针组、磁刺激组和联合组大鼠脑缺血区组织中神经元凋亡指数分别为(2.47±0.76)%、(24.13±4.46)%、(17.07±2.77)%、(15.45±1.92)%和(11.27±3.34)%,差异有统计学意义(F=44.387,P<0.01);与假手术组比较,模型组、电针组、磁刺激组和联合组大鼠脑缺血区组织中神经元凋亡指数升高,差异有统计学意义(均P<0.05),与模型组比较,电针组、磁刺激组和联合组大鼠缺血脑组织中神经元凋亡指数降低,差异有统计学意义(均P<0.05),与电针组和磁刺激组比较,联合组大鼠脑缺血组织中神经元凋亡指数降低,差异有统计学意义(均P<0.05),见图1和图2。

与假手术组比较,aP<0.05;与模型组比较,bP<0.05;与电针组比较,cP<0.05;与磁刺激组比较,dP<0.05

图2 TUNEL法检测各组大鼠缺血脑组织中神经元凋亡情况(×200)Fig.2 Detection of neuronal apoptosis in ischemic tissues of rats by TUNEL(×200)
2.3 各组大鼠缺血脑组织中PTEN、Akt和p-Akt蛋白表达
与假手术组比较,模型组、电针组、磁刺激组和联合组大鼠缺血区组织中PTEN和Akt蛋白相对表达量升高,而p-Akt蛋白相对表达量降低,差异有统计学意义(均P<0.05);与模型组比较,电针组、磁刺激组和联合组大鼠缺血区组织中PTEN和Akt蛋白相对表达量降低,而p-Akt蛋白相对表达量升高,差异有统计学意义(均P<0.05);与电针组和磁刺激组比较,联合组大鼠缺血区组织中PTEN和Akt蛋白相对表达量降低,而p-Akt蛋白相对表达量升高,差异有统计学意义(均P<0.05),见表2、图3。
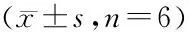
表2 各组大鼠缺血脑组织中PTEN、Akt和p-Akt蛋白表达Table 2 Expression of PTEN,Akt and p-Akt protein in ischemic tissues of rats in each

图3 Western blot法检测大鼠缺血脑组织中PTEN、Akt和p-Akt蛋白表达Fig.3 Detection of expression of PTEN,Akt and p-Akt protein in ischemic area of rats by Western blotting
3 讨论
脑缺血-再灌注损伤作为致残、致死率较高的病理过程,机制复杂,涉及多个病理过程,最终引发缺血区神经元损伤、凋亡,导致缺血区组织坏死,以及神经功能受损[10]。有研究指出,神经元缺血凋亡是脑缺血-再灌注损伤引起的各种有害级联反应所致的最终结局,是脑缺血-再灌注损伤的重要致残、致死机制[11]。电针作为中医学中针刺治疗技术的传承和发展,其在缺血性脑卒中治疗中的疗效已得到认可,可有效保护脑组织[12]。经颅磁刺激作为一种无痛、无创且安全的新技术,可通过在皮层产生感生电流而对刺激部位产生易化或抑制作用,在促进脑功能恢复中发挥重要作用[13]。本研究结果显示,电针联合经颅磁刺激可有效减轻神经功能损伤,且其效果优于电针和磁刺激单独治疗。而凋亡检测结果进一步提示电针联合经颅磁刺激可能通过减少大鼠脑缺血组织中神经元凋亡而保护神经功能。
PTEN基因位于人染色体10q23上,由8个内含子和9个外显子组成,同时具有蛋白磷酸酶和脂质磷酸酶活性,有研究指出[14],PTEN过表达可通过抑制PI3K/Akt信号通路激活而促进细胞凋亡。敲除PTEN基因表达则可促进PI3K/Akt信号通路激活而加速细胞增殖、生长[15]。近年来的研究发现,PTEN广泛存在于与学习记忆功能密切相关的皮层、海马组织中,且与神经系统发育和轴突导向密切相关[5]。动物实验发现[16],帕金森小鼠模型中PTEN基因缺失可降低多巴胺能神经元的凋亡。本研究结果显示,与模型组比较,电针组、磁刺激组和联合组大鼠缺血脑组织中PTEN和Akt蛋白相对表达量降低,而p-Akt蛋白相对表达量升高,与电针组和磁刺激组比较,联合组大鼠缺血区组织中PTEN和Akt蛋白相对表达量降低,而p-Akt蛋白相对表达量升高,说明电针联合经颅磁刺激可抑制缺血脑组织中PTEN蛋白表达,促使Akt蛋白磷酸化,从而激活PI3K/Akt信号通路,且其作用效能强于单独使用电针或磁刺激,提示电针联合经颅磁刺激可能通过作用于PTEN/PI3K/Akt信号通路而影响神经元凋亡,从而保护脑组织。
