基于网络药理学和分子对接技术探究田蓟苷抗冠心病作用机制①
2021-05-19郑瑞芳苏文灵都研文刘桂花
郑瑞芳,苏文灵,都研文,杨 洁,刘桂花
(新疆维吾尔自治区药物研究所,乌鲁木齐830002)
冠心病(coronary heart disease,CHD)是由于冠状动脉粥样硬化所致的管腔狭窄,冠状动脉供血相对不足,引起心肌缺血、缺氧的心脏疾病[1]。目前的治疗方法主要包括抗血小板治疗、调脂、经皮冠状动脉介入治疗等[2]。唇形科香青兰属植物香青兰(Dracocephalum moldavica L.)具有活血化瘀、补益心脑的功效[3],上市药品益心巴迪然吉布亚颗粒是香青兰单味药材制剂,临床应用显示出较强的补益心脑、改善心烦气喘的功效[4]。本课题组前期研究发现田蓟苷(Tilianin)是香青兰中的主要活性成分,对心肌缺血再灌注损伤大鼠心脏具有明显保护作用,具体表现在抑制线粒体功能障碍、抑制氧化应激从而抑制心肌细胞凋亡[5]。田蓟苷还具有调节血脂代谢,抑制动脉粥样硬化的作用[6]。网络药理学整合系统生物学与药理学方法结合,利用计算机模拟和系统建模,分析生物网络中药物、靶点与疾病之间的联系,通过对靶点分析探索多靶点药物的有效性,增加临床试验的成功率,降低研究成本[7]探讨多靶点药物整合调节的作用[8]。冠心病的病理发展过程涉及多重生物分子、多个蛋白和基因的变化。网络药理学通过整合中药中的药效物质与疾病相关网络,从整体的角度为多成分、多靶点中药研究提供了新思路和新方法[9]。利用分子对接技术验证化合物与靶点的结合能,为多靶点药物开发提供新途径和新策略[10]。本研究通过反向药效团匹配方法(PharmMapper)构建筛选化合物靶点,对获取的靶点信息进行GO富集分析和KEGG通路注释分析,构建活性成分-靶点网络,利用DrugBank、GEO数据库找到冠心病对应的靶点网络,构建化合物靶点与疾病靶点文恩图,利用分子对接技术验证配体与靶标蛋白的结合力,系统解析田蓟苷治疗冠心病的作用机制,现报道如下。
1 材料和方法
1.1 仪器与试药 细胞培养箱(美国Themo公司);多功能微孔板检测仪(瑞士TECAN公司)。田蓟苷(新疆维吾尔自治区药物研究所自制,20170805);DMEM/LOW培养基(美国HyClone公司,AF29527013);胰酶(美国HyClone公司,J200028);胎牛血清(美国Gibco公司,2145086CP);厌氧袋(日本三菱公司,0085ZJ-1);细胞增殖及细胞毒性检测试剂盒(武汉博士德有限公司,15E27C60)。
1.2 田蓟苷结构信息查询 从NCBIPubChem(https://pubchem.ncbi.nlm.nih.gov/)获得田蓟苷结构信息下载mol2格式。中药系统药理学数据库和分析平台(TCMSP,http://ibts.hkbu.edu.hk/LSP/tcmsp.php)是一个系统的中药药理学平台。借助TCMSP数据库获得田蓟苷的生物利用度(OB)、药物相似性(DL)、血脑屏障(BBB)等信息。
1.3 田蓟苷靶点预测 通过Swiss Target Prediction(http://www.swisstarget-prediction.ch/)网站建立基于配体的药效团模型,即基于化合物结构与配体的相似度,通过交叉验证和分析排列实现活性分子靶点的预测。在网站中选择种属为人源(Homo sapiens),再输入田蓟苷SMILES号检索成分对应靶点,获得与活性成分相关的蛋白。
1.4 化合物-作用靶点网络构建 根据预测的田蓟苷作用靶点,将靶点导入Cytoscape软件,构建田蓟苷-作用靶点关系网络,活性成分与潜在作用靶点用节点(node)代表,边(edge)用来连接活性成分与作用靶点,构建田蓟苷多靶点网络。
1.5 靶点通路GO和KEGG富集分析 利用DAVID(https://david.ncifcrf.gov/)数据库进行田蓟苷活性靶点GO和KEEG分析进行生物学功能注释,挖掘生物学意义。建立并上传田蓟苷对应潜在靶点文件,对分子功能、生物过程和细胞组成进行GO分析和KEEG通路注释,并将结果可视化。
1.6 冠心病相关靶点 利用DrugBank(http://www.drugbank.ca/)数据库,以冠心病为关键词,搜索已知的冠心病靶点,并用Cytoscape3.2.1软件构建疾病靶点相互作用网络。
1.7 化合物靶点与疾病靶点文恩图 将获得的田蓟苷潜在作用靶点与冠心病相关靶点取交集,通过建立田蓟苷-潜在活性成分靶点文件、疾病-靶点文件,利用Venny 2.1.0(csic.es)网站,构建潜在活性靶点-疾病靶点文恩图,得到田蓟苷抗冠心病相关靶点。
1.8 分子对接 采用Chem3D Pro 14.0软件分别对田蓟苷进行分子力场优化。在Chem3D Pro 14.0软件中选择Calculations菜单,选择MM2菜单,选择Minimize Energy选项,以默认参数计算化合物最小能量构象。导出MOL2文件后采用PyMOL2.1.1软件将MOL2文件转换为PDB文件后,采用AutodockTools1.5.6中的prepare_ligand4.py脚本处理配体文件,处理过程包括合并非极性氢,赋予原子类型和电荷等,输出PDBQT文件后配体文件准备完成。采用Autodock Vina 1.1.2进行分子对接,以每个对接结果结合能最低的构象作为稳定构象,运行环境为Ubuntu 18.04 LTS。
1.9 田蓟苷抑制H9c2细胞缺氧复氧损伤 将H9c2以10 000个每孔接种到96孔板中,在37℃、5%CO2培养箱中培养,待细胞长满后,弃去培养基,对照组和模型组加入DMEM低糖培养基,给药组3个浓度田蓟苷药液预给药6 h,预给药结束后,将模型组和给药组换以无糖培养基,在厌氧罐中缺氧缺糖3 h后复氧复糖3 h。给予10μLCCK-8,检测细胞活力。
1.10 统计学处理 采用Graphpad prism 8.0统计软件进行统计学分析,计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),检验水准α=0.05。
2 结果
2.1 田蓟苷结构信息 采用TCMSP软件搜索得到田蓟苷的吸收、分布、代谢和排泄(ADME)有关信息,田蓟苷分子式为C22H22O10,分子量为446.44,生物利用度(OB)为19.66、药物相似性(DL)为0.79,BBB为-2.09,田蓟苷化学结构式,见图1。

图1田蓟苷的化学结构
2.2 田蓟苷靶点预测 通过Swiss Target Prediction网站建立基于配体的药效团模型,共预测得到34个潜在靶点,见表1。田蓟苷潜在靶点蛋白群主要为分泌蛋白13.3%、G族蛋白偶联受体20%、氧化还原酶13.3%、裂解酶13.3%、激酶13.3%、水解酶类蛋白6.7%,见图2。
2.3 Cytoscape构建田蓟苷与潜在活性靶点网络关系图 利用Cytoscape 3.2.1构建田蓟苷与靶点间相互作用网络,网络图共包含34个节点和34条边,图中外圈表示田蓟苷潜在作用蛋白,内圈表示田蓟苷化合物,边表示田蓟苷与蛋白之间的关联,黄色表示活性化合物田蓟苷,蓝色表示相应的靶标。田蓟苷能直接或间接作用于IL2、TNF、ADORA1等主要靶点,见图3。

表1 基于药效团模型的田蓟苷靶点预测
2.4 田蓟苷靶点富集分析 对34个田蓟苷药效团靶点进行富集分析,发现细胞组成主要涉及细胞外基质、蛋白质样胞外、胞外区、质膜整体成分、膜、溶酶体腔、胞外间隙、质膜等。生物过程条目共20条,主要与血管内皮生长因子激活血小板衍生生长因子正向调节细胞增殖、成纤维细胞增殖的正调节、缺氧反应、钙介导的磷脂酶A2活性的激活、一氧化氮生物合成过程的正性调节、细胞内钙离子浓度正性调节、蛋白激酶B信号的正调控、细胞生长的正调控、脂类分解代谢过程的负调控、细胞迁移的正性调节、平滑肌收缩的调节、凋亡过程的负调控、MAPK级联、ERK1和ERK2级联的正调控、MAP激酶活性的正调节、活性氧代谢过程的正调控等。通过KEEG分析发现这些蛋白主要涉及VEGF信号通路、cGMP-PKG信号通路、MAPK s信号通路、T细胞受体信号通路和氮代谢等信号通路,横坐标代表途径中基因数目的比例,纵坐标代表途径名称,气泡大小代表基因数目,颜色越红,表明差异越显著,见表2、图4。
对9例苏醒后颅脑损伤昏迷病人进行访谈,发现病人心理体验主要表现在病人对生命价值认同、对健康状况存在期望、担忧工作生活改变、希望建立社会支持系统等方面,情绪体验可进一步归纳为2种类型:积极情绪体验、消极情绪体验。

图2 潜在活性成分占比

图3 田蓟苷与潜在活性靶点网络关系图

表2田蓟苷治疗CHD潜力的GO富集分析结果
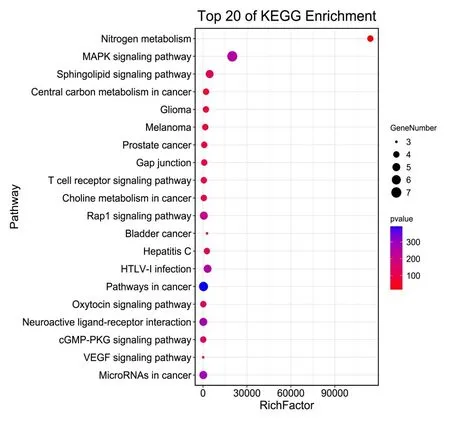
图4 田蓟苷治疗冠心病的靶点基因注释富集分析
2.5 靶点与疾病互作网络 通过数据库共查找冠心病靶点61个,利用Cytoscape 3.2.1构建冠心病与靶点间相互作用网络,得到一个包含61个节点,61条边的靶点-疾病交互网络,见图5。
2.6 田蓟苷潜在靶点与疾病靶点交集基因 利用Venny 2.1.0(csic.es)打开网页,在List1中输入田蓟苷潜在作用靶点,List2中输入冠心病相关靶点取交集,在文恩图上可以看到共有9个田蓟苷抗冠心病基因,分别为ADRA2A、ADRA2C、CD38、NOX4、ADORA3、MMP1、ALDH2、AKR1B1、PTGS2,见图6。

图5 靶点与疾病互作网络图

图6 田蓟苷潜在靶点与疾病靶点交集基因图
2.7 核心靶标分子对接
2.7.1 Alpha-2A肾上腺素能受体结合模式分析 从田蓟苷与Alpha-2A肾上腺素能受体分子结合能为-9.1,能够较好地结合在Alpha-2A肾上腺素能受体形成的结合口袋内。田蓟苷分子上的6号氧原子上的氢分别与196位酪氨酸和200位丝氨酸残基的氧原子形成强的氢键,键强分别为2.94Å和2.36Å。7号氧原子与394位酪氨酸残基的氢原子形成强的氢键,键强为2.97Å。8号氧原子与200位丝氨酸残基的环烃上的氢原子形成强的氢键,键强为2.36Å。母核上的碳原子与109位异亮氨酸、110位异亮氨酸、113位天冬氨酸残基等形成疏水作用力,见图7。
2.7.2 Alpha-2C肾上腺素能受体结合模式分析 从田蓟苷与Alpha-2C肾上腺素能受体结合能为-9.3,能够较好地结合在Alpha-2C肾上腺素能受体形成的结合口袋内。田蓟苷分子上的6号氧原子上的氢分别与204位亮氨酸和206位天冬氨酸残基的氧原子形成强的氢键,键强分别为3.16Å和2.92Å。7号氧原子与206位天冬氨酸残基的氢原子形成强的氢键,键强为2.97Å。8号氧原子上的氢分别与204位亮氨酸和205位天冬酰胺残基的氧原子形成强的氢键,键强分别为3.1Å和2.71Å。10号氧原子与135位半胱氨酸残基的氢原子形成强的氢键,键强为3.33Å。母核上的碳原子与131位天冬氨酸、203位甘氨酸、398位苯丙氨酸残基等形成疏水作用力,见图8。

图7 田蓟苷与Alpha-2A的分子对接图

图8田蓟苷与Alpha-2C的分子对接图
2.7.3 环状ADP核糖水解酶结合模式分析 从田蓟苷与环状ADP核糖水解酶结合能为-9.2,能够较好地结合在环状ADP核糖水解酶形成的结合口袋内。田蓟苷分子上的6号氧原子与221位苏氨酸残基的氢原子形成强的氢键,键强为2.78Å。8号氧原子与219位天冬氨酸残基的氢原子形成强的氢键,键强为3.01Å。10号氧原子与125位色氨酸残基的氢原子形成强的氢键,键强为3.26Å。母核上的碳原子与145位亮氨酸、186位丝氨酸、189位色氨酸残基等形成疏水作用力,见图9。

图9田蓟苷与CD38的分子对接图
2.7.4 基质金属蛋白酶1结合模式分析 从田蓟苷与 基质金属蛋白酶1结合能-8.7,能够较好地结合在基质金属蛋白酶1形成的结合口袋内。田蓟苷分子上的1号氢原子与315位天冬酰胺残基的氮原子形成强的氢键,键强为3.05Å。5号氧原子与207位苯丙氨酸残基的氢原子形成强的氢键,键强为2.99Å。7号氧原子与207位苯丙氨酸残基的氢原子形成强的氢键,键强为2.84Å。8号氧原子上的氢分别与318位丝氨酸和319位缬氨酸的氧原子形成强的氢键,键强分别为2.93Å和2.93Å。母核上的碳原子与85位赖氨酸、240位酪氨酸、241位苏氨酸残基等形成疏水作用力,见图10。

图10田蓟苷与MMP1的分子对接图
2.7.5 乙醛脱氢酶2结合模式分析 从田蓟苷与乙醛脱氢酶2结合能-8.5,能够较好地结合在乙醛脱氢酶2形成的结合口袋内。田蓟苷分子上的8号氧原子上的氢分别与459位缬氨酸残基的氧原子和氮原子形成强的氢键,键强分别为2.83Å和3.19Å。母核上的碳原子与170位苯丙氨酸、292位苯丙氨酸、296位苯丙氨酸残基等形成疏水作用力,见图11。
2.7.6 醛糖还原酶结合模式分析 从田蓟苷与醛糖还原酶结合能-10.3,能够较好的结合在醛糖还原酶形成的结合口袋内。田蓟苷分子上的3号氧原子上的氢与298位半胱氨酸残基的氧原子形成强的氢键,键强为3.15Å。4号氢原子与111位色氨酸残基的氮原子形成强的氢键,键强为3.05Å。9号氢原子与183位谷氨酰胺残基的氧原子形成强的氢键,键强为2.7Å。母核上的碳原子与209位酪氨酸、262位赖氨酸、300位亮氨酸残基等形成疏水作用力,见图12。

图11田蓟苷与ALDH2的分子对接图
2.7.7 前列腺素-过氧化物合酶2结合模式分析 从田蓟苷与前列腺素-过氧化物合酶2结合能-10,能够较好的结合在前列腺素-过氧化物合酶2形成的结合口袋内。田蓟苷分子上的1号氧原子上的氢与130位酪氨酸残基的氧原子形成强的氢键,键强为2.71Å。8号氧原子上的氢与34位天冬酰胺残基的氧原子形成强的氢键,键强为3.23Å。9号氧原子上的氢分别与130位酪氨酸和135甘氨酸残基的氧原子形成强的氢键,键强分别为2.87Å和3.11Å。母核上的碳原子与45位甘氨酸、153位脯氨酸、156位脯氨酸残基等形成疏水作用力,见图13。
2.8 田蓟苷对缺氧复氧损伤H9c2细胞保护作用
H9c2细胞进行缺氧复氧损伤后,与对照组相比,模型组细胞存活率为55%,田蓟苷预给药组细胞存活率低、中、高3个浓度均有提高,分别为69%、70%、75%,差异均有统计学意义(P<0.05),见图14。

图12 田蓟苷与AKR1B1的分子对接图

图13 田蓟苷与PTGS2的分子对接图

图14 田蓟苷可防止缺氧/复氧引起的H9c2心肌损伤
3 讨论
本研究筛选出的靶标CD38是一个定位于膜上的糖蛋白,具有ADPR环化酶和cADPR水解酶活性,广泛分布于各个组织,有文献报道抑制CD38可抑制eNOS偶联和NO的生成,从而减少缺血后心肌梗死的面积,以保护心肌细胞[11]。抑制CD38还可通过增加FOXO1核转位增加,减少ROS和NOX4的表达,从而保护心脏免缺血再灌注损伤影响[12]。基质金属蛋白酶作为心肌梗塞重构和心力衰竭的可能标志物而被广泛研究[13],心肌梗死后再灌注患者血清MMP-1在入院4 d后升高,在第14天达到峰值,到第28天MMP-1水平与第14天相比下降了50%。血清MMP-1水平与左室收缩末期容积指数呈负相关,与左室射血分数呈正相关[14]。心力衰竭后心肌组织MMP-1增加,心肌Ⅲ型胶原被降解,加快心室重构及心力衰竭进程[15]。本研究通过GO和KEEG通路富集分析,田蓟苷对冠心病的治疗可以通过多种途径,涉及多条信号通路其中涉及的MAPK信号通路、钙信号通路和ERK信号通路在前期的试验研究中已有验证,有文献报道田蓟苷可以抑制钙超载,增强线粒体活性从而抗心肌缺血再灌注损伤。田蓟苷能抑制MIRI损伤心肌细胞p-CaMKII和ox-CaMKII的表达,从而抑制线粒体介导的心肌细胞凋亡。田蓟苷可以通过调节P38 MAPK和ERK2蛋白的表达[16]。综上所述,本研究利用网络药理学初步探究了田蓟苷抗冠心病的作用机制,采用分子对接技术进行靶基因研究,为后续试验研究和临床应用提供理论依据。
