导尿管表面局麻药物缓释涂层的形成及其镇痛效果研究
2021-05-18赖馨宁黄宇光许海燕
赖馨宁 校 博 黄宇光 许海燕# 许 力* 刘 健#*
1(中国医学科学院基础医学研究所,北京协和医学院基础学院,北京 100005)
2(中国医学科学院北京协和医学院,北京协和医院麻醉科,北京 100730)
引言
导尿术是临床上常见的一种处置方式。但插入导尿管是一项侵入性操作,患者在清醒状态下置管可因刺激出现紧张、心率加快、烦躁、疼痛、血压增高等不良反应。而留置的导尿管更是会导致尿道与膀胱长期疼痛或不适,引发患者在术后恢复期的情绪不稳,严重影响患者的生活质量,严重时会导致患者的生命体征出现波动,甚至引发术后出血等不良反应。为了提高患者的顺应性,临床上通常会在插拔导尿管时使用一些局部麻醉药物来实施表面麻醉,如使用含局麻药物的凝胶润滑导尿管,或提前在尿道内注入局麻药后再进行插拔管操作[1]。但是,由于局麻药物的快速流失,其麻醉效果会迅速减弱,因此这些方法只能短时缓解插拔导尿管时引起的膀胱及尿道刺激。导尿管插入及长期留置时引起疼痛与不适仍是目前导尿术所面临的主要问题之一[2],特别是临床上迫切需要实现留置导尿管麻醉效果的长效化。
利多卡因是一种酰胺类局麻药,其麻醉强度大、起效快、弥散力强,黏膜穿透力强,是临床上应用最广的局麻药之一[3]。目前,虽然有一些在敷料、支架、水凝胶、微球等材料中进行利多卡因缓释的研究[4-7],但能在导管表面实现的报道尚不多见。
通过表面改性实现导管的功能化改良是一种有效的方法。但目前的商品化表面改性导尿管主要是为了改善其抗感染能力及亲水性[8-10],如银离子亲水涂层硅胶导尿管(商品名“安泌舒”)、银涂层超滑抑菌导尿管(商品名“安润捷”)等。具有局麻药物缓释功能的导尿管目前只有极少数的专利报道。刘秋华等发明了一种由亲水超滑镇痛缓释层、高分子聚合物支撑层和管主体层构成的导尿管,其表面层具有润滑作用,体外能在2 h 内持续释放盐酸利多卡因[11];Zhang 将导尿管长时间浸泡在负载药物溶液中,使药物通过扩散作用渗入导尿橡胶管壁中,从而实现长效缓释[12]。但这些研究所采用的实现方法需要大规模改变导尿管的制备工艺或储存运输条件,且都未见其后续在临床试验及商品化方面的进展。为此,本研究希望开发一种能够简单方便地在导管表面形成局部麻醉药长效释放涂层的技术,从而满足临床对留置导尿管麻醉效果长效化的需求,大幅提高导尿管留置患者的顺应性。
1 材料和方法
1.1 材料
聚乙烯醇1799(PVA)购自上海麦克林生化科技有限公司,泊洛沙姆407(P407)由巴斯夫(中国)有限公司提供,利多卡因(LID)、盐酸利多卡因(LIDH)、乙腈、甲醇购自阿拉丁试剂有限公司,三溴乙醇购自Sigma 试剂公司,乳胶单腔导尿管(16 号,直径5.3 mm)购自事达实业有限公司。乙腈和甲醇为色谱级,其余化学用品均为分析纯。
1.2 方法
1.2.1 含LID 聚乙烯醇在导尿管表面的成膜
配制15%(W/W)的PVA 水溶液,加入LID 后超声混匀,将溶液移至50 mL 离心管中,置于75℃水浴中备用。取导尿管的中间部分,剪成若干段,使每段导管长度约为7 cm。将导管垂直浸没在含药溶液中,并缓慢抽出,使其表面均匀涂布一层LIDPVA 溶液。室温晾干后放入50℃烘箱中干燥12 h,即可在导管表面形成LID-PVA 膜。
为了减缓LID 的溶出速度,可将具有LID-PVA单层膜的导管,按照上述挂膜方法在其表面继续涂布不含LID 的15% PVA 溶液,于室温下晾干后放入50℃烘箱中干燥。通过重复此步骤,可在LID-PVA膜表面覆盖不同层数的PVA 空白膜。
1.2.2 含界面活性剂的LID-PVA 膜的形成
向50 mL 锥形瓶中依次加入3 g P407,1.5 g LID,25.5 mL 水,冰浴下磁子搅拌30 min(200 r/min),获得混合液。将30 g 15%PVA 溶液慢慢加入到等质量的上述混合液中,冰浴下磁子搅拌30 min(200 r/min)。将最终混合液置于75℃水浴中,磁子搅拌15 min(200 r/min),之后按照本文第1.2.1 节所述的挂膜方法,在导尿管样品表面形成含P407的LID-PVA 膜(LID-P407-PVA)。
1.2.3 LID-P407-PVA 膜的理化学表征
在将导尿管上形成的LID-P407-PVA 膜小心地剥离后,用螺旋测微器在6 个不同位置测量膜的厚度,并计算其平均值。剪取2 cm×1.8 cm 的LIDP407-PVA 膜,准确称重并记录。在室温下将药膜浸入PBS(pH 值为7.4)中,隔一段时间后取出药膜,用滤纸轻轻除去药膜表面的水分,称取并记录此时药膜的重量。根据以下公式,计算药膜在每个时间点的膨润率S,有
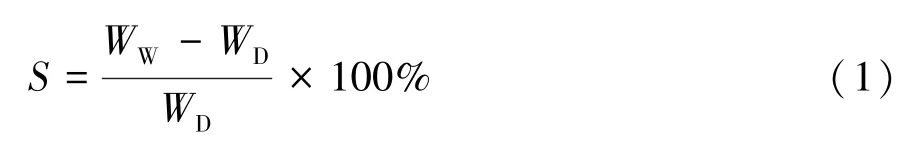
式中,WD表示干燥膜的质量,WW表示润湿后药膜的质量。每组测定3 个平行样品,取平均值作为最终结果。
1.2.4 LID-P407-PVA 膜载药量的测定
剪取1.8 cm×7 cm 的LID-P407-PVA 膜,剪碎后置于50 mL 离心管中,加入50 mL 水及200 μL 浓盐酸。将离心管放入恒温摇床中,设置温度为37℃,转速为100 r/min。48 h 后收集1 mL 上清液,用0.45 μm 滤膜过滤后,参照《中国药典》的规定,采用高效液相色谱(HPLC)法对盐酸利多卡因(LIDH)进行定量,并计算单位药膜面积的含药量。
液相色谱分析的具体条件如下:色谱仪采用Ultimate 3000(赛默飞世尔科技公司),色谱柱采用XSelect HSS-C18(5 μm,4.6 mm×250 mm),流动相为含50%乙腈的磷酸缓冲液(pH 值为8.0),流速为1.0 mL/min,检测波长为254 nm,柱温为40℃,进样量为10 μL,分析时间为16 min。
1.2.5 差示扫描量热仪(DSC)检测
剪取LID-PVA 及LID-P407-PVA 膜,准确称量后封入全铝样品皿中,用DSC Q2000 V24.11(美国热分析仪器公司)在氮气氛围保护下,以5℃/min速度由40℃加热至200℃。
1.2.6 体外药物释放实验
将表面覆膜的导尿管置于50 mL 离心管中,加入50 mL 的DDW。将离心管放入恒温摇床中,设置温度为37℃,转速为100 r/min。于各取样时间点吸取1 mL 上清,并同时补入1 mL 的新鲜DDW。将收集到的上清液用0.45 μm 滤膜过滤,然后加入稀盐酸盐酸,使LID 完全转化为盐酸盐,按照本文第1.2.4 节中所述的检测方法,对LIDH 浓度进行定量,并计算不同时间点的LID 累积释放量。
将释放实验结束后将药膜剥离剪碎,并加入200 μL 浓盐酸继续震荡48 h,作为释放终点。吸取1 mL 上清,并检测其LIDH 浓度。计算药膜中总的初始含药量,进而计算各时间点的LID 累积释放率。
1.2.7 LID-P407-PVA 膜的体内麻醉效果评价
本研究所涉及的动物实验均严格依照中国医学科学院基础医学研究所实验动物管理及伦理委员会规章的指导实施。
局麻药可引起感觉阻滞,因此将药膜埋入小鼠坐骨神经旁,通过观察小鼠对热痛刺激的反应评估麻醉效果。取体重为35 ~40 g 雌性昆明种小鼠,将其右后肢置于48℃的热水浴中,测定其缩腿反应潜伏期(缩腿阈值);每只小鼠测定3 次,每次间隔2 min,并计算3 次测定的平均值。剔除缩腿阈值小于3 s 或大于30 s 的小鼠,再将其余小鼠随机分为3组(n≥5)。将经三溴乙醇麻醉(50 mg/kg)后的小鼠以俯卧位固定在手术台上,剔除臀部毛发,切开皮肤和皮下组织进行钝性分离,暴露右下肢坐骨神经,在其上覆盖植入1 cm×1 cm 的空白膜(空白膜组,无利多卡因)或LID-P407-PVA 膜(药膜组,含4 mg 利多卡因),或滴加0.05 mL 盐酸利多卡因溶液(原药组,80 mg/mL),并缝合伤口。
术后4、6、8、10、12、14、17、20、30 h,采用热水浴法测定小鼠的缩腿阈值。每只小鼠在每个时间点重复测定3 次,间隔时间为2 min,并取3 次测定结果的平均值作为该时间点的缩腿阈值。
1.2.8 LID-P407-PVA 的组织相容性评估
药膜植入1 周后,处死小鼠,取与药膜接触部位的肌肉组织,用4%甲醛固定,用苏木精-伊红染色(HE 染色)后进行组织病理切片观察。
1.2.9 统计学分析
使用Prism 7 软件对实验数据进行分析,所有实验数据以平均值加减标准差表示(mean ± SD),两组间的统计学差异使用t检验进行分析,3 组及以上组间的统计学差异使用单因素ANOVA 进行分析,P<0.05 表示数据具有统计学差异。
2 结果
2.1 LID-PVA 在导尿管表面的成膜
将LID 分散在PVA 溶液中后,可以很容易地通过蘸取的方法在导尿管表面形成一层薄膜。之后通过进一步蘸取不含LID 的PVA 溶液,可在表面形成多层PVA 覆膜。随着覆盖膜层数的增加,导尿管表面膜的总厚度也有小幅增加(见图1(a)),但并未产生明显的叠加效果。推测是挂膜时可能会导致基膜的部分溶解,或者是PVA 溶液在PVA 膜上的附着力较低,导致后续挂膜操作只能形成很薄的膜层。LID 释放情况如图1(b)所示,虽然在48 h 释放终点时,覆膜组的累积释放度分别为69.4%、75.4%、76.5%、69.2%,略低于未覆膜组的累积释放度(84.0%),表明覆膜对内部药物的释放具有一定的阻碍作用,但各组初期的释放曲线基本一致,突释的效果均较为明显,且多次挂膜的操作极为耗时,因此多层覆膜方案并非改善LID-PVA 膜释放行为的最佳方法。
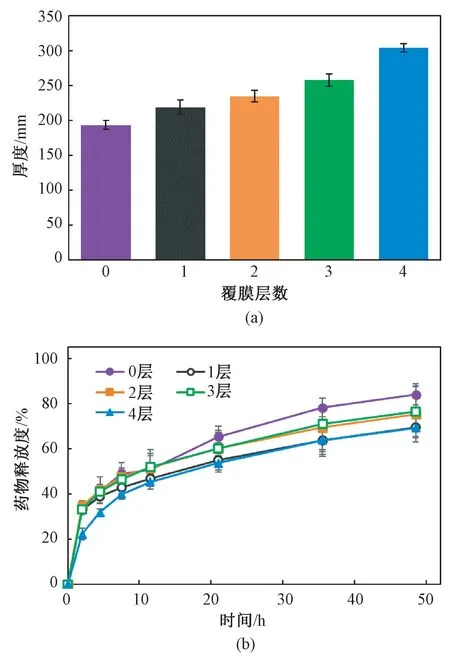
图1 不同覆盖膜层数LID-PVA 膜的厚度及LID释放情况。(a)不同覆盖膜层数LID-PVA 膜的厚度;(b)LID 释放情况Fig.1 The thickness of LID-PVA film with different cover layers and the LID release profile.(a)Thickness of LID-PVA film with different cover layers;(b)LID release profile
2.2 引入P407 对LID 与PVA 基质相容性的改善
LID-PVA 成膜后,用肉眼可以明显看到膜表面存在大量白色颗粒(见图2(a)),其原因可能是由于疏水性的LID 在成膜过程中与PVA 基质的相容性不佳,导致其更多地聚集在表层,甚至在膜表面析出,这应该也是导致LID-PVA 膜初期释放速度偏快的主要原因。
为了改善LID 与PVA 基质的相容性,尝试采用加入泊洛沙姆407(P407)的方法对PVA 膜进行改性。由于P407 具有温敏性,其高浓度溶液在最低临界溶解温度(LCST)之上会出现凝胶化的现象。为避免凝胶化妨害P407 对LID 的助溶效果,在挂膜液制备前期的混合过程中(此时溶液中的P407浓度相对较高)采用了冰浴,以确保P407 分子处于完全溶解状态。在挂膜液中引入P407 后,获得的LID-P407-PVA 膜表面平整,表面未见明显的LID 析出(见图2(b)),表明LID 在PVA 基质中的分散均匀性得到了明显改善。测得LID-P407-PVA 的厚度为(75.11±9.35)μm,膨润率约为600%,平均载药量为(4.00±0.18)mg/cm2。
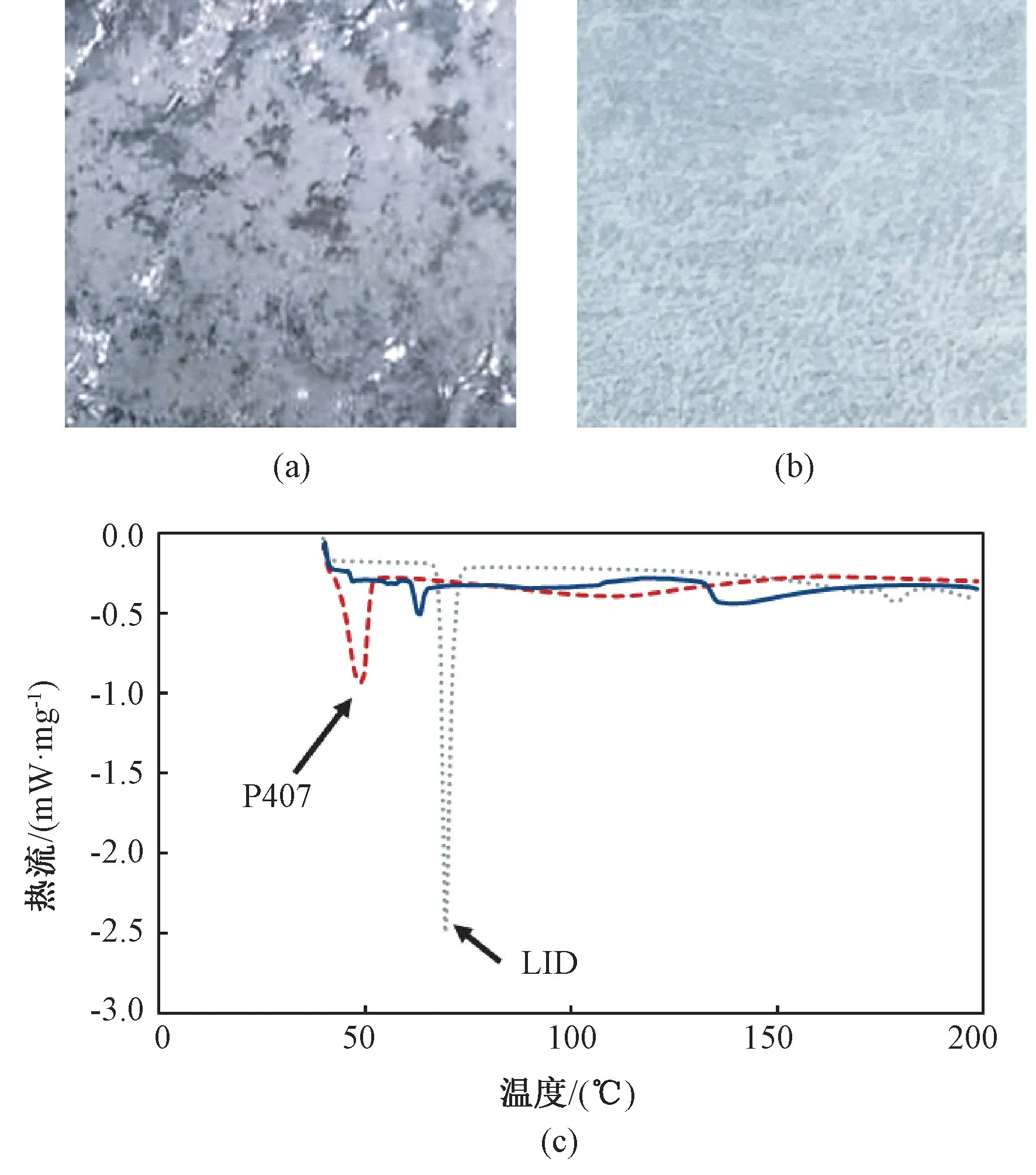
图2 LID-PVA 和LID-P407-PVA 膜的外观及其DSC 曲线。(a)LID-PVA 膜的照片;(b)LID-P407-PVA 膜的照片;(c)LID-PVA 膜(实线)及LIDP407-PVA 膜(虚线)的DSC 曲线,灰色点线为纯的LID,箭头标明的分别是LID 及P407 熔融峰的位置Fig.2 The appearance photos of LID-PVA and LID-P407-PVA films and their DSC curves.(a)Photograph of LID-PVA film;(b)Photograph of LID-P407-PVA film;(c)DSC curve of LID-PVA film(solid line)and LID-P407-PVA film(dash line), the gray dot line line is the DSC curves of pure LID, the black arrows indicate the melting peak of LID and P407, respectively
DSC 的测定结果(见图2(c))显示,在LIDPVA 的DSC 曲线中,LID 熔融峰的位置向低温方向略有偏移,推测是LID 与高分子基质材料混合后高分子与LID 分子间的相互作用所导致的。在添加P407 后,70℃附近处的LID 熔融吸热峰消失,从而推测P407 可以降低LID 的结晶度,使其主要以无定形态分布于PVA 基质中。
2.3 LID-P407-PVA 膜的膨润性及体外释药曲线
干燥的LID-P407-PVA 膜较硬,因此使用前需要进行润湿。由图3(a)可见,LID-P407-PVA 膜浸入PBS 溶液后会迅速吸水膨润,在5 min 内即可达到平衡,其饱和膨润率约为500%。润湿后的膜柔软光滑,有利于实施插管操作。
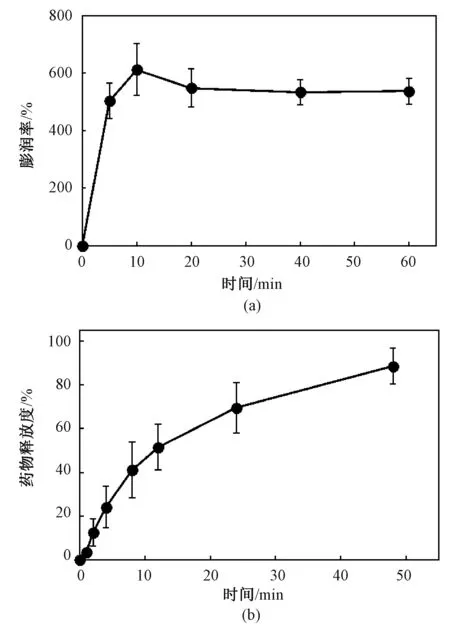
图3 LID-P407-PVA 在水中的膨润性及LID 释放曲线。(a)LID-P407-PVA 膜的膨润率随浸泡时间变化的曲线;(b)LID-P407-PVA 膜的LID 释放曲线Fig.3 The swelling and in vitro LID release profile of LID-P407-PVA.(a)The swelling ratio of LID-P407-PVA;(b)LID release profile
LID-P407-PVA 膜的体外药物释放曲线(见图3(b))显示,导尿管表面的LID-P407-PVA 膜能持续释放LID 达48 h,且释药曲线整体较为平缓,未见明显的突释,48 h 内的平均释药速度约为0.6 mg/h,可以满足持续麻醉的需求。
2.4 LID-P407-PVA 的体内麻醉效果评价
用热水浴法测试经小鼠坐骨神经旁给药后各组小鼠的缩腿反应潜伏时间,测试结果如图4所示。空白膜对照组的小鼠在整个测试时间段内的缩腿反应潜伏时间没有明显变化,而原药组及药膜组小鼠在给药后缩腿反应潜伏时间均发生了延长,说明LID 发挥了麻醉效果。但原药组小鼠的缩腿反应潜伏时间在给药12 h 时后就恢复了正常,而药膜植入组对缩腿反应的阻滞效果则能持续至20 h 以上。这说明,与原药相比,LID-P407-PVA 可以延长利多卡因对小鼠坐骨神经的感觉阻滞时间。
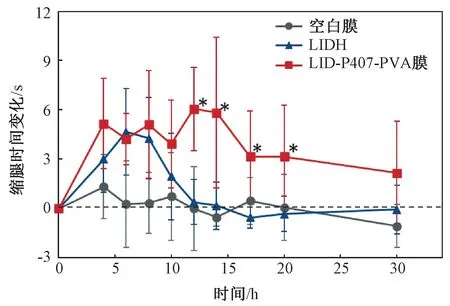
图4 术前及术后各组小鼠右后肢对48℃水浴的缩腿反应潜伏时间的变化情况(*P<0.05,与原药组比较)Fig.4 The latency time change of the withdrawal reaction of the right hind limbs of the mice in a 48℃water bath(*P<0.05, significant difference against the original drug group)
2.5 LID-P407-PVA 的组织相容性研究
手术1 周后处死小鼠并解剖,进行肉眼观察。各脏器无异常,药膜植入部位无血管增生,植入物与周围组织无粘连,没有明显刺激反应。取与药膜接触部位的肌肉组织进行切片及组织病理染色。HE 染色结果(见图5)显示,在空白膜和药膜植入组可观察到少量炎症细胞浸润,但无明显感染、组织细胞坏死及组织纤维化等反应,肌肉组织结构完整,表明植入物只引起了非常轻微的炎症反应,组织相容性良好。
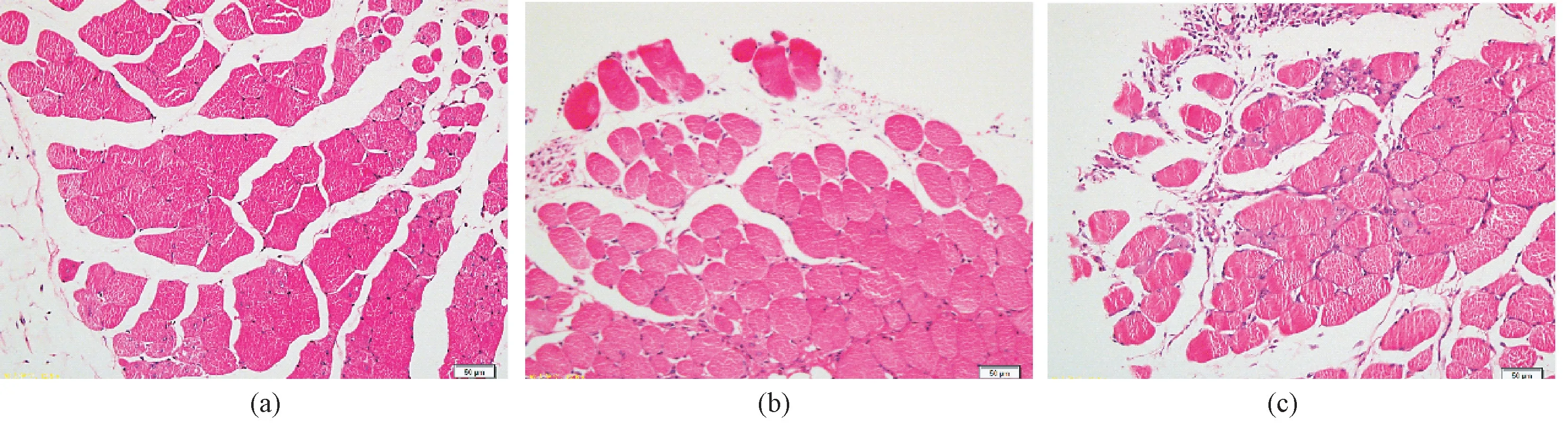
图5 各组小鼠手术部位肌肉组织的病理切片观察(HE 染色, 20×)。(a)空白膜组;(b)LIDH 组;(c)LIDP407-PVA 膜组Fig.5 Pathological sections of muscle tissue around the implantation site of each group(HE staining, 20×).(a)Blank film group;(b)LIDH group;(c)LID-P407-PVA group
3 讨论
导尿术是临床上常见的一种处置方式,通过局麻药物的缓释化技术,有望实现留置导尿管麻醉效果的长效化,从而大幅缓解患者尿管插管及留置时的不适和疼痛。在本研究中,选择在临床中被广泛应用的利多卡因作为缓释对象。除了因为利多卡因具有吸收速度快、黏膜穿透力强、扩散范围广、麻醉强度大、价格低廉等优点[3,13-14],更重要的是其有原型药物(LID)及盐酸利多卡因(LIDH)两种形式;其盐酸盐具有良好的水溶性,而原型药物溶解性较差,因此易于通过选择合适的药物形式并配合不同亲疏水性的高分子基质,获得合适的缓释时间。
目前,在利多卡因缓释剂型的研究中,多采用聚乳酸等疏水性高分子作为基质材料负载利多卡因原药[15-16],或采用胶原蛋白等亲水性高分子负载盐酸利多卡因[4,17]。前者通常可以获得较长的缓释时间;而后者在柔软性、润滑性等方面具有优势,但普遍缓释时间较短。聚乙烯醇(PVA)具有良好的成膜性[18]和生物相容性[19],以及适度的拉伸强度、柔韧性和硬度。而且,PVA 的亲疏水性可通过改变其醇解度在较大范围内进行调节:较低醇解度的PVA 由于链上存在大量疏水乙酸基团,溶解度通常较差;而高度醇解的聚乙烯醇水溶性较好,但需要高溶解温度(100℃)和较长的溶解时间来破坏分子内和分子间的强氢键作用力[20-21]。因此,具有良好的成膜特性及适当亲疏水性的聚乙烯醇(PVA)是一种理想的制备LID 缓释膜的高分子基质材料。
当使用PVA 膜负载LIDH 时,LIDH 在1 h 内的释放度就达到了90%(数据未展示)。因此,为了延长药物的释放时间,本研究中使用了水溶性较低的利多卡因原型药物。但是,形成的LID-PVA 膜突释情况仍然较为严重,且用肉眼可以明显看到膜表面存在大量白色颗粒。其原因可能是由于疏水性的LID 在成膜过程中与PVA 基质的相容性不佳,导致LID 更多地聚集在表层,甚至在膜表面析出。界面活性剂(如泊洛沙姆、吐温等)是增强疏水性药物亲水性的有效手段,为了减少LID 在膜表面的析出,进一步提高药膜的缓释性能,减少突释,本研究尝试在成膜液中引入界面活性剂,以改善LID 与PVA 的相容性。泊洛沙姆是一类由聚氧乙烯(PEO)和聚氧丙烯(PPO)组成的非离子型嵌段共聚物,具有两亲性和表面活性。泊洛沙姆407(P407)是研究最多、应用最广泛的泊洛沙姆之一,是获得美国FDA认证的一种无毒、无刺激性的药用辅料,易溶于水,能形成独特的疏水内核-亲水外壳结构,是疏水性药物的理想载体[22-23]。在LID-PVA 膜配方组成的基础上,加入表面活性剂P407,可使LID 以非晶态形式均匀分布在PVA 基质中,其分散性得到了显著改善,其释放曲线也更加平缓。另外,获得的LIDP407-PVA 膜具有良好的润湿性,可以短时间内充分吸水膨润,有利于临床应用。
在体外释放实验中,LID-P407-PVA 在PBS 中可以平稳释放LID 达48 h,能够满足绝大多数临床应用中对留置导尿管麻醉持续时间的要求。而且,由于该释放实验是在大体积释放介质中进行的,释放出的药物可以很快扩散,从而使膜表面附近的药物的浓度始终远小于其饱和浓度,因此这时的药物释放曲线反映的是薄膜释放药物的最大速度。在实际的临床应用中,由于尿道中导尿管外壁与尿道壁之间的间隙较小,释放介质的体积有限,释放的药物能够很快达到饱和,因此推测该缓释膜在实际的导尿应用中能够实现更长时间的LID 持续释放。
4 结论
将PVA、泊洛沙姆P407、利多卡因以恰当比例共混后作为成膜液,可实现在导尿管表面的成膜,所获得的LID-P407-PVA 膜润湿性良好,在PBS 中能持续释放利多卡因达48 h,在动物体内也能够显著延长神经阻滞时间。这种在导管表面进行利多卡因缓释涂层修饰的方法,具有制备简单快速、成本低、可现场加工、生物相容性好、缓释效果良好等优点,有望成为临床上缓解患者插管不适的有效方法,具有良好的应用前景。
