生物转化法提高木糖醇产量的发酵条件优化
2021-05-18陈雪松杨胜利
陈雪松,杨胜利
(1.浙江树人大学 生物与环境工程学院,浙江 杭州 310015;2.浙江工业大学 药学院,浙江 杭州 310014)
传统木糖醇生产工艺是以玉米芯为原料,经过酸水解等预处理,产生木糖,采用加氢催化技术制备木糖醇。该工艺产量较低,能耗大,污染严重且生产成本高。此外,镍催化剂会污染环境,严重制约企业发展和国际竞争力。而采用微生物发酵半纤维素水解液生产木糖醇,具有反应条件温和、低能耗、相对环境污染程度小、产品质量安全可靠的优点[1-5]。
柑橘皮渣尚未得到好的开发利用,基本上任其腐烂,化为尘土肥料。也曾有人从柑橘皮渣提取精油、果胶、色素、黄酮、柠檬苦素和膳食纤维等,但都未形成规模生产。柑橘皮渣富含半纤维素,用其做原料生产木糖乃至木糖醇,成本低廉,目前国内外未见相关报道。并且柑橘皮渣中的木聚糖结合不如玉米芯牢固,容易水解得到木糖。本研究以实验室保藏的转化木糖醇的Y-3号菌株为实验菌株,对木糖转化发酵条件进行优化。
1 材料与方法
1.1 材料
菌种来自实验室保藏的Y-3号菌株。
活化培养基:酵母膏5 g·L-1,磷酸二氢钾2 g·L-1,D-木糖20 g·L-1,二水氯化钙0.1 g·L-1,硫酸铵5 g·L-1,七水硫酸镁0.2 g·L-1,琼脂20 g·L-1。
种子保藏培养基:酵母膏5 g·L-1,磷酸二氢钾2 g·L-1,D-木糖20 g·L-1,二水氯化钙0.1 g·L-1,硫酸铵5 g·L-1,七水硫酸镁0.2 g·L-1,琼脂20 g·L-1。
发酵培养基:柑橘皮水解液(木糖含量20 g·L-1),酵母粉10 g·L-1,蛋白胨10 g·L-1。
灭菌条件:木糖与其他营养成分分开灭菌,条件为121 ℃,20 min。
1.2 方法
1.2.1 柑橘皮水解液的制备
柑橘皮选自温州蜜柑皮,将蜜柑皮烘干后,用电动粉碎器粉碎,粉碎粒度100目,半纤维素质量分数为6.9%。
柑橘皮半纤维素水解。柑橘皮粉末以1∶7(质量∶体积)的固液比与质量浓度1.0%硫酸混合,121 ℃下水解1 h。
浓缩。水解液离心滤去残渣后,50 ℃真空浓缩,至总还原糖约为20%。
中和。水解液用NaOH中和至pH 10.0,4 000 r·min-1离心20 min去除沉淀。上清液用浓硫酸回调至pH 5.5,冷藏备用。
1.2.2 发酵条件的优化
发酵条件的优化,具体是对装液量、接种量、水解液的pH、发酵温度、转速进行单因素实验,依次求得最优培养条件。发酵实验每个变量做3个平行样,以木糖转化率为指标,确定最优条件。
1.2.3 测定方法
取待测样品10 mL,3 000 r·min-1离心10 min,将上清液适当稀释。在25 mL大试管中加入1 mL稀释的上清液和3 mL的DNS试剂,充分混合,沸水浴中反应5 min,冷却,定容至25 mL。在波长540 nm处测量吸光度值,根据标准曲线回归方程计算出样品木糖浓度[6]。
使用紫外分光光度计法测定木糖醇的含量[7]。取适量发酵液,4 500 r·min-1离心15 min,将上清液适当稀释。取1 mL稀释液于小试管中,加入1 mL试剂a,混匀后在室温下反应10 min,再分别加入2 mL试剂b和4 mL的NaSH试剂,混合均匀后在53 ℃水浴中保温15 min,冷却后于412 nm处测定吸光度值。试剂a:将0.320 g高碘酸钾溶于100 mL 1%的盐酸中;试剂b:配置鼠李糖1.11 g·L-1;NaSH试剂(需现配现用):在100 mL 150 g·L-1的乙酸铵中,分别加入0.2 mL的乙酸及乙酰丙酮。
2 结果与分析
2.1 木糖的标准曲线
木糖的标准曲线见图1。
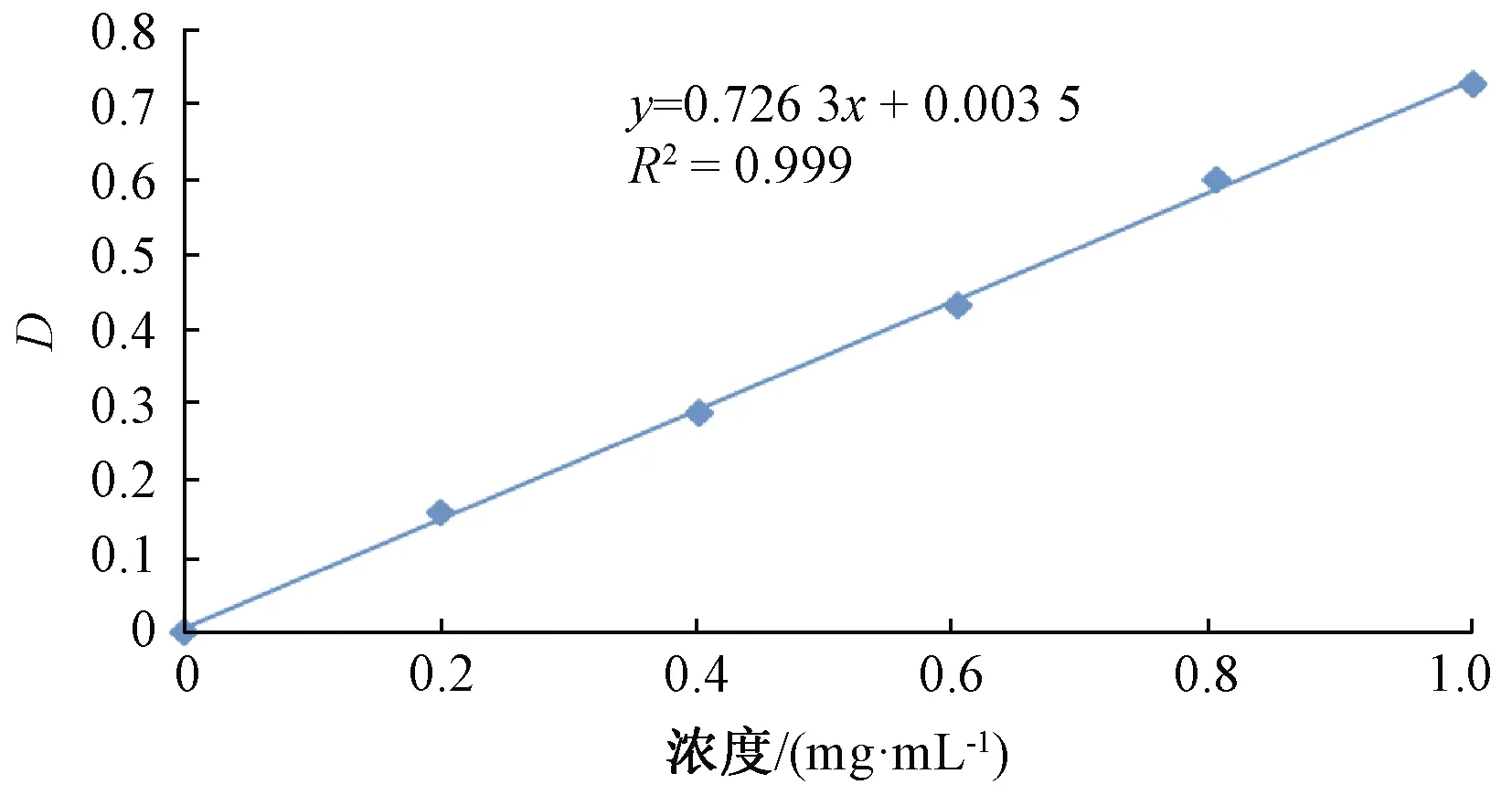
图1 木糖的标准曲线
2.2 木糖醇的标准曲线
木糖醇的标准曲线见图2。
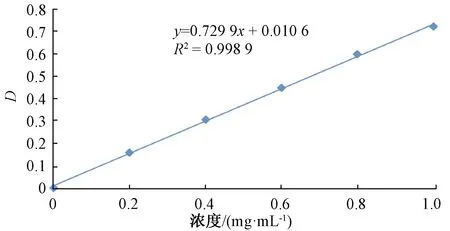
图2 木糖醇的标准曲线
2.3 发酵条件的优化
2.3.1 转速对发酵效果的影响
木糖及木糖醇转化率的影响因素比较多,其中溶解氧是关键其一[8],菌体生长和代谢产物的积累取决于溶解氧的多少。通常发酵液溶氧量的改变是通过调节转速来实现的。对木糖醇产生的代谢网络分析看出,在木糖还原酶(XR)的催化作用下,以NADPH为辅酶转化产生木糖醇,此过程不需要氧的参与。而代谢过程在需氧状态下[9],木糖醇会进一步在木糖醇脱氢酶(XDH)的催化下氧化生成木酮糖,更多的文献表明微耗氧环境对木糖醇的积累是有利的。因而,实验设置了100、120、140、160和180 r·min-1的低转速,以研究其生物转化木糖醇情况(表1)。
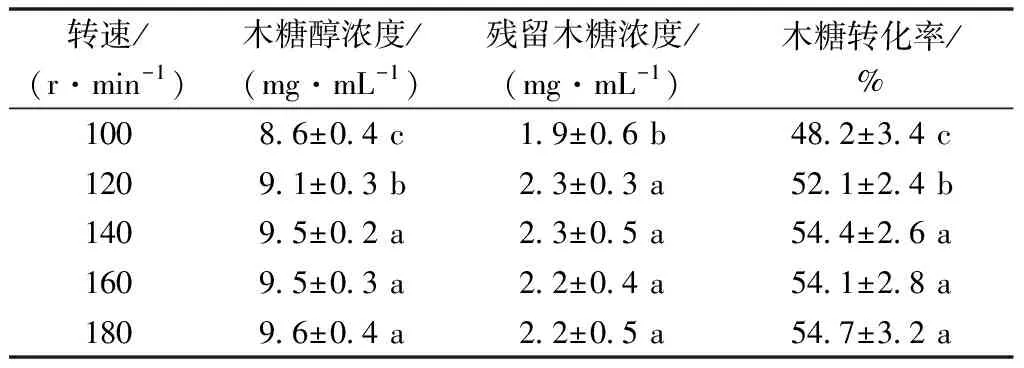
表1 摇床转速对发酵效果的影响
由表1可知,随着转速不断增大,酵母菌转化木糖醇的量也随之增加,但是幅度并不明显,在转速为140 r·min-1时,木糖转化率最高为54.4%。再增大转速影响不大,主要原因是增大转速使得溶解氧量增加,在发酵前期更加有利于酵母菌的繁殖。因此,当转速为140 r·min-1时已经能够满足溶氧要求,达到酵母生长的目的。
2.3.2 装液量对发酵效果的影响
摇瓶发酵过程中装液量的控制非常关键。在转速不变的情况下,摇瓶装液量决定了水解液溶解氧的浓度[10]。模拟好氧、缺氧以及厌氧条件的表征是通过装液量来实现的。影响发酵反应产物积累的重要条件是曝气量,通常氧气充分的状态下不会产生木糖醇,在严格厌氧的状态下菌体不能利用木糖进行发酵。
在250 mL的锥形瓶里,实验设置了20、40、60、80 mL的装液量,研究其发酵情况(表2)。
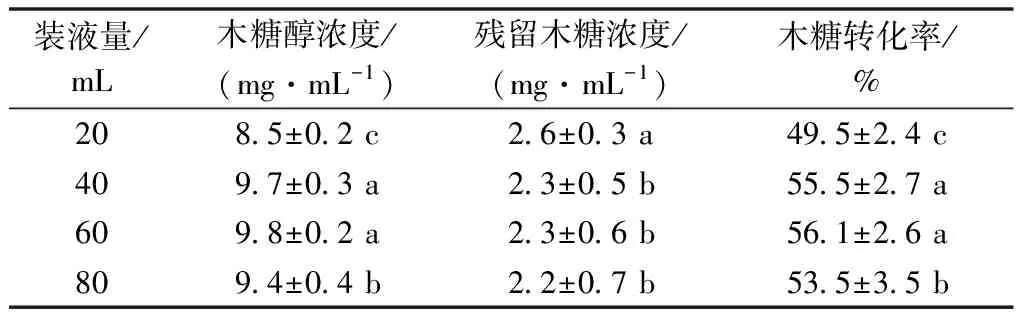
表2 装液量对发酵效果的影响
由表2可知,在装液量为40~60 mL时发酵效果最好,木糖转化率超过55%。此时酵母菌发酵所需营养物质充足,体系传质效果好,且提供了足够的溶氧和养分供酵母菌进行繁殖。
2.3.3 温度对发酵效果的影响
温度对微生物生长繁殖和代谢产物积累是至关重要的,温度通过对菌种体内酶的改变来影响微生物的发酵状态。偏低或者偏高的温度会影响代谢产物的积累,是由于温度会影响菌体内酶活性、氧气和其他营养物质的传质速率。在最适温度情况下,有利于菌种体内酶的生长、发酵和转化,并处于最佳活性状态。偏离这个温度,过低会使酶的活性降低,过高可能导致酶变性失活。因而基于酵母菌生长及代谢产物积累的特性,实验设置了25、30、35、40 ℃ 4个温度变量,以研究其木糖醇转化情况。
由表3可知,随着温度升高,酵母菌所产生的木糖醇也随之增加,在30 ℃达到最大的木糖转化率57.7%,超过35 ℃时转化率反而下降,达到40 ℃时转化率很低,只有42.4%,这可能与菌体内参与代谢的酶活性受温度影响有关。
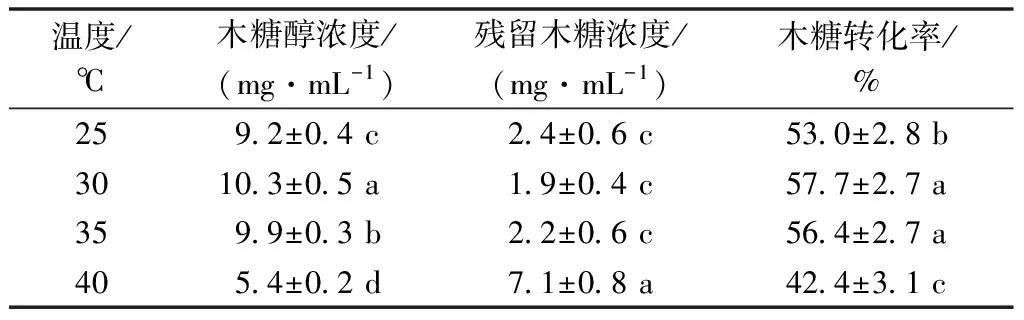
表3 温度对发酵效果的影响
2.3.4 接种量对发酵效果的影响
接种量是指投加种子液的体积和接种后培养液体积的比值。菌种在发酵液中生长繁殖的速度由接种量的多少决定,增加接种量可以缩短发酵中菌丝繁殖达到高峰的时间,提前形成产物,并能大大削弱杂菌的生长机会。但投加的接种量过多或者过少,都会对发酵产生影响。对于接种量的优化,主要考虑菌体与营养物质及代谢产物的关系,接种量过少延长发酵时间,降低发酵罐的生产率。过多则会消耗过多底物用于菌体生长,并且可能引起溶氧不足,过多移入代谢废物,对木糖醇积累不利,且成本过高[11]。适宜的接种量,菌体在发酵液中生长旺盛,同时营养成分不会过分消耗,能够正常累积代谢产物。因此,实验设置了4%、6%、8%、10% 4个接种量变量,以研究其木糖醇转化情况。
由表4可知,木糖醇的转化率受接种量影响也较大,随着接种量的增大,在6%的接种量木糖转化率达到最大值61.5%,再增加接种量木糖转化率反而降低,可能是由于菌体的增多导致其代谢废物积累也多,影响发酵。
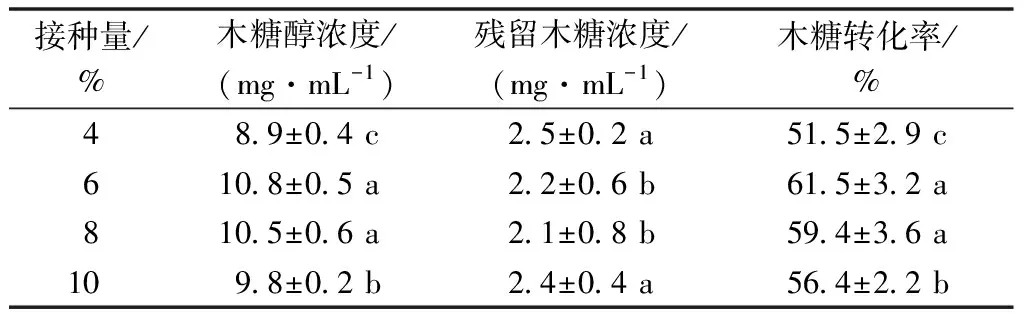
表4 菌体接种量对发酵效果的影响
2.3.5 起始pH对发酵效果的影响
pH在菌体发酵过程中,影响着菌体的生长繁殖和代谢途径,适宜的pH范围能促进微生物代谢产物的积累,是菌体新陈代谢活动的重要影响因素。各种菌种在转化木糖醇时最佳pH值不同,本实验选用的Y-3菌种在pH呈酸性条件下生长繁殖非常旺盛。很多研究者报道酵母转化木糖产生木糖醇的最适宜pH为4.0~6.0[12]。因此,本实验设置了4.0、4.5、5.0、5.5、6.0 pH变量,以研究其木糖醇转化情况。当pH为4~6时菌株具备了木糖醇转化能力,并具有一定的正相关性,其中在pH为5.5时有最高的转化率,达到64.4%(表5)。
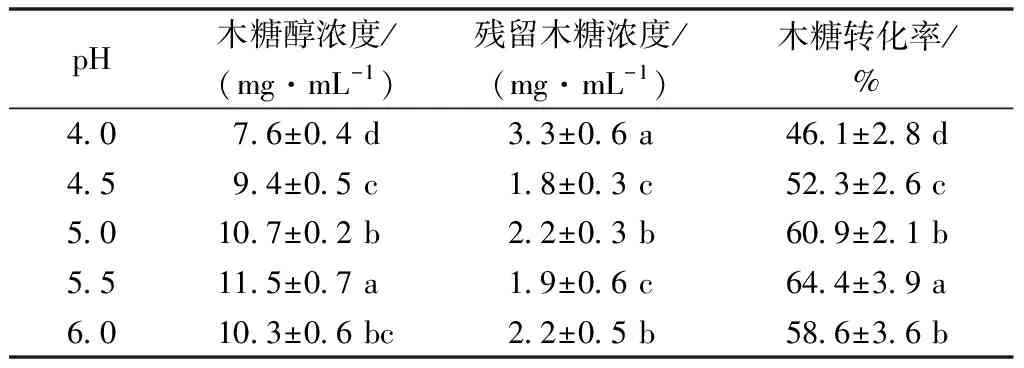
表5 起始pH对发酵效果的影响
3 小结
产木糖醇Y-3号菌株的优化发酵条件:转速140 r·min-1,装液量为60 mL,适宜温度30 ℃,最佳接种量为6%,起始pH 5.5。优化后实验测得木糖醇浓度为11.5 mg·mL-1,木糖转化率为64.4%,较未优化时的木糖转化率提高。
