栀子苷对大鼠蛛网膜下腔出血后早期脑损伤氧化应激的保护作用
2021-05-18黎劭学肖晓岚尹雷孟苗苗岑学程蔡军杭春华
黎劭学肖晓岚尹 雷孟苗苗岑学程蔡 军杭春华
(1.广州中医药大学第二附属医院 脑病中心,广州 510120; 2.广州中医药大学第二附属医院 儿科,广州 510120; 3.广州中医药大学第二临床医学院,广州 510120; 4.南京大学医学院附属鼓楼医院 神经外科,南京 210008)
动脉瘤性蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是一种致死致残率甚高的脑血管危急重症[1]。 SAH 后早期脑组织损伤(early brain injury, EBI)覆盖了从初次出血到血管痉挛发生前72 h 内,脑组织的一系列重要病理损伤改变,是导致SAH 高致残致死率的主要机制[2-4]。 而氧化损伤导致的神经细胞凋亡是其中的一个重要环节。
核因子相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)是参与调节细胞抗氧化应激反应的重要转录因子[5]。 在氧化应激状态下,Nrf2 会激活并启动下游的基因转录,通过上调多种抗氧化酶的表达,以提高细胞的抗氧化能力[6]。 栀子苷(geniposide, GNP)属于环烯醚萜苷类化合物,是茜草科植物山栀(Gardenia jasminoidesEllis)果实中的其中一种主要活性成分。 GNP 的药理作用相当广泛,具有抗炎、抗氧化应激、调节血糖、抗肿瘤等多种功效[7-11]。 近年研究发现,GNP 在缺血及出血性脑血管病细胞及动物实验模型中,均表现出一定的神经保护作用,但其相关作用通路及分子机制尚不完全明确,可能与抗氧化应激、抗炎、线粒体保护等多个机制存在密切关系[12-13]。 有关GNP 对SAH后EBI 的作用鲜有研究,为了探讨相关机制,本研究对大鼠蛛网膜下腔出血模型进行GNP 后处理,通过观察Nrf2 通路相关抗氧化损伤蛋白表达的变化及神经细胞凋亡情况探讨其可能的治疗效果。
1 材料和方法
1.1 实验动物
60 只SPF 级雄性Wistar 大鼠,12 ~13 周龄,重量约280 ~330 g,由扬州大学比较医学中心提供[SCXK(苏)2017-0007],饲养于南京市鼓楼医院动物实验中心[SYXK(苏)2018-0020]。 饲养环境温度为(22±2)℃,具有12 h 光照循环,动物自由饮食。 本实验经南京市鼓楼医院实验动物伦理委员会审批(IACUC 2018020003),并在实验过程中严格遵循3R 原则。
1.2 主要试剂与仪器
栀子苷(购自上海源叶生物科技有限公司,HPLC ≥9899.3%,货号:24512-63-8);戊二醛(MDA)试剂盒(购自南京建成生物工程研究所,A003-1);Nrf2 抗体(批号AF7603)、NQO-1 抗体(批号AF7614)、HO-1 抗体(批号AF1333)、GST 抗体(批号AF2299)、GAPDH 抗体(批号AF5009)、TUNEL 试剂盒(批号C1089)购自碧云天生物科技有限公司。
5024R 低温高速离心机(德国eppendorf 公司);FLX800 荧光酶标仪(美国BioTek 公司);IX51 荧光显微镜(日本Olympus 公司);XO-400S 超声波细胞破碎仪(中国南京先欧公司);Western blot 转印电泳仪器(美国Bio-Rad 公司);Tanon5200 化学发光成像分析系统(中国上海天能科技有限公司)。
1.3 实验方法
1.3.1 动物分组及给药方法
Wister 大鼠经适应性喂养3 d 后,随机分为4组:假手术组、模型组,GNP 低剂量组(50 mg/kg),GNP 高剂量组(100 mg/kg),每组12 只。 药物处理的两组大鼠在造模后30 min 给予GNP 不同剂量一次腹腔内注射处理。 模型组和假手术组以等量生理盐水代替药物注入。
1.3.2 大鼠蛛网膜下腔出血模型制作
本研究选用视交叉前池注血模型,操作步骤与在既往报道上进一步改进[14]:取俯卧位,将动物固定颅顶水平位,于冠状缝前8.0 mm 处钻孔。 解剖右侧股动脉并抽取自体动脉血350 μL。 立即将注射器以30°方向,插入穿刺孔10 mm,即达视交叉前池,维持20 s 将自体血注射完毕。 骨蜡封闭骨孔缝合头皮,头低位30 min,饲养同术前。 在建模过程中,如大鼠造模失败或24 h 内死亡,则取用备用大鼠补齐每组存活12 只。 假手术组接受相同的SAH造模流程,但视交叉前池仅注入相应等量的生理盐水,其它步骤不变。
1.3.3 脑组织取材及处理
在造模后第24 h 处死大鼠,分别以冰冻生理盐水灌注后取全脑并根据Sugawara 评分标准[15]进行蛛网膜下腔出血评分(图1)。 其后取颞叶皮层进行MDA 含量测定及Western blot 实验操作。 另用生理盐水灌注后再使用多聚甲醛灌注固定并制石蜡切片,备免疫荧光法检测Nrf2 的细胞表达情况,以及TUNEL 荧光染色观察细胞凋亡情况。
1.3.4 免疫荧光标记染色检测颞叶皮层Nrf2 表达情况
石蜡切片脱蜡、热修复,加入3% H2O2抑制内源性过氧化物酶。 加入兔抗Nrf2(1 ∶200)4℃孵育过夜,加入荧光二抗37℃孵育90 min。 复染后在荧光显微镜下观察阳性表达情况。
1.3.5 颞叶皮层组织MDA 含量测定
提取部分适量颞叶皮层组织,在冰浴中按照1 ∶9(W/V)加入生理盐水制成10%脑组织匀浆,离心后取上清液,按照试剂盒说明进行操作测定MDA含量。
1.3.6 Western blot 检测HO-1、NQO-1、GST 蛋白表达
提取颞叶皮层脑组织,10%聚丙烯酰胺凝胶电泳分离蛋白,转膜后分别加稀释的一抗NQO-1、HO-1、GST 及β-actin 4℃孵育过夜。 加二抗室温孵育2 h,洗膜后显影成像。 采用Quantity One 软件分别计算各条带灰度值的百分比,以分析各组蛋白表达量。
1.3.7 TUNEL 检测神经细胞凋亡情况
按照试剂盒说明步骤进行检测,室温下,PBS 溶液清洗、TrixonX-100 处理后,滴加TdT 酶荧光标记液避光孵育,4,6-二脒基-2-苯基吲哚(4,6-diamidino-2-phenylindole,DAPI)染液进行核染色,孵育并再次PBS 溶液清洗后,用抗荧光淬灭剂封片,荧光显微镜观察并拍照。 随机选取切片5 个区域,通过计数总细胞数和凋亡细胞数,计算细胞凋亡率。
1.4 统计学方法
采用SPSS 24.0 统计学分析软件建立数据库,数据均以平均数±标准差(±s)表示,对组间数据的比较统计采用单因素方差分析(Oneway ANOVA),组间行turkey检验,死亡率比较采用Fisher’s 精确概率检验,P<0.05 认为有统计学差异。
2 结果
2.1 各组大鼠死亡率及蛛网膜下腔出血情况评分
在造模后至处死前24 h 内,假手术组、模型组、GNP 低剂量组、GNP 高剂量组的死亡率及存活情况分别为0%(n=0/12)、20%(n=3/15)、20%(n=3/15)和7.7%(n=1/13)。 虽然GNP 高剂量组死亡率百分比较模型组及低剂量组有所下降,但各组间死亡率并无显著统计学差异(P>0.05)。
对于大鼠而言,24 h 后蛛网膜下腔出血即被迅速清除[16]。 本实验根据Sugawara 评分标准[15],在24 h 观察点对实验大鼠蛛网膜下腔出血量进行评分,结果示假手术组的大鼠脑组织未见出血,评分为0 分。 而模型组、GNP 低剂量组、GNP 高剂量组在24 h 的脑组织腹侧可见蛛网膜下腔不同程度的积血和血凝块,如图2 所示。 四组的SAH 出血量评分分别为0、(15.17±0.48)、(14.26±0.61)、(14.35±0.77)。 虽然药物处理的两组大鼠术后24 h SAH出血量明显高于假手术组,但与模型组相比,评分并无显著性差异(P>0.05,n=6)。
2.2 GNP 对SAH 大鼠模型颞叶皮层Nrf2 表达的影响

注:(A):腹侧6 分区,6 个部位分数相加得出总的评分以评估大鼠蛛网膜下腔出血情况,最低分0 分,最高分18分。 0 分:未见出血;(B):中度蛛网膜下腔出血,1 分:极少量血凝块;2 分:中等量蛛网膜下腔出血,但仍可看清血管;(C):重度蛛网膜下腔出血,3 分:大量出血,该部分血管难以辨认。图1 蛛网膜下腔出血Sugawara 评分Note. (A), Six segments of the basal cistern. The subarachnoid blood clots are assessed in each of these segments to allot a score from 0 to 18. 0, No blood.(B), Moderate SAH. 1, Minimal subarachnoid blood. 2, Moderate blood clot with recognizable arteries. (C), Severe SAH. 3, Blood clot obliterating all arteries within the segment.Figure 1 Subarachnoid hemorrhage grading
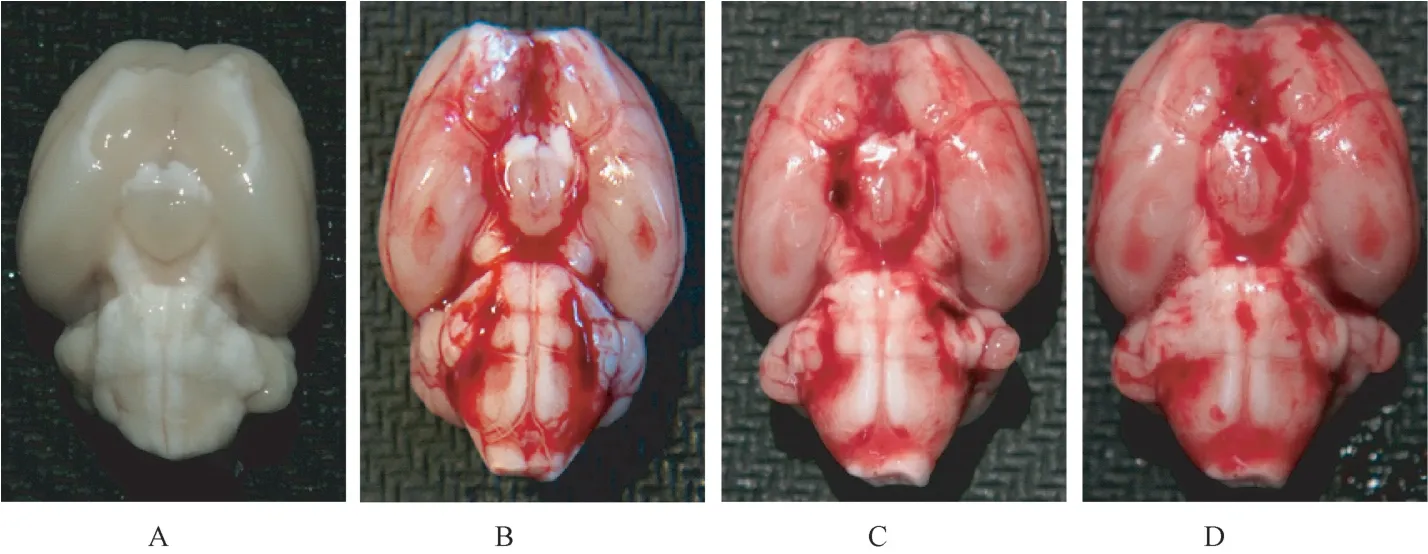
注:A:假手术组;B:模型组;C:GNP 低剂量组;D:GNP 高剂量组。图2 造模后24 h 实验大鼠全脑蛛网膜下腔出血情况Note. A, Sham+vehicle group. B, SAH+vehicle group. C, SAH+GNP low dose group. D, SAH+GNP high dose group.Figure 2 The whole brain of SAH rat model at 24 h
免疫荧光标记染色结果显示,假手术组大鼠大颞叶皮层组织偶见微弱荧光染色,Nrf2 阳性百分率为(0.028 ± 0.031)%。 与假手术组相比,模型组大鼠颞叶皮层Nrf2 阳性细胞数目略有增多,阳性百分率为(21.014 ± 1.828)%,两者有统计学差异(P<0.05)。 与模型组相比,经GNP 干预后Nrf2 阳性细胞数目进一步增加(P<0.05),低剂量组为(47.750± 4.176)%,高剂量组的增加更为显著,为(76.733± 2.949)%。 提示GNP 能促进SAH 后Nrf2 的激活(图3)。
2.3 GNP 对SAH 大鼠模型颞叶皮层MDA 含量的影响
与假手术组相比,模型组大鼠颞叶皮层MDA含量显著增高。 药物干预组虽亦有升高,但较模型组有所降低(P<0.05),且高剂量组升高较少。 提示GNP 能显著减轻SAH 后由MDA 的升高,抑制细胞的氧化损伤(图4)。

注:A:假手术组;B:模型组;C:GNP 低剂量组;D:GNP 高剂量组。图3 GNP 对SAH 大鼠模型颞叶皮层Nrf2 表达的影响(n=6)Note. A,Sham+vehicle group. B,SAH+vehicle group. C, SAH+GNP low dose group. D,SAH+GNP high dose group.Figure 3 Effects of GNP on Nrf2 expression in the temporal cortex of the SAH rat model
2.4 GNP 对SAH 大鼠模型颞叶皮层HO-1、NQO-1、GST 蛋白表达的影响
与假手术组相比,模型组的HO-1、NQO-1、GST蛋白表达均有明显升高(P<0.05)。 与模型组相比,经GNP 处理后HO-1、NQO-1、GST 蛋白的表达进一步增加(P<0.05)。 提示GNP 能显著增强SAH 后由Nrf2 诱导的下游抗氧化酶HO-1、NQO-1、GST 的表达,提高细胞的抗氧化能力(图5)。
2.5 GNP 对SAH 大鼠模型颞叶皮层神经细胞凋亡的影响
造模后24 h,模型组TUNEL 阳性细胞比例明显上升,凋亡率为(50.88 ± 6.22)%,较假手术组(0.00 ± 0.02)%有显著性差异(P<0.05)。 而GNP处理的两组TUNEL 阳性细胞比例较模型组明显下降,且GNP 高剂量组细胞凋亡率为(28.76 ±7.37)%,低于GNP 低剂量组(39.86 ± 8.57)%(P<0.05)。 提示高剂量GNP 能够显著改善SAH 造模后24 h 的神经细胞凋亡(图6)。
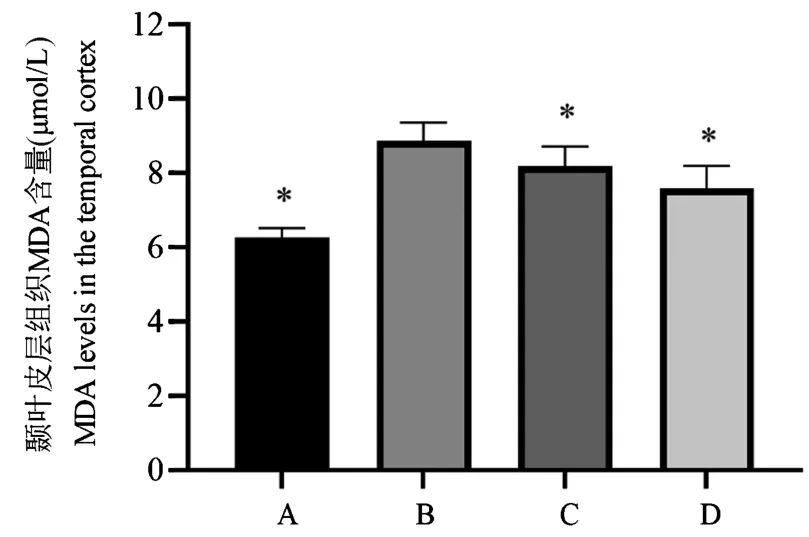
注:A:假手术组; B:模型组; C:GNP 低剂量组; D:GNP 高剂量组。 与模型组相比,*P<0.05。图4 GNP 对SAH 大鼠颞叶皮层丙二醛(MDA)含量的影响(n=6)Note. A,Sham+vehicle group. B,SAH+vehicle group. C,SAH+GNP low dose group. D, SAH+GNP high dose group. Compared with model group,*P<0.05.Fig ure 4 Effects of GNP on malondialdehyde (MDA) contents in the temporal cortex of the SAH rat model
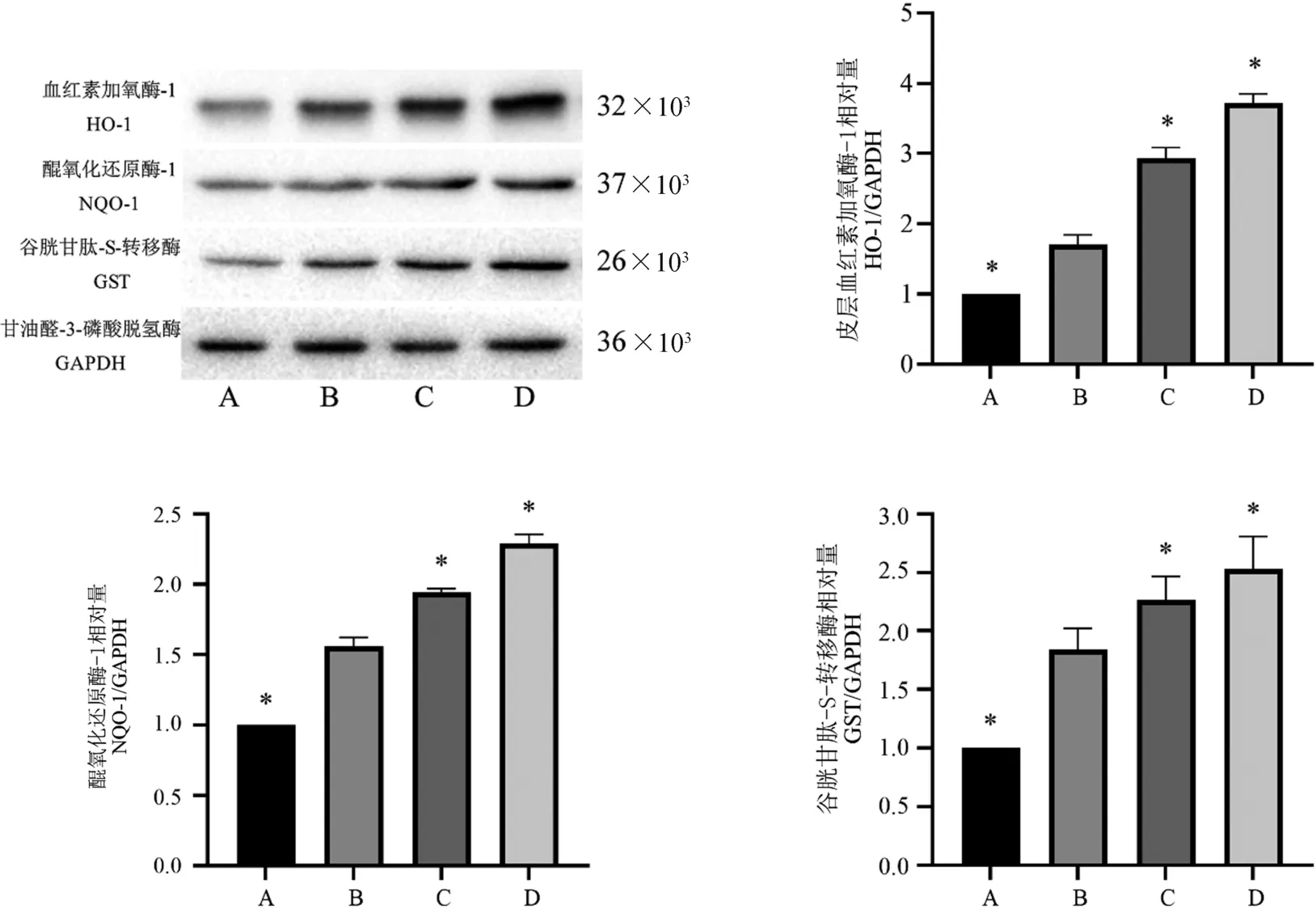
注: A:假手术组; B:模型组; C:GNP 低剂量组; D:GNP 高剂量组。 与模型组相比,*P<0.05。图5 SAH 大鼠模型颞叶皮层组织中HO-1、NQO-1、GST 蛋白表达的相对强度(n=6)Note. A, Sham+vehicle group. B, SAH+vehicle group. C, SAH+GNP low dose group. D, SAH+GNP high dose group.Compared with model group, *P<0.05.Figure 5 Rrelative intensity of HO-1、NQO-1、GST protein expressions of temporal cortex of the SAH rat model

注: A:假手术组;B:模型组;C:GNP 低剂量组;D:GNP 高剂量组。 与模型组相比,*P<0.05。图6 GNP 对SAH 大鼠模型颞叶皮层神经细胞凋亡的影响(n=6)Note. A, Sham+vehicle group. B, SAH+vehicle group. C, SAH+GNP low dose group. D, SAH+GNP high dose group. Compared with model group, *P<0.05.Figure 6 Effects of GNP on TUNEL positive nerve cells in the temporal cortex of the SAH rat model
3 讨论
在EBI 的一系列病理改变中,氧化应激损伤是其中一个重要环节[3]。 在这一阶段,高氧饱和度的动脉血进入蛛网膜下腔刺激脑组织并产生大量活性氧(reactive oxygen species,ROS),造成一系列细胞内容物的严重损伤。 除了造成出血部位邻近脑组织损伤外,还可以引起远隔部位微循环障碍[17],导致全脑细胞缺血缺氧及广泛的神经元去极化损害[18-19]。 该过程中,神经细胞坏死及凋亡会造成血脑屏障的破坏并形成恶性循环,最终导致不可逆的脑组织坏死[20-21]。 另一方面,在各种损伤因素的作用下,作为内源性抗氧化系统的核心调控枢纽,Nrf2通路会被激活并启动下游基因转录,上调多种抗氧化酶的表达,通过负反馈以减轻氧化应激导致的细胞损伤和凋亡[22]。
GNP 是近年被筛选鉴定出来的一种新的胰高血糖素样肽- 1 受体(glucagon-like peptide 1 receptor, GLP-1R)激动剂,具有与GLP-1R 激动剂类似的神经营养和神经保护功能[7]。 并在抗氧化应激、抗内质网应激、抗炎、修复受损的神经细胞、促进神经生长等多个方面表现出良好的疗效[23]。其作用机制与Nrf2 通路的激活及下游抗氧化物质的表达上调密切相关[9]。 在本研究中,给药时间为造模后30 min 给药,目的是研究GNP 对SH 的早期保护效果和机制。 在模型死亡率及神经细胞凋亡情况方面,本研究证实了GNP 虽然不能减少蛛网膜下腔出血的吸收,但可有效减轻SAH 后EBI 情况。研究并通过检测各组大鼠颞叶皮层组织中MDA 水平,Nrf2 及下游抗氧化酶HO-1、NQO-1、GST 的蛋白表达情况,进一步推测GNP 对SAH 后EBI 的神经保护作用是通过Nrf2 通路来进行调节的。
MDA 是作为脂质过氧化后的重要产物,可以反映体内脂质过氧化的程度,间接反映了细胞氧化损伤程度[24]。 本研究中,模型组大鼠颞叶皮层中MDA 含量明显增加,符合SAH 后EBI 改变;但GNP干预后MDA 的含量均有所下降,且GNP 高剂量组下降更为明显,提示GNP 能够减轻SAH 造成的颞叶皮层的氧化损伤。
正常情况下,Nrf2 定位于细胞质中,与胞质结合蛋白(Keap1)相互结合;当机体处于各种应激状态时,Nrf2 与Keap1 解离,转移到细胞核,与Maf 蛋白形成异二聚体;然后该异二聚体再与抗氧化应答元件(ARE)结合,调控Ⅱ相解毒酶和抗氧化酶基因的转录活性,产生直接或间接抗氧化作用[5,25-26]。HO-1 是热休克蛋白中的一种,在正常组织中呈低表达,但在氧化应激状态下会被大量诱导表达,以增加机体抗氧化能力[6]。 NQO1 是一种调节细胞内物质处于氧化还原状态的黄素酶,以NAD(P)H 为受体,对各种代谢引起的氧化应激反应均具有一定的保护作用[27]。 GST 属于超级Ⅱ相解毒酶的基因家族,其催化谷胱甘肽(glutathione hormone,GSH)与底物之间的相互作用,清除有害化学物质并进行解毒,在防治组织损伤方面作用显著[28]。 本研究中,两种剂量的GNP 虽然均不能减少蛛网膜下腔出血的吸收,但都可激活颞叶皮层神经细胞的Nrf2 通路并明显上调下游抗氧化酶HO-1、NQO-1、GST 的蛋白表达,最终减轻神经细胞的凋亡,提示GNP 对SAH 后神经细胞的保护作用与Nrf2 通路的激活存在密切关系。 低剂量的GNP 虽然能减轻细胞凋亡,但并不能减少SAH 对动物模型造成的死亡,仅高剂量治疗能够降低其死亡率百分比,提示GNP 对SAH的治疗作用存在一定的剂量依赖效应。
由于动物来源及条件限制,本研究未能扩展GNP 剂量及时间分层并在Nrf2 基因敲除动物模型中验证GNP 对SAH 的神经保护作用,存在一定的不足。 另外,本研究虽然观察到GNP 高剂量组死亡率百分比有所下降,但并未能得出统计学差异,考虑与实验纳入样本量不足所致。
综上所述,本研究表明,GNP 50 mg/kg 及100 mg/kg 两种治疗剂量在大鼠SAH 造模后24 h 可抑制颞叶皮层的神经细胞凋亡,该效应存在一定的剂量依赖,高剂量治疗并能进一步下降实验动物死亡率,其作用机制可能与通过激活内源性抗氧化系统Nrf2 通路,上调下游抗氧化酶发挥对神经细胞的保护作用密切相关。
