胃肠胰神经内分泌肿瘤同步肝转移的相关因素分析以及预测模型建立*
2021-05-18姚晓萌郑琳琳孙茹梦
姚晓萌 郑琳琳 孙茹梦 周 琳
郑州大学第一附属医院消化内科(450052)
背景:胃肠胰神经内分泌肿瘤(GEP-NEN)是一种罕见的异质性肿瘤,发生肝转移可严重影响其预后。然而预测GEP-NEN同步肝转移的工具较少。目的:探讨GEP-NEN同步肝转移的危险因素及其列线图模型的建立。方法:收集2010年1月—2017年12月SEER数据库中经病理检查确诊的10 973例GEP-NEN患者的临床资料,将其随机分为建模组(n=7 511)和验证组(n=3 462)。两组根据有无肝转移分为肝转移组和未转移组。采用多因素logistic回归分析评估GEP-NEN肝转移的危险因素。用R软件进行GEP-NEN患者肝转移风险列线图的绘制和验证。结果:GEP-NEN患者肝转移与性别、年龄、种族、肿瘤原发部位、分化程度、肿瘤直径、T分期、淋巴结转移有关。多因素logistic回归分析结果显示肿瘤原发部位为小肠和胰腺、分化程度为低分化和未分化、肿瘤直径≥5 cm、T3/4分期和淋巴结转移均是影响GEP-NEN患者肝转移的独立危险因素(P<0.001)。列线图的内部验证一致性指数为0.838(95% CI: 0.826~0.849),外部验证一致性指数为0.847(95% CI: 0.829~0.864)。结论:肿瘤原发部位为小肠和胰腺、分化程度为低分化和未分化、肿瘤直径≥5 cm、T3/4分期和淋巴结转移是影响GEP-NEN患者肝转移的独立危险因素,提示此类患者需警惕肝转移的发生并采取更积极的治疗。建模组和验证组的校准曲线拟合度均较好,具有良好的预测能力,有助于临床医师为GEP-NEN患者初诊时是否具有同步肝转移作出个体化预测。
神经内分泌肿瘤(neuroendocrine neoplasm, NEN)是一种起源于肽能神经元和神经内分泌细胞的具有神经内分泌功能的高度异质性肿瘤。NEN可见于存在肽能神经元和神经内分泌细胞的全身多个器官系统,其中以胃、肠、胰腺最为多见。近年胃肠胰神经内分泌肿瘤(gastroenteropancreatic neuroendocrine neoplasm, GEP-NEN)的发病率呈上升的趋势[1-2]。因其临床症状不典型,就诊时间晚,诊断时往往已发生了远处转移,其中肝脏是其最常见的转移部位[3-4]。目前关于GEP-NEN发生肝转移危险因素的研究尚不多见。本研究通过探讨GEP-NEN发生同步肝转移的危险因素,并在此基础上进一步建立预测GEP-NEN发生同步肝转移风险的列线图,旨在对GEP-NEN患者初诊时是否伴有同步肝转移作出个体化预测,从而指导临床实践。
对象与方法
一、研究对象
收集2010年1月—2017年12月SEER数据库中经病理检查确诊的GEP-NEN患者的临床资料和随访数据。纳入标准:①患者年龄>19岁;②GEP-NEN是其唯一的原发性肿瘤;③死亡患者的原因为GEP-NEN而非其他原因;④随访和临床资料完整。排除标准:①患者年龄≤19岁;②仅经尸检和死亡证明确诊的病例;③具有多发性原发性肿瘤或GEP-NEN并不是其唯一原发性肿瘤的患者;④死亡患者并非因GEP-NEN死亡;⑤随访和临床资料不完整者。
二、方法
将入选的患者随机分为建模组和验证组,然后根据是否发生肝转移,进一步将患者分为肝转移组和未转移组,比较两组的临床病理特征,并分析GEP-NEN发生肝转移的危险因素。绘制列线图并进行内部和外部的验证。
三、统计学分析
采用26.0 SPSS统计学软件。计数资料的比较采用t检验,分类资料的比较采用χ2检验和Wilcoxon秩和检验。采用多因素Logistic回归分析评估GEP-NEN肝转移的独立危险因素。用R软件进行列线图的绘制。通过建模组和验证组的一致性指数和校准曲线进行内外部验证。P<0.05为差异有统计学意义。
结 果
一、一般资料
建模组共纳入7 511例GEP-NEN患者,其中男3 676例,女3 835例;年龄20~85岁,平均57.2岁;838例发生肝转移,6 673例未发生肝转移。肝转移组和未转移组患者的性别、年龄、种族、肿瘤原发部位、分化程度、肿瘤直径、T分期、淋巴结转移等相比差异均有统计学意义(P均<0.05;表1)。

表1 建模组肝转移组和未转移组的GEP-NEN患者临床病理特征n(%)
二、GEP-NEN患者肝转移的多因素分析
多因素logistic回归分析结果显示肿瘤原发部位位于小肠和胰腺、低分化和未分化、肿瘤直径≥5 cm、T3/4分期和淋巴结转移均为GEP-NEN患者肝转移的危险因素(P均<0.05;表2)。
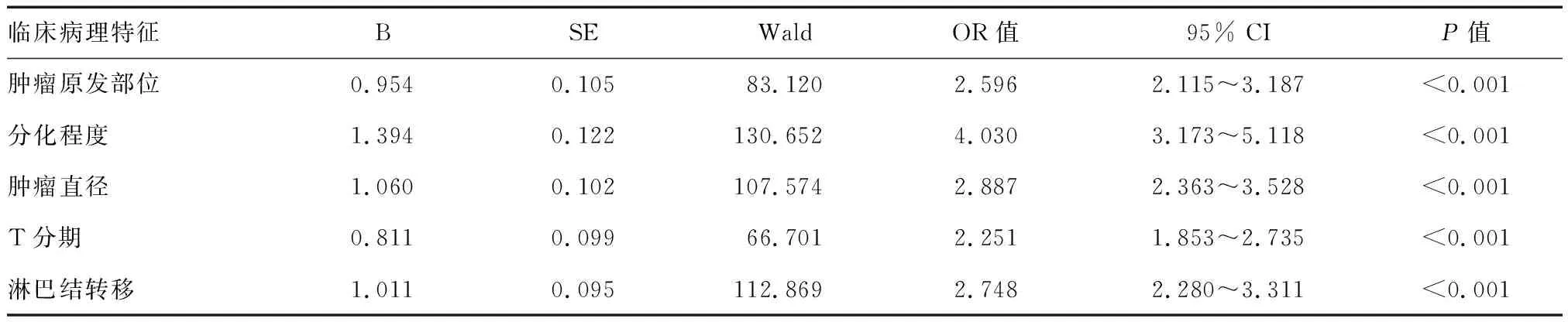
表2 GEP-NEN患者发生肝转移的多因素Logistic回归分析结果
三、GEP-NEN患者肝转移列线图的绘制以及内部验证
利用多因素logistic回归分析结果的5个独立危险因素建立GEP-NEN患者初诊时发生同步肝转移的列线图(图1)。内部验证一致性指数为0.838(95% CI:0.826~0.849),说明预测与实际发生肝转移风险一致性的校准曲线拟合度较好(图2)。
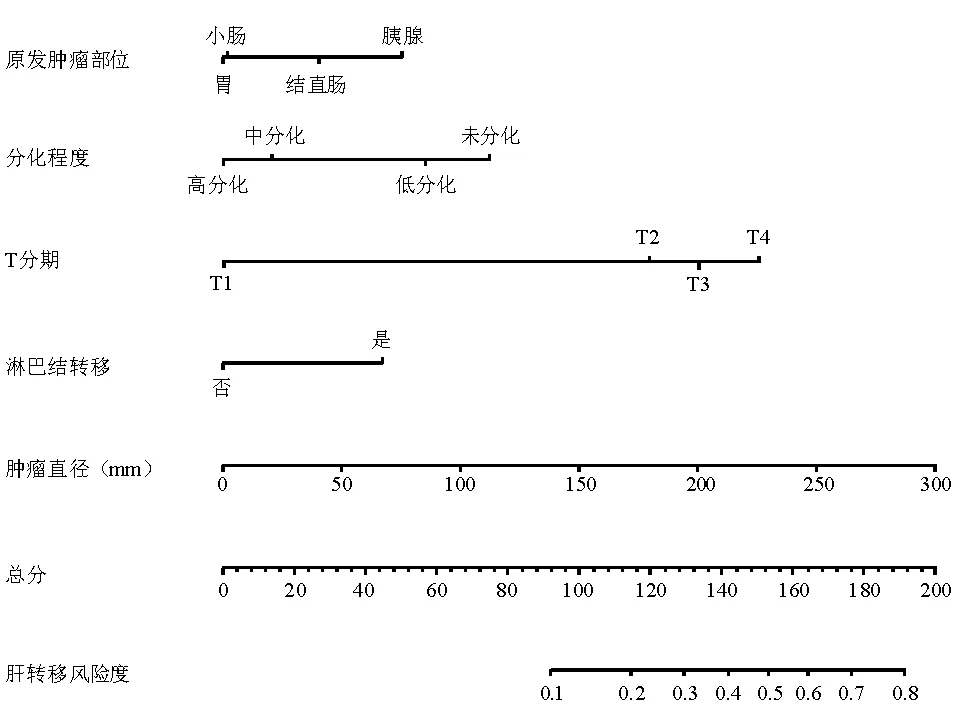
图1 GEP-NEN患者发生肝转移风险的列线图

图2 GEP-NEN患者肝转移风险内部验证校准曲线图
四、GEP-NEN患者肝转移列线图的外部验证
验证组共纳入3 462例患者,其中男1 686例,女1 776例;年龄20~85岁,平均56.4岁;346例发生肝转移,3 116例未发生肝转移。与未转移组相比,肝转移组患者原发肿瘤部位为小肠和胰腺、分化程度为低分化和未分化、肿瘤直径≥5 cm、T3/4分期、淋巴结转移所占的比例均更高(P均<0.05;表3)。以验证组患者对列线图模型进行外部验证,一致性指数为0.847(95% CI:0.829~0.864),说明预测模型具有较好的区分度,预测与实际发生肝转移风险一致性的校准曲线拟合度较好(图3)。

表3 验证组肝转移组和未转移组的GEP-NEN患者临床病理特征n(%)

图3 GEP-NEN患者肝转移风险外部验证校准曲线图
五、GEP-NEN肝转移患者的预后
在10 973例GEP-NEN患者中,肝转移组和未转移组患者中位生存时间分别为27、43个月(χ2=1 139.656,P<0.05)。原发于小肠、胰腺、胃和结直肠的GEP-NEN肝转移患者的中位生存时间分别为42、23、13、10个月(χ2=282.576,P<0.05)。
讨 论
远处转移是影响GEP-NEN患者预后的主要因素[5-7]。肝脏是NEN最常见的转移部位,约占转移患者的82%[4]。据报道,10.3%~12.1%的GEP-NEN患者初诊时已发生肝转移[8-10]。本研究中,建模组和验证组GEP-NEN患者肝转移发生率分别为11.2%和10.0%。肝转移严重影响GEP-NEN患者的预后[11]。早期鉴别初诊时同步肝转移风险较高的GEP-NEN患者有助于改善其预后。然而,目前尚缺乏GEP-NEN患者初诊时同步肝转移的预测评估工具。故本研究基于SEER数据库,采用多因素logistic回归分析探讨GEP-NEN同步肝转移的危险因素,从而建立GEP-NEN患者发生同步肝转移风险的列线图,为GEP-NEN患者初诊时是否发生肝转移提供个体化预测。
本研究发现,肝转移和未转移GEP-NEN患者的临床病理特征具有较大的差异。肝转移GEP-NEN患者以男性多见,总体分化程度更差,具有更大的肿瘤直径、更高的T分期、更高的淋巴结转移率。这与既往文献报道的研究结果一致[8]。本研究结果表明,肿瘤原发部位为小肠和胰腺、分化程度为低分化和未分化、肿瘤直径≥5 cm、较高的T分期和淋巴结转移的GEP-NEN患者易发生同步肝转移。NEN根据分化程度可分为分化好的神经内分泌瘤(neuroendocrine tumor, NET)和分化差的神经内分泌癌(neuroendocrine carcinoma, NEC),两者在病理特征、临床表现和预后转归等方面具有显著差异[12]。低分化和未分化表明肿瘤具有更高的异质性和更强的侵袭能力[13],因此分化程度较低的GEP-NEN患者更易发生同步肝转移。肿瘤直径在一定程度上代表了肿瘤负荷,而T分期和淋巴结转移可反映肿瘤进展程度。本研究发现,肿瘤直径≥5 cm者的肝转移风险为肿瘤直径<5 cm患者的2.887倍(95% CI: 2.363~3.528,P<0.001)。此外,T3/4期患者肝转移风险为T1/2期者的2.251倍(95% CI: 1.853~2.735,P<0.001)。淋巴结转移组肝转移风险为淋巴结未转移组的2.748倍(95% CI: 2.280~3.311,P<0.001)。由此可见,更大的肿瘤直径、更高的T分期和淋巴结转移患者更容易发生肝转移。
不同肿瘤原发部位的GEP-NEN患者肝转移的发生率并不相同。日本一项全国性GEP-NEN流行病学调查显示,23.2%的胰腺NEN在诊断时已发生远处转移,其中包括肝转移[14]。欧洲一项关于NEN转移情况的流行病学调查显示,在所有的肝转移患者中,最常见的原发肿瘤部位为小肠,占所有肝转移患者的56%[4]。本研究中,肿瘤原发部位为小肠和胰腺的GEP-NEN患者肝转移比例最高,分别为43.2%和28.6%。因此,对于疑诊为肝转移性NEN患者,应特别警惕肿瘤原发部位为胰腺和小肠。
肿瘤原发部位对于GEP-NEN肝转移患者的预后亦有影响[15]。国外一项关于GEP-NEN肝转移患者的研究[16]显示,小肠NEN的预后最佳,其长期生存率高于胰腺NEN和胃NEN。本研究中,原发于小肠、胰腺、胃和结直肠的肝转移患者的中位生存时间分别为42、23、13、10个月(P<0.05)。说明原发肿瘤部位位于胃和结直肠的GEP-NEN肝转移患者预后较差,而原发肿瘤部位位于小肠和胰腺的GEP-NEN肝转移患者预后较好。可能的原因是胰腺是功能性GEP-NEN的最好发部位,其可分泌功能不同的激素表现为特异性综合征从而易被早期诊断和治疗[1,6]。小肠NEN尤其是肝转移的小肠NEN多表现为类癌综合征的特征性表现,也易早期诊断和治疗[16]。而胃NEN和结直肠NEN多为无功能性NEN,临床表现不典型,易被误诊,多由胃肠镜检查时偶然发现,丧失早期治疗的机会,且胃NEN和结直肠NEN初诊时淋巴结转移率较高[15]。因此,对于高危人群,尤其是具有不典型临床表现的老年患者,定期胃肠镜检查是早期发现和诊治胃NEN和结直肠NEN的关键所在。
手术是GEP-NEN肝转移患者的首选治疗方式。研究表明,切除原发肿瘤可延长GEP-NEN肝转移患者的总体生存率[16-17]。切除原发肿瘤可减少肿瘤负荷,延缓病情,从而提高患者的生存率。因此,对于无明显手术禁忌证的GEP-NEN肝转移患者,制定治疗方案时应充分考虑切除原发部位肿瘤。
为验证列线图的有效性和临床实用性,本研究对其进行了内部验证和外部验证,用C指数和校准曲线来验证列线图的预测和判别能力。结果显示内部验证C指数为0.838(95% CI: 0.826~0.849),校准曲线拟合度较好。外部验证C指数为0.847(95% CI: 0.829~0.864),校准曲线的拟合程度较高。说明列线图模型的可靠性和可重复性较好。
本研究具有一定的局限性。首先,本研究是一个回顾性研究,未具备完整临床病理资料的患者被排除在外,这可能导致研究出现偏差。其次,由于NEN的高度异质性,不同组织来源、不同亚型的NEN肝转移率差异较大。但因SEER数据库的局限性,未能按不同组织来源的不同亚型对NEN肝转移风险进行分析,这有待在今后的工作中进一步完善。最后,本研究构建的列线图模型仅适用于GEP-NEN患者初诊时同步肝转移的风险预测。然而约38%的患者在随访期间出现肝转移[18]。本研究对于在初次诊断后疾病发展过程中肝转移情况未进行分析,因此对于GEP-NEN异时肝转移的风险预测需行进一步的研究和探讨。
综上所述,本研究构建了GEP-NEN患者同步肝转移的风险列线图,可作为识别GEP-NEN患者初诊时肝转移的一种优良的工具,经内部和外部验证其具有良好的预测能力和判别能力。该列线图有助于临床医师早期对GEP-NEN患者是否具有同步肝转移作出准确的个体化预测,识别肝转移风险较高者,有助于早期诊断和规范治疗,从而改善GEP-NEN肝转移患者的生存和预后。
