血清肝再生磷酸酶-3鉴别诊断高、低级别浆液性卵巢癌价值
2021-05-17邹春玲王黎明沈晓萍
邹春玲 王黎明 沈晓萍
1.山东省龙口市人民医院(265701);2.上海交通大学医学院附属新华医院崇明分院
浆液性卵巢癌是卵巢癌最常见的恶性肿瘤类型,临床上常将其分为高、低级别浆液性卵巢癌,二者在形态学、组织学改变以及临床治疗与预后等方面均存在较大差异[1]。低级别浆液性卵巢癌发展缓慢,预后良好;高级别浆液性卵巢癌进展迅速侵袭性强,预后较差[2-3]。因此,术前准确鉴别对治疗及预后有重要临床意义。但在临床诊断中,因不同级别的肿瘤可能存在组织学形态的交叉和重叠,增加了临床实践难度。因此,亟需寻找有效诊断浆液性卵巢癌的生物标志物,准确鉴别高、低级别浆液性卵巢癌,为临床确定治疗方案提供依据。肝再生磷酸酶-3(PRL-3)在晚期卵巢癌中的表达水平明显高于早期卵巢癌,与卵巢癌的发生发展有关[4]。基于此,本研究探讨血清PRL-3对高、低级别浆液性卵巢癌的鉴别价值,为术前鉴别两种卵巢癌提供依据。
1 资料与方法
1.1 一般资料
选取2015年3月—2019年1月本院接受手术治疗的浆液性卵巢癌患者106例作为观察组,按美国M.D.Anderson肿瘤中心提出的分级系统[5],将患者分为低级别45例(低级别组),高级别61例(高级别组)。另选取同期本院行常规体检的健康女性98例为对照组。纳入标准:①术后病理切片确认为浆液性卵巢癌;②术前3个月未进行放疗或化疗;③临床病理资料完整。排除标准:①合并其他恶性肿瘤;②合并患有心脏、肝、肾等疾病;③合并自身免疫疾病。本研究经医院伦理委员会审批。
1.2 检测方法
采集患者晨空腹静脉血抗凝离心,取血清-20℃保存。采用实时荧光定量PCR(qRT-PCR)仪检测血清PRL-3表达量。总RNA提取:从-20℃取出血清样本,Trizol试剂(日本TaKaRa公司)提取血清总RNA,异丙醇沉淀浓缩后75%酒精洗涤,干燥后加入100μl DEPC水,变性凝胶电泳检测总RNA完整度,紫外分光光度计检测所得RNA浓度。逆转录反应:取所得总RNA 2μg,按照逆转录试剂盒(北京天根生化有限公司)说明书将RNA逆转录为cDNA,-20℃保存。qRT-PCR反应(反应体系20μl):取cDNA模板2μl,10μl 2×SYBR Green PCR Master Mix,上下游引物各1 μl,DEPC水6μl,每个样本设置3个平行。根据目的基因设计相应上下游引物,以GAPDH为内参,序列见表1。qRT-PCR反应条件:95℃ 30s;95℃ 10 s、60℃ 30 s,45个循环,qRT-PCR仪(赛默飞世尔科技中国有限公司)反应。根据各样本平均Ct值,采用2-ΔΔCt法计算PRL-3相对表达量。
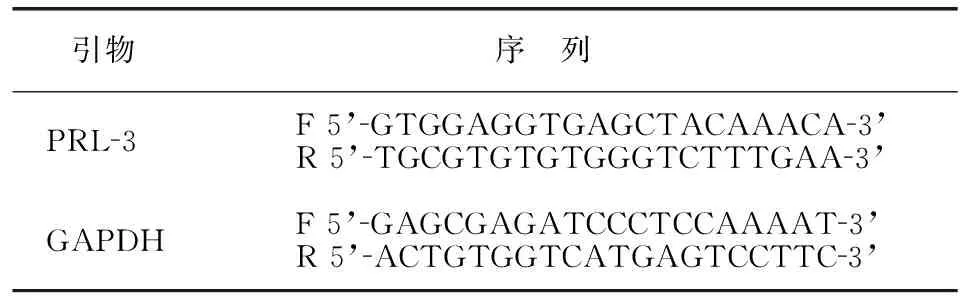
表1 PRL-3及内参基因GAPDH引物序列
1.3 统计学方法
2 结果
2.1 一般资料比较
高级别组、低级别组、对照组年龄、体质指数(BMI)、患糖尿病及高血压比例均无差异(P>0.05),高级别组FIGO分期[6]为Ⅲ-Ⅳ期患者比例高于低级别组(P<0.05)。见表2。
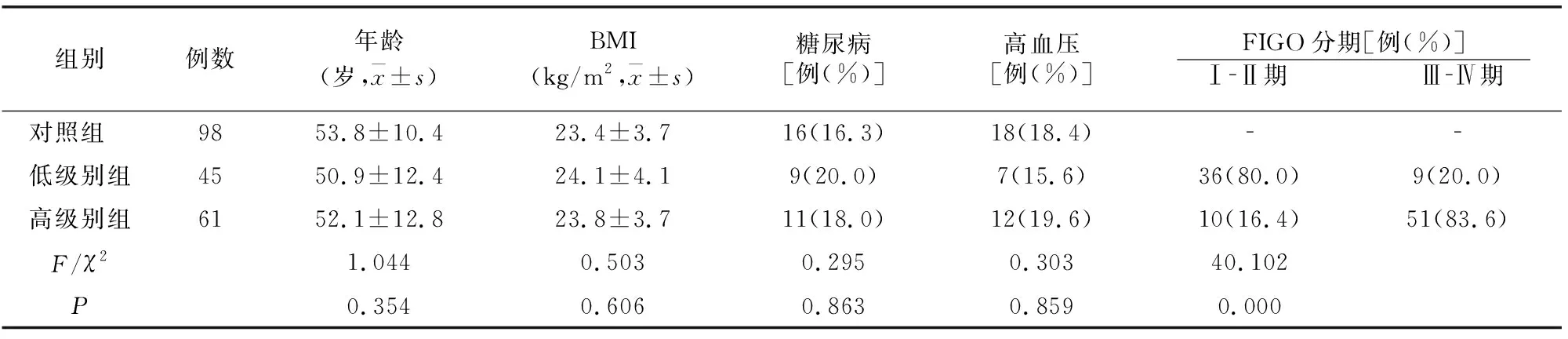
表2 各组一般资料比较
2.2 血清PRL-3 mRNA表达量比较
血清中PRL-3表达水平高级别组最高(2.61±0.72),低级别组次之(1.39±0.69),对照组最低(1.16±0.43)(P<0.001)。
2.3 不同FIGO分期患者血清PRL-3表达量比较
血清PRL-3 mRNA表达量,低级别组中Ⅰ~Ⅱ期患者(1.31±0.62)与Ⅲ~Ⅳ期患者(1.68±0.51)比较无差异(t=1.652,P=0.106),高级别组中Ⅰ~Ⅱ期患者(2.32±0.58)与Ⅲ~Ⅳ期患者(2.67±0.69)比较也无差异(t=1.501,P=0.139)。
2.4 血清PRL-3诊断高、低级别浆液性卵巢癌价值
以血清PRL-3水平为检测变量绘制ROC曲线,诊断高、低级别浆液性卵巢癌的ROC曲线下面积为0.887(95%CI:0.811~0.940),截断值为1.95,灵敏度为90.2%,特异性为77.8%。见图1。

图1 血清PRL-3诊断高、低级别浆液性卵巢癌的ROC曲线
3 讨论
浆液性卵巢癌是临床常见的卵巢癌,早期诊断困难,其中高级别浆液性卵巢癌预后差,低级别浆液性卵巢癌预后较好[7]。血清PRL-3是一种蛋白质酪氨酸磷酸酶,在卵巢癌患者中呈高表达,敲除PRL-3基因发现,其可参与卵巢癌的肿瘤发生及恶性表型的维持[8]。PRL-3可促进癌细胞上皮间质转化,提高癌细胞的侵袭、迁移能力,并能作用于下游蛋白或酶来调控多条信号通路,从而影响癌细胞的增殖和凋亡[9]。研究表明,PRL-3可通过抑制PTEN表达激活PI3K-AKT信号传导,从而导致上皮间质转化,而上皮间质转化是癌变过程中癌细胞入侵的关键步骤[10]。Zhang等[11]研究发现,PRL-3与Ⅱa类组蛋白脱乙酰基酶4(HDAC4)竞争性结合,导致HDAC4与心肌细胞增强因子2A(MEF2A)和组蛋白分离,乙酰化的MEF2A进而与性别决定相关基因簇2(SOX2)启动子区域结合,促进SOX2表达,从而诱导卵巢癌细胞转化为肿瘤干细胞。Liu等[12]研究结果显示,PRL-3在卵巢癌中表达水平升高,敲除PRL-3基因能抑制卵巢癌细胞株A2780生长,推测PRL-3可通过抑制c-fos转录,参与调节整合素α2的信号通路,从而参与浆液性卵巢癌的转移。本研究结果显示,浆液性卵巢癌患者血清PRL-3表达水平明显高于对照组,且高级别患者表达量高于低级别患者,表明血清PRL-3在浆液性卵巢癌中高表达,且随着癌症进展而不断升高。原因可能是PRL-3可通过调控多种信号通路,影响卵巢癌细胞的增殖和凋亡,并诱导卵巢癌细胞向肿瘤干细胞转化,从而参与浆液性卵巢癌的发生发展。本研究高、低级别浆液性卵巢癌Ⅰ-Ⅱ期、Ⅲ-Ⅳ期患者间均未见差异,提示FIGO分期对血清PRL-3表达量影响不大。既往研究表明,PRL-3-HDAC4-MEF2A / histones-SOX2信号转导轴可能是抑制卵巢癌转移和复发的潜在治疗靶标,PRL-3在卵巢癌的发生发展中发挥重要作用[11]。PRL-3可成为浆液性卵巢癌的潜在生物标志物。因此本研究探讨了PRL-3对浆液性卵巢癌的诊断价值,结果显示血清PRL-3水平诊断高、低级别浆液性卵巢癌的AUC为0.887,截断值为1.95,灵敏度为90.2%,特异性为77.8%,提示PRL-3水平对高、低级别浆液性卵巢癌具有一定的诊断价值。PRL-3已被证明参与了多种肿瘤发生发展的环节,目前已针对PRL-3为癌症治疗靶点展开了广泛研究。本研究结果显示PRL-3在卵巢癌中特异性表达且具有一定诊断价值,提示PRL-3有望成为浆液性卵巢癌的靶向治疗位点,针对不同级别患者采用不同治疗方案,以期取得更好的临床疗效。
综上所述,浆液性卵巢癌患者血清中PRL-3表达上调,且高级别患者表达量高于低级别患者,PRL-3对高、低级别浆液性卵巢癌有一定诊断价值。但由于本研究样本量少,结果可能具有局限性,尚需扩大样本量进一步验证PRL-3在临床诊断及治疗中的应用价值。
