子宫颈癌及病变中信号通路Shh蛋白与p-STAT3的表达及临床意义
2021-05-17郭灵敏李林株杜佩铭区承昌
郭灵敏 ,林 芳,李林株,杜佩铭,区承昌
(佛山市高明区人民医院:1.病理科;2.妇产科,广东 佛山 528500)
宫颈癌是人类女性中高发的一种癌症,发病率和死亡率仅低于乳腺癌,近些年频发且有年轻化趋向[1],很多患者在就医时已确诊为浸润癌,因而在上皮内病变和早癌时期发现并治疗便显得尤为重要。一般情况认为宫颈癌变过程与高危型人乳头状瘤病毒(HR-HPV)相关,但单发因素不足以引起癌变,目前宫颈癌发病的病理尚未明确,因此对其分子机制的研究极其重要。Hedgehog(HH)是经典的胚胎发育信号通路,有报道该通路多种因子在胃、肺及胰腺等部位癌组织中有异常活化和表达,该通路的激活对肿瘤的增殖与分化起重要作用。信号转导和转录激活因子-3(STAT3)为一种癌基因[2],其过度活化与多种癌症的产生、发展及预后密切相关。目前国内外尚缺乏关于HH通路、p-STAT3蛋白同时在宫颈鳞癌的研究。本实验用免疫组织化学(免疫组化)标记刺猬蛋白(Shh)及p-STAT3在宫颈组织不同病变中的表达,并分析宫颈鳞癌与临床各因素的关系,为治疗和预后预测提供新的病理评估依据。
1 资料与方法
1.1资料
1.1.1一般资料 选取2015年1月至2018年12月病历齐全的宫颈鳞状细胞癌(SCC)患者标本45例(SCC组)、高级别鳞状上皮内病变(HSIL)患者标本35例(HSIL组)、低级别鳞状上皮内病变(LSIL)患者标本35例(LSIL组),并将因非肿瘤性疾病而子宫全切患者的正常宫颈组织(NC)30例作为对照组。SCC组45例患者术前均未进行放化疗,并经病理确诊,年龄28~77岁,平均(47.56±11.24)岁;淋巴转移17例,无淋巴转移28例;临床分期采用FIGO方案,Ⅰ~Ⅱ期24例,Ⅲ~Ⅳ期21例;病理组织类型:均为鳞状细胞癌;病理分级:Ⅰ级15例,Ⅱ级18例,Ⅲ级12例。各组患者一般情况比较,差异无统计学意义(P>0.05),具有可比性。
1.1.2纳入和排除标准 纳入标准:(1)以《2019年NCCN宫颈癌临床实践指南(第1版)》[3]为参考,术前经阴道镜活检或术中冰冻诊断为SCC,且经根治术后病理诊断一致;(2)研究经本院医学伦理委员会批准,患者均签署知情同意书。排除标准:(1)患者术前已进行放疗或化疗;(2)患者仅宫颈脱落细胞学诊断无术后诊断;(3)未行根治手术患者的标本;(4)病历不完整者。
1.2方法
1.2.1标本处理 所有标本组织均通过10%甲醛固定、石蜡包埋、连续4 μm切片后进行免疫组化En-Vision两步法染色,流程按商品规范进行,脱蜡水化、柠檬酸盐缓冲液(pH 9.0)高温高压热修复,3%过氧化氢阻断剂阻断内源性过氧化物酶,DAB显色,苏木素复染,树胶封片。一抗均购自Santa Cruz biotechnology公司,分别是兔抗人单克隆抗体Shh、兔抗人单克隆抗体p-STAT3,适用稀释浓度1∶100,DAB显色剂及En-Vision法试剂盒购于丹麦Dako公司。均使用试剂盒提供的阳性组织作为阳性对照,以PBS缓冲液替代一抗作阴性对照。
1.2.2判定标准 Shh以细胞质呈棕黄或棕褐色判定为阳性,p-STAT3以细胞核呈棕黄或棕褐色判定为阳性。观察10个有代表性的高倍(400×)视野计1 000个肿瘤细胞,计算平均阳性率,利用双评分半定量计分法判断染色情况[4]:以大部分细胞显示的染色状态为指标对着色程度评分,无色为0分,浅黄色记1分,棕黄色记2分,棕褐色记3分;阳性细胞数百分比小于或等于5%记0分,>5%~25%记1分,>25%~50%记2分,>50%记3分。两积分相乘,0分为阴性(-),1~3分为弱阳性(+),>3~5 分中度阳性(++),>5分为强阳性(+++)。

2 结 果
2.1Shh、p-STAT3在宫颈不同病变中的表达特点及差异 Shh及p-STATA3在NC组织中阴性表达或偶尔弱阳性表达,各组Shh及p-STATA3的阳性表达率分别为:NC组3.3%和16.7%,LSIL组28.6%和20.0%,HSIL组37.1%和60.0%,SCC组71.1%和64.4%,随着肿瘤的进展,2种蛋白的阳性表达率和表达强度均增加。Shh在各组间阳性表达率比较,差异有统计学意义(χ2=37.321,P<0.05);LSIL组与SCC组间、HSIL组与SCC组间Shh阳性表达率比较,差异均有统计学意义(P<0.05);而LSIL组与HSIL组间Shh阳性表达率比较,差异无统计学意义(P>0.05)。p-STAT3在各组间阳性表达率比较,差异有统计学意义(χ2=28.648,P<0.05);LSIL组与SCC组间、HSIL组与LSIL组间p-STAT3阳性表达率比较,差异均有统计学意义(P<0.05),而LSIL组与NC组间、HSIL组与SCC组间p-STAT3阳性表达率比较,差异均无统计学意义(P>0.05)。见表1。
2.2Shh、p-STAT3与宫颈癌临床因素的关系 Shh、p-STAT3的表达与患者的临床分期、肿瘤分化程度及淋巴结转移有关(P<0.05)。随着分级分期的增加两者表达递增,且表达增强,即与鳞癌的病变进展相关,而与患者的年龄、肿瘤大小无相关性(P>0.05)见表2。

表1 Shh、p-STAT3在宫颈不同病变中的表达比较
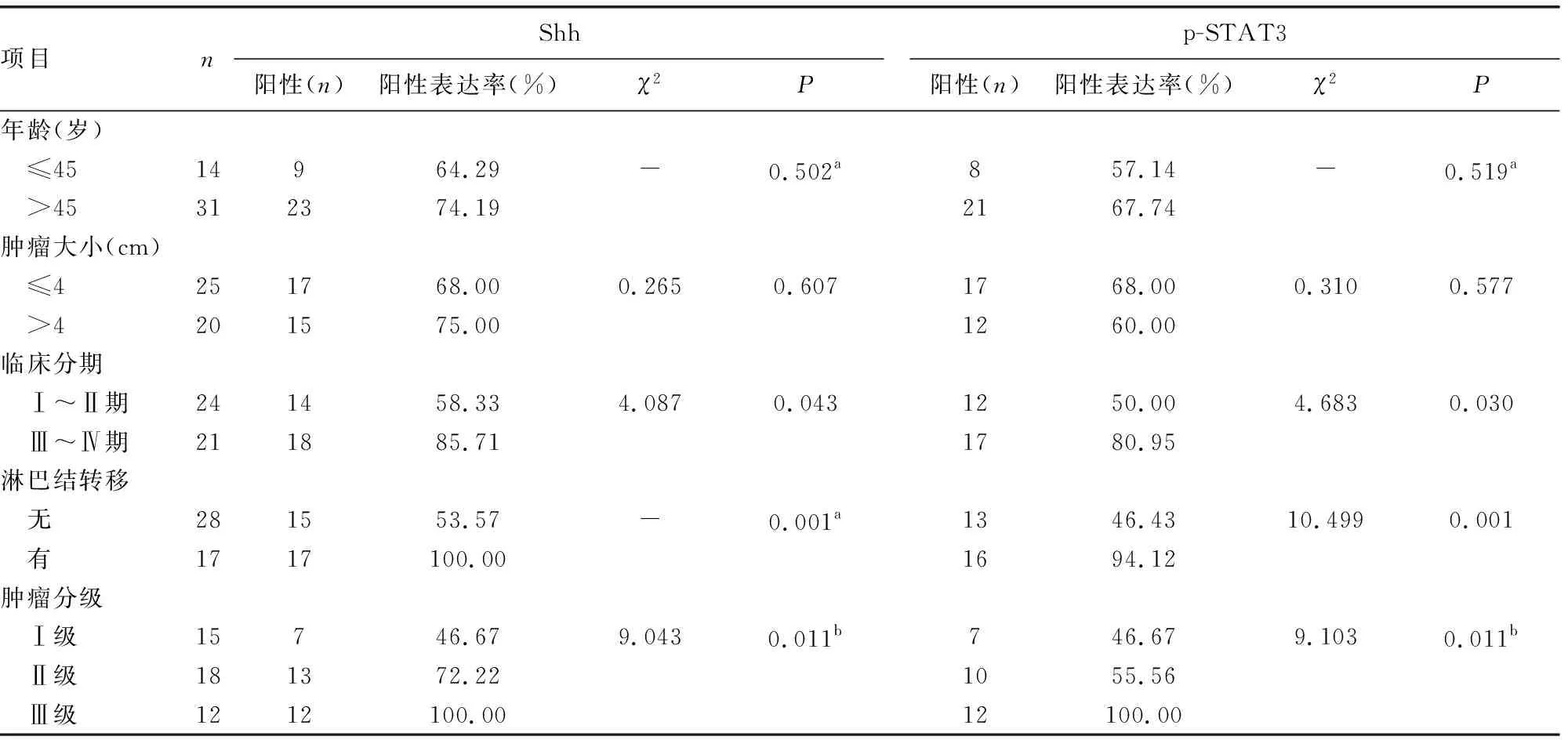
表2 Shh、p-STAT3与宫颈癌临床因素的关系
2.3宫颈癌/病变Shh、p-STAT3表达的相关性 经Spearman相关分析,SCC组中,Shh、p-STAT3表达呈正相关[相关系数(r)=0.448,P=0.002)],见表3。在HSIL组中,Shh、p-STAT3表达呈正相关(r=0.386,P=0.022);而在LSIL组中,Shh、p-STAT3表达无相关性(r=0.316,P=0.064)。
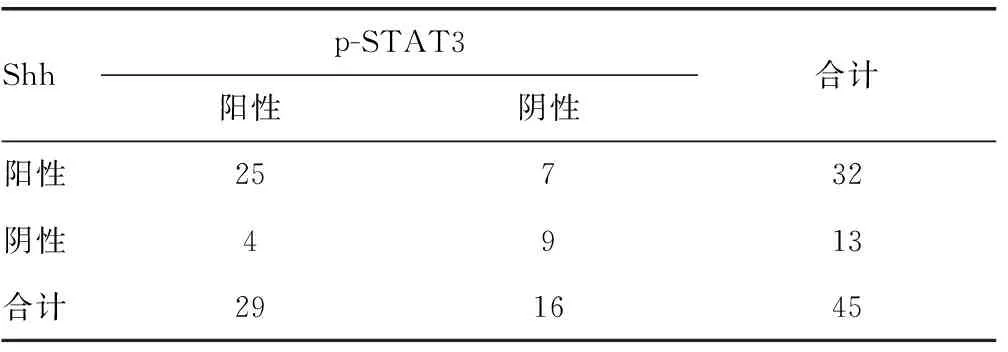
表3 宫颈癌/病变Shh与p-STAT3表达的相关性(n)
3 讨 论
近年来,宫颈癌发病率一直增长,已位居女性癌症中发病率第2位,且患者多为鳞癌(占75%~80%),发病诱因包括HPV病毒感染、免疫低下紊乱等因素。作为一种涉及肿瘤基因激活且抑癌基因失活的疾病[5],染色体突变、缺损与信使蛋白的异常表达在宫颈鳞癌的产生、进展及侵犯转移中起着不可或缺的作用。宫颈鳞癌是由宫颈鳞状上皮内病变发展而来,从感染病毒到癌时间跨度可有10年,虽然细胞学、HPV病毒等初筛手段的广泛运用,极大地减少了宫颈癌的发生,但因为对鳞状上皮的癌性增生缺少分子级的研究,很多患者在入院时已确诊为癌症,且出院后即便进行综合性治疗,5年生存率不到40%,复发率和转移率也高[6]。因此,早发现宫颈上皮内病变甚至早期鳞癌对增加患者存活率意义重大。
近年来发现,一些信号通路不仅在胚胎细胞发育、组织分化中起重要作用,也调控着肿瘤的产生和进展,CARBALLO等[7]研究显示,激活的HH通路不仅在组织的发育中起重要作用,还与多种癌症的产生及进展有密切关系。HH基因在1980年被发现,其具有表面突起的特征而称为“刺猬蛋白”。HH成员包含Sonic Hedgehog(SHh)、Desert Hedgehog(DHh)及Indian Hedgehog(IHh),其中SHh是最类似人基因组的,且生物学意义最重要,Shh是SHh通路中一个重要启动基因,通过编码Shh配体,与靶细胞膜上的Ptch转录元件结合,促使Smo激活下游基因Gli,活化的Gli进入胞核激活目的基因而发挥作用,因而Shh蛋白的增多可作为Shh通路活化的标识。BENESCH等[8]认为在分化成熟的宫颈上皮中,Shh在维持宫颈的内环境稳态有重要作用。已有多项研究表明Shh异常激活能导致多类肿瘤的产生,如前列腺癌、肺癌、神经胶质瘤、胃肠胰腺肿瘤等[9],并且发现其在不同组织中的活化机制也不一致,比如Shh配体表达增多,Ptch、Smo基因突变等[10]。其他研究也发现Shh的活化可同时激活目标基因血管内皮生长因子(VEGF)等,促进脉管生成,加快肿瘤生长、侵犯和转移[11]。本研究探讨了Shh在鳞状细胞癌发展当中的变化过程,发现正常上皮基本阴性或偶尔表达,而其在SIL、SCC中的阳性率递增,阳性强度也更明显,差异有统计学意义(P<0.05),提示Shh的过度激活是鳞癌发病过程中的早期改变,支持上皮内病变与癌为连续病变过程的同一疾病。Shh与宫颈鳞癌的临床进展呈正相关,特别是FIGO分期高、分级高和伴有淋巴转移的情况,说明随着病变进展,Shh表达上调且预后不良。
酪氨酸激酶STATs是人体又一条重要的信号通路,STAT3一开始是研究细胞内信号转导与干扰素的关系时被发现的[12],作为STATs中的重要部分,接受来自上游的生物活性因子或其他多肽配体活化,发生酪氨酸磷酸化以二聚体状态进入细胞核与目标基因的启动子结合,从而调节下游蛋白如B淋巴细胞癌-2基因、细胞周期蛋白D1、VEGF等的表达[13]。正常情况下激活会在短时间内脱磷酸化而使STATs失效,而肿瘤状态下则是持续激活,从而在肿瘤的增生和凋亡、侵犯和转移等进程中起主要调节作用,被广泛且深入地探讨,诸如乳腺癌、卵巢癌、头颈部肿瘤和白血病[14]等多种病变中过表达。研究显示,STAT3除了参与癌的形成和进展,还与肿瘤游走、免疫逃逸及脉管形成等紧密相关[15]。实验结果显示p-STAT3主要表达于细胞核,这种表达的定位与细胞内STAT3信号传导流程一致。本研究结果显示,p-STAT3在宫颈病变的阳性率递增,LSIL组及SCC组与HSIL及LSIL组比较,差异均有统计学意义(P<0.05),说明p-STAT3在宫颈癌的产生、进展中起促进作用。同时p-STAT3与组织分级、临床分期及淋巴转移有关,说明STAT3在宫颈癌的分化过程和淋巴转移中起重要作用,可能是通过激活下游相关靶基因,加速细胞增殖并阻断凋亡。
本研究结果表明,Shh在SCC组中的阳性率高于SIL组及NC组,且SIL组均高于NC组,显示Shh活化发生在宫颈病变早期。p-STAT3在SCC组及HSIL组的阳性率高于LSIL组及NC组,SCC组与HSIL组无明显差异,相较于Shh,p-STAT3发挥的时间较晚,主要在宫颈高度病变及癌阶段,说明p-STAT3在宫颈早期病变中未能扮演重要角色,无过表达,而后期HPV整合到宿主DNA后会在一些因子刺激下过表达。此外相关性研究显示,2种蛋白在宫颈HSIL和宫颈癌中呈正相关,说明两通路存在相关联系。LI等[16]在大肠癌齐墩果酸抑制血管生成的研究中发现,VEGF是Shh和STAT3共同的靶基因,说明两通路具有共同的作用靶点,具有一定相关性。SUYAMA等[17]发现在乳腺癌中,CD24可以通过抑制STAT1来下调Shh的转录。有研究报道在淋巴瘤中发现Shh的活化需要STAT3的激活[18]。YANG等[19]关于肺腺癌的一项研究也表明STAT3活化可间接上调Shh基因的表达。本研究结果也符合相关趋势,基于上述证据,作者推测在宫颈癌中Shh可能是STAT3直接或间接的下游靶基因,下一步将研究两通路之间影响的具体机制,从而了解它们的调控流程。
总之,Shh、p-STAT3与宫颈癌/病变紧密相关,进一步了解宫颈鳞癌产生的分子机制有利于获得新的治疗方案,对早诊断、早干预及预后评估均有重要帮助,同时,对研制新靶向药物有显著的指导作用。
