熔盐电脱氧含钛废渣制备金属钛
2021-05-17盖家萱陈朝轶李军旗王林珠申园园
盖家萱,陈朝轶,李军旗,王林珠,申园园
(1.贵州大学材料与冶金学院,贵州贵阳,550025;2.贵州省冶金工程与过程节能重点实验室,贵州贵阳,550025)
钛具有比强度高、密度小、耐热性及耐腐蚀性强的特点,应用广泛[1-2]。工业上采用Kroll 法生产海绵钛,需经过氯化与镁热还原等过程[3],工艺复杂,生产周期长,导致金属钛的价格高昂。TiCl4制备过程中会产生大量的含钛废渣[4],由于颗粒粒度小,返回冶炼炉熔炼易于产生堵塞,其添加量不能超过15%,使得回收利用率较低,这些含钛废渣中钛含量较高,具有回收价值,若直接堆弃,则会造成资源浪费,并环境污染[5-6]。因此,寻求绿色环保、高效回收利用新途径显得尤为重要。
陈林等[7]等采用酸法处理含钛烟尘,将TiO2质量分数从38.3%提高到58.5%,起到一定的富集效果;赵海涛[8]对TiCl4生产过程中产生的各种废渣提出了处理方案,但未能提供具体实验结果,回收效果有待验证。WANG等[9]采用电解脱氧工艺,以不同质量比例的TiO2和GeO2混合物为前驱体,在电压为3.0 V、温度为800°C 的电解条件下,制备Ti-Ge(TixGey)金属间化合物。刘美凤等[10]提出CaCl2熔盐中TiO2电极直接电解还原过程中,首先被还原成钛的低价氧化物,再还原生成金属钛,由高价到低价再到金属逐渐进行。WENG 等[11]以NaCl-KCl-TiClx为电解质,以海绵钛为原料进行熔盐电解提纯制取高纯钛粉。由于熔盐电脱氧法(FFC法)具有流程短、操作简便等优点,近年来研究广泛,学者们选择以纯的金属氧化物以及一些复合矿与高炉渣[12]为原料,利用熔盐电脱氧法制备金属钛[13]、钛合金及电解其他稀有难熔金属与合金[14]等呈现出较好的效果。
本文作者以某钛厂氯化过程产生的含钛废渣为原料,采用FFC法对其进行电还原制备金属钛,重点考察电解时间和槽电压对电解效果的影响,并利用SEM-EDS,XRD以及循环伏安法分析产物元素分布与杂质的电还原行为。
1 实验
1.1 实验原料
实验采用的含钛废渣取自贵州某钛厂,主要元素质量分数见表1。从表1可知:Ti 质量分数为49.74%,杂质主要为Al,Si,Ca和Fe等。其XRD谱如图1所示,杂质与钛以类质同晶形态存在。

表1 含钛废渣的元素质量分数Table 1 Element mass fraction of titanium containing slag %

图1 含钛废渣的XRD谱Fig.1 XRD pattern of titanium slag
1.2 实验方法
采用液体石蜡为黏结剂,将含钛废渣压制成片,经XD-1200N马弗炉在1 050 ℃烧结后制成阴极,碳棒作为阳极,铁铬铝丝为电极引线,以CaCl2熔盐作为电解质,在氩气保护下进行电脱氧。电解结束后,持续氩气保护降至室温,取出电解产物,用蒸馏水和体积分数为1%的稀盐酸对其进行冲洗,干燥后待检测。利用德国XEPOSX 荧光分析仪对含钛废渣进行元素分析,烘干后对阴极产物进行XRD 分析(岛津XRD-7000,Cu Kα靶,扫描速率为10(°)/min,2θ为10°~85°),利用SEMEDS(JSM-6700F)分析其阴极表面形貌以及元素分布。利用High Score plus(荷兰飞利浦)对含钛废渣样品进行XRD图谱分析。
2 结果与讨论
2.1 电解时间对电脱氧效果的影响
在温度为900 ℃,槽电压为3.1 V,电解时间为0.5,1,6,9 和12 h 条件下,阴极产物的SEM形貌如图2所示,对应的元素分布如表2所示。由图2和表2可知:随着电解时间延长,阴极产物中Ti质量分数明显增加,O质量分数明显降低;当电解时间为0.5 h和1 h时,颗粒粒度较小;当电解时间达到6 h时,阴极颗粒粒度明显增大,呈海绵形态;继续延长电解时间,颗粒粒度增加不明显,但产生烧结作用,出现聚集现象,孔隙率增大,金属化率提高。

表2 不同电解时间的阴极产物元素质量分数Table 2 Element mass fraction of cathode products at different electrolysis time %
在上述电脱氧条件下阴极产物的XRD 谱如图3所示。由图3和表2可知:当电解时间为0.5 h时,产物主要为CaTiO3和Ti2O3,这与表2中Ca 质量分数较高的结果相吻合,说明经CaCl2熔盐浸泡及电解初期主要生成CaTiO3;随着电解时间延长,CaTiO3被电解为Ti 的低价氧化物;电解1 h 后,CaTiO3的衍射峰消失,经EDS 分析Ca 质量分数为0;当电解时间超过6 h时,出现金属Ti的衍射峰,且衍射峰的强度随时间延长而增加;当电解时间达到12 h时,产物主要为金属Ti和微量TiO,其中金属Ti质量分数为94.23%,O质量分数降至3.50%。

图2 不同电解时间的阴极产物SEM形貌Fig.2 SEM morphologies of cathode products for different electrolysis time

图3 不同电解时间的阴极产物XRD谱Fig.3 XRD patterns of cathode products for different electrolysis time
电解电流-时间曲线如图4所示。由图4可知:电解1 h 以内,电流急剧下降,产物由CaTiO3向Ti2O3转变;电解1.5 h 后,电流趋于平缓,产物以Ti 的低价氧化物为主;电解3.5 h 后,电流略为增加,经分析认为,金属Ti 开始析出,增加了导电性;当电解时间达到9 h 后,产物以金属Ti 为主;电解后期,电流出现增大趋势,这是由于碳棒阳极发生了粉化现象,碳粉浮在电解质表面,产生了部分电子导电作用。结合图4与XRD分析结果,获得电脱氧历程为:CaTiO3→Ti2O3→TiO→Ti。
电解过程中发生的主要反应方程为:
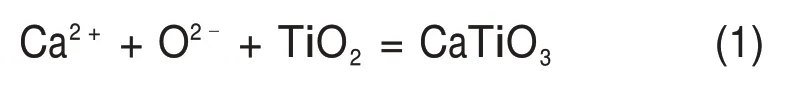

图4 电流-时间曲线Fig.4 Curve of current with time

2.2 槽电压对电脱氧的影响
在温度为900 ℃时阴极的循环伏安曲线如图5所示。由图5可知:在槽电压低于1.5 V 时,未出现还原峰,说明阴极未发生电脱氧反应;当槽电压高于1.5 V时,开始出现还原峰,但不明显,这是导致电还原速率慢、电流低的原因。实际开始发生还原的槽电压应该高于1.5 V。

图5 阴极的循环伏安曲线图Fig.5 Cyclic voltampere of cathode
在温度为900 ℃,电解时间为15 h,槽电压分别为1.2,1.6,2.0和2.8 V条件下的阴极产物SEM形貌如图6所示,对应的元素分析如表3所示。由表3可知:当槽电压低于1.6 V 时,Ca 和O 质量分数高,还原程度低;随槽电压升高至2.0 V,颗粒粒径开始增加,Ti 质量分数明显增加,而Ca 质量分数明显降低,但O 质量分数较高,电还原程度仍然不明显;当槽电压升高至2.8 V时,颗粒的粒径明显增大,呈典型海绵形态,金属Ti 质量分数达到97.79%,Ca 质量分数为0,O 质量分数降至0.71%,还原程度较为彻底,其他杂质元素含量也大幅降低。
在上述电脱氧条件下阴极产物的XRD 谱如图7所示。从图7可知:当槽电压为1.2 V时,该电压未达到CaTiO3的分解电压,阴极产物主要为CaTiO3;当槽电压升高至1.6 V 时,部分CaTiO3发生分解生成钛的氧化物,Ca 质量分数降低;当槽电压升高至2.0 V时,Ca质量分数明显降低,仅为2.20%,CaTiO3的衍射峰消失,钛的氧化物发生脱氧,降至更低价态,产物主要为TiO;当槽电压升至2.8 V时,只有金属Ti的衍射峰。
不同槽电压条件下阴极电流-时间曲线如图8所示。从图8可知:电流随槽电压升高而升高;电解时间在1~20 min 时,电流急剧下降;当槽电压为1.2 V和1.6V时,由于电压较低导致整体电流较小;当槽电压为2.0 V 时,电解时间在20~50 min时,出现电流平台,之后电流迅速降低,经分析认为,这是CaTiO3发生分解所致;而当槽电压低于1.6 V 时,CaTiO3较为稳定,几乎不发生分解,没有出现电流平台现象;当槽电压升至2.8 V 时,脱氧速率较快,电流明显增加,电流趋于稳定后,出现3个电流平台。经分析认为:在第一和第二电流平台,CaTiO3发生分解,并还原为Ti 低价氧化物;第三平台电流略有增加,是析出金属Ti、伴随碳棒阳极粉化现象所致。
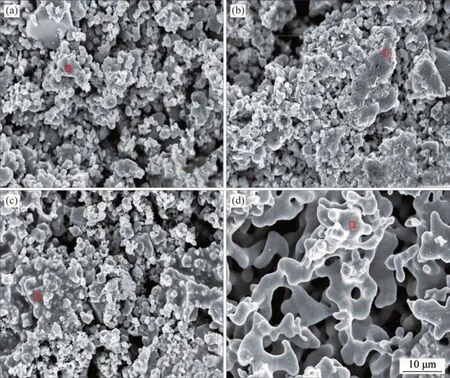
图6 不同槽电压的阴极产物微观形貌Fig.6 SEM morphology of cathodes at different voltages electrolysis

表3 不同槽电压的阴极产物元素质量分数Table 3 Element mass fraction of cathode products at different cell voltages %

图7 不同槽电压的阴极产物XRD谱Fig.7 XRD patterns of cathode products at different bath voltages

图8 不同槽电压阴极电流-时间曲线Fig.8 Current-time curve of cathode under different electrolytic voltage
3 杂质元素分析
含钛废渣中主要杂质为Fe,Si 和Al 等元素,杂质与金属钛的分离主要是由于析出电位差不同,电位差越大,精炼效果越好。在电解过程中,相比于TiO2,电极电位更低的杂质优先在阴极析出。表4所示为杂质元素的物理化学特性。由表4可知:Fe,Al 和Si 的氯化物沸点均小于900 ℃。化学方程式(6)~(8)计算所得标准吉布斯自由能ΔGΘ如图9所示。在900 ℃生成FeCl3,AlCl3和SiCl4的ΔG均远大于零,不能自发进行。

表4 金属的物理化学特性Table 4 Physical and chemical properties of metals

CaO在CaCl2熔盐电解质中具有一定溶解度[15],使得废渣中Ca全部进入熔盐,Fe,Al和Si等杂质被还原为单质,大部分起到热还原作用,最终进入熔盐,小部分与电解产生的少量氯气生成氯化物挥发,反应方程见式(9)~(11)。AlCl3的沸点低,更易于挥发,随着电解时间及槽电压的增加,产物中铝的含量大幅下降。而产物中铁含量变化不大,1.6 V 电解过程中出现FeTiO3,Fe和Ti产生类质同晶现象,有形成TiFe合金的倾向[16-19],由于产物中其含量不高,未能发现对应的衍射峰。由于废渣中Si 含量较低,电解过程主要在阴极孔隙中进行,产物中含量变化的规律性不强。

图9 标准吉布斯自由能随温度变化曲线Fig.9 Standard Gibbs free energy with temperature curve

4 结论
1)在温度为900 ℃和槽电压为3.1 V 条件下,随着电解时间延长,Ti 质量分数增加;电解3.5 h开始析出金属Ti,电解6 h后,阴极颗粒粒度明显增大,呈海绵形态;电解12 h 时,金属Ti 质量分数达到94.23%,产物为金属Ti 和微量TiO;电脱氧历程为:CaTiO3→Ti2O3→TiO→Ti。
2)在900 ℃下电解15 h,槽电压为2.0 V 时,CaTiO3发生分解,产物主要为TiO;当槽电压升高至2.8 V 时,Ti 质量分数达到97.79%,O 质量分数降至0.71%。
3)电极电位更低的杂质优先被还原为单质,大部分起热还原作用,在阴极孔隙中进行扩散与迁移过程较复杂,使得产物中残留微量的Fe,Al和Si等杂质,而Ca全部进入熔盐。
