Arntl基因敲除对小鼠T细胞发育及抗感染功能的影响
2021-05-15孙亚娥焦安君张星哲杨小丰周晓勃张保军刘晓斌
孙亚娥,焦安君,王 昕,张星哲,雷 蕾,杨小丰,解 涛,周晓勃,史 霖,张保军,4,5,刘晓斌
(1. 延安大学医学院,陕西延安 716000;2.西安交通大学基础医学院病原生物学与免疫学系,陕西西安 710061;3.西安交通大学医学部转化医学研究院感染与免疫研究所,陕西西安 710061;4.环境与疾病相关基因教育部重点实验室(西安交通大学),陕西西安 710061;5. 西安市免疫相关疾病重点实验室,陕西西安 710061)
芳基烃受体核传送器样分子(aryl hydrocarbon receptor nuclear translocator-like, Arntl)也称为BMAL1、MOP3、BMAL1c、JAP3、PASD3、TIC、bHLHe5,其编码基因位于小鼠7号染色体上,是外周时钟核心基因,也是目前唯一发现的单独敲除会导致小鼠活动节律性失调的基因[1]。哺乳动物的免疫活动也呈现节律振荡[2],但在免疫细胞中,Arntl的作用不仅是调节节律,还影响到免疫细胞的发育和功能。髓系祖细胞缺失Arntl会促使其向IL-17+/IFN-γ+T细胞分化,引起中枢神经性自身免疫性疾病(EAE)的恶化[3];小鼠缺失Arntl(Arntl-/-)会使外周血和脾脏中的B细胞数目减少,导致pre-B细胞不能分化为成熟的B细胞[4];巨噬细胞缺失Arntl则会增加其运动性及吞噬功能,使其能更好地抵抗肺炎球菌引起的感染[5]。本研究团队通过Immgen数据库检索发现,Arntl在小鼠DP细胞中表达较高,提示其在T细胞此阶段的分化发育中可能发挥作用,但目前没有相关研究报道。因此,本研究拟采用T细胞特异性敲除Arntl的小鼠模型(ArntlF/FCD4cre+小鼠)研究Arntl对T细胞的发育及抗感染免疫应答的影响。
1 材料与方法
1.1 实验材料
1.1.1实验动物ArntlF/F小鼠和CD4cre+小鼠均购自Jackson。ArntlF/FCD4cre+小鼠和ArntlF/FCD4cre-小鼠的饲养和繁殖均在西安交通大学医学部SPF级动物房〔许可证:SYXK(陕)2020-005〕,动物实验均符合西安交通大学医学部实验动物伦理指南。
1.1.2实验试剂抗体CD4-APC/CY7(clone:GK1.5)、CD8-FITC(clone:53-6.7)、CD44-PE/CY7(clone:IM7)、CD62L-APC(clone:MEL-14)、TCRγδ-PE/CY7(clone:GL3)、CD25-PE(clone:PC61)、FOXP3-APC(clone:MF-14)、IFNγ-PE/CY7(clone:XMG1.1)、Purified anti-mouse CD3ε Antibody(clone:145-2C11)、Purified anti-mouse CD28 Antibody(clone:37.51)、Purified anti-mouse IL-4 Antibody(clone:11B11)和试剂Recombinant Mouse IL-2(Cat:575402)、Recombinant Mouse IL-12(Cat:577002)、Monensin(Cat:420701)、Brefeldin A(Cat:420601)、细胞破膜剂(Cat:420801)、清洗剂(Cat:421002)均购自BioLegend。GP33和CD1d tetramer由NIH Tetramer Core Facility提供。PDBU(Cat:524390)和Ionomycin(Cat:I3909)购自Sigma-Aldrich。CountBrightTMabsolute counting beads(Cat:C36950)购自invitrogen。RNA提取试剂盒(Cat:DP419)购自天根生物。反转录试剂盒(Code No.FSQ-301)购自东洋纺。
1.1.3实验仪器流式细胞仪(型号:CytoFLEX,BECKMAN);PCR仪(型号:BIORAD,Thermal Cycler);RT-PCR仪购(型号:StepOnePlus,Applied Biosystems);离心机(型号:centrifuge 5810R, Eppendorf)。
1.2 实验方法
1.2.1条件性敲除小鼠的构建及鉴定将ArntlF/F小鼠和CD4cre转基因小鼠(CD4cre+小鼠)进行两代杂交,获得对照组小鼠(ArntlF/FCD4cre-, WT)和基因敲除组小鼠(ArntlF/FCD4cre+, KO)。基因型鉴定采用PCR扩增法,引物序列CD4cre:Forward 5′-GGGTGCCCACTTTTGTGTAT-3′,Reverse 5′-ATGTTTAGCTGGCCCAAATG-3′;Arntl:Forward
5′-ACTGGAAGTAACTTTATCAAACTG-3′,Reverse 5′-CTGACCAACTTGCTAACAATTA-3′。样本为小鼠脚趾组织,提取DNA后,通过PCR扩增目的基因片段,经15 g/L琼脂糖凝胶电泳后,用凝胶成像仪扫描分析。
1.2.2实验分组6~10周龄的小鼠,基因型ArntlF/FCD4cre-的小鼠为对照组(WT),基因型ArntlF/FCD4cre+的小鼠为基因敲除组(KO)。每次实验取每组小鼠3~5只。
1.2.3病毒感染方法取-80 ℃存放的LCMV病毒,于37 ℃水浴中快速解冻,每只小鼠以2×105PFU剂量腹腔注射。在感染后第8天,分析脾脏中淋巴细胞的比例及表型。
1.2.4胸腺和脾脏中淋巴细胞的提取分别取WT(n=3)和KO(n=3)组小鼠的胸腺及脾脏,研磨,200目筛网过滤,1 500 r/min、4 ℃离心5 min。弃上清,加入1 mL红细胞裂解液重悬细胞,作用1 min后加FACS(1×PBS+2% FBS)洗涤2次,用1 mL FACS重悬,备流式检测。
1.2.5流式细胞术检测细胞的数目和比例取1.2.4项备好的淋巴细胞,按体积1∶400的比例加入特定组合抗体,冰上避光孵育30 min,用FACS缓冲液清洗1次后,每管加2 μL CountBrightTMabsolute counting beads,流式细胞术检测各类细胞的数目和比例。
1.2.6胞内细胞因子检测取WT(n=3)和KO(n=3)组的小鼠脾脏淋巴细胞,按每孔2×105的细胞密度接种在96孔细胞培养板中,加入Monensin(2 μmol/L)、Brefeldin A(5 μg/mL)、Ionomycin(0.5 μg/mL)、PDBU(1 μmol/L),37 ℃、50 mL/L CO2条件下培养4 h后,收集细胞,用FACS洗涤。进行细胞表面标志抗原染色,然后进行胞内细胞因子染色(具体方法详见BioLegend相关试剂说明书),最后用流式细胞仪进行检测。
1.2.7Th细胞的体外诱导分化用流式分选仪分选源自WT(n=3)和KO(n=3)小鼠的初始CD4+T细胞(CD4+CD25-CD44-CD62L+T细胞),按每孔1×105的细胞密度接种在96孔培养板中,培养板预先低包被anti-CD3(5 μg/mL)、anti-28(2.5 μg/mL),培养基中加入IL-2(2.5 ng/mL)、IL-12(20 ng/mL)、anti-IL-4(10 μg/mL),37 ℃、50 mL/L CO2条件下培养96 h。在培养的第92 h,每孔加入Monensin(2 μmol/L)、Brefeldin A(5 μg/mL)、Ionomycin(0.5 μg/mL)、PDBU(1 μmol/L),继续培养4 h后收集细胞,用FACS清洗1次后染色。先进行表面标志抗原染色,再进行胞内细胞因子IFN-γ染色(步骤同前),用流式细胞仪检测。
1.2.8qPCR检测LCMV病毒载量取LCMV感染后第8天的脾脏细胞,用总RNA提取试剂盒提取RNA,用等量的RNA进行反转录,qPCR检测LCMV病毒载量,引物序列:Forward 5′-TGCCTGACCAAATGGATGATT-3′,Reverse 5′-CTGCTGTGTTCCCGAAACACT-3′。以actin作为内参照,计算病毒的相对载量。

2 结 果
2.1 T细胞中特异性敲除Arntl小鼠的鉴定Arntl+/+的PCR产物大小为327 bp,ArntlF/+的PCR产物大小为327 bp和431 bp,ArntlF/F的PCR产物大小为431 bp(图1A)。CD4cre+的PCR产物大小为450 bp,CD4cre-的PCR扩增条带则是阴性(图1B)。对各型小鼠PCR结果显示:T细胞中特异性敲除Arntl基因的小鼠构建成功。
2.2 Arntl敲除对T细胞发育的影响WT小鼠(ArntlF/FCD4cre-)和KO小鼠(ArntlF/FCD4cre+)胸腺中DP、CD4+、CD8+、Treg(CD4+CD25+FOXP3+)、γδT(TCRγδ+)、NKT(CD1d+TCRβ+)等主要T细胞亚群的比例和数目无统计学差异(图2);脾脏中CD4+、CD8+、Treg、γδT、NKT等主要T细胞亚群的比例和数目也未见统计学差异(图3)。
2.3 Arntl敲除对LCMV感染后小鼠脾脏中T细胞的影响LCMV感染后,WT和KO组小鼠脾脏中CD4+T细胞、CD8+T细胞占总细胞比例及病毒特异性GP33+T细胞占CD8+T细胞的比例无统计学差异;CD8+的效应T细胞(CD8+CD44+CD62L-)和GP33+的效应T细胞(CD8+GP33+CD44+CD62L-)的比例也无统计学差异(图4)。
2.4 Arntl敲除对脾脏中病毒载量的影响用qPCR的方法检测脾脏中LCMV病毒载量,结果显示,KO组LCMV的相对表达量较WT组显著降低(P<0.05,图5)。说明KO小鼠脾脏中的病毒含量较少,KO小鼠对病毒的清除能力较强。
2.5 Arntl敲除对LCMV感染后小鼠脾脏中T细胞分泌IFN-γ的影响为了研究Arntl敲除鼠中病毒载量降低是否与T细胞的功能增强有关,本研究分析了LCMV感染后脾脏中CD8+T细胞和GP33+T细胞分泌炎性因子IFN-γ的情况。结果显示,KO组小鼠中CD8+IFN-γ+T细胞占总CD8+T细胞的比例较WT组显著升高,GP33+IFN-γ+T细胞的比例占总GP33+T细胞的比例也显著升高(P<0.01,图6A~6D)。

图2 ArntlF/FCD4cre+和野生型小鼠胸腺中各T细胞亚群的比例和数目
2.6 Arntl敲除促进初始CD4+T细胞向Th1细胞分化为了探索Arntl在T细胞免疫应答过程中对CD4+T细胞分化的影响,本研究分别分选了WT和KO组小鼠淋巴结中的初始 CD4+T细胞(CD4+CD25-CD44-CD62L+),体外诱导Th1细胞分化。结果显示,与WT组小鼠相比,KO组小鼠的初始CD4+T细胞分化为Th1细胞的比例显著升高(P<0.01,图6F)。
3 讨 论
Arntl属于分子时钟基因,控制细胞生理活动的昼夜节律变化,其表达水平也随着昼夜发生周期性的变化。在T细胞发育中,Arntl在DP阶段有较高的表达,但其表达没有明显的节律性[6]。T细胞中Arntl的表达对T细胞的发育和功能的影响不太清楚。T细胞良好的发育是机体免疫功能的保障,T细胞数量的减少或者比例的变化与疾病的发生息息相关[7-10]。本实验中,T细胞特异性缺乏Arntl表达并没有引起胸腺、脾脏中主要T细胞亚群数目的改变,包括DP细胞及发挥效应功能的CD4+、CD8+T细胞和发挥调节功能的Treg细胞,因此Arntl不影响T细胞发育。本研究结果与HEMMERS[6]报道的一致。

图3 ArntlF/FCD4cre+和野生型小鼠脾脏中各T细胞亚群的比例和数目
T细胞在机体的免疫防御中发挥重要作用。CD4+T细胞活化后,辅助调节CD8+T细胞、B细胞及天然免疫细胞的功能。CD8+T细胞通过分泌TNF-α、IFN-γ、穿孔素、颗粒酶等来发挥效应功能,其功能的升高有利于机体抵抗病原感染和肿瘤发生[11-14]。本研究用LCMV感染对照组(ArntlF/FCD4cre-)和敲除组(ArntlF/FCD4cre+)小鼠,并检测病毒载量,发现敲除组小鼠的病毒载量明显降低,提示敲除Arntl增强T细胞的抗病毒功能。进一步通过流式细胞术检测,发现CD8+IFN-γ+T细胞的比例占总CD8+T细胞的比例显著升高,病毒特异性GP33+T细胞中分泌IFN-γ细胞的比例也显著升高。这些结果表明,Arntl敲除后,T细胞在发生免疫应答的过程中效应功能增强。Arntl对IFN-γ的影响是否意味着其在Th细胞的分化过程中会促使Th1型细胞的分化呢?体外诱导Th1细胞分化的实验证实了分泌IFN-γ细胞的比例增加。因此,本研究认为Arntl敲除一方面促进了Th0向Th1分化,辅助CD8+T细胞的效应功能;另一方面,Arntl敲除可以促使CD8+T细胞分泌IFN-γ,增强抗病毒免疫反应。因此,IFN-γ的表达增高可能是敲除鼠病毒清除效率增高的原因。
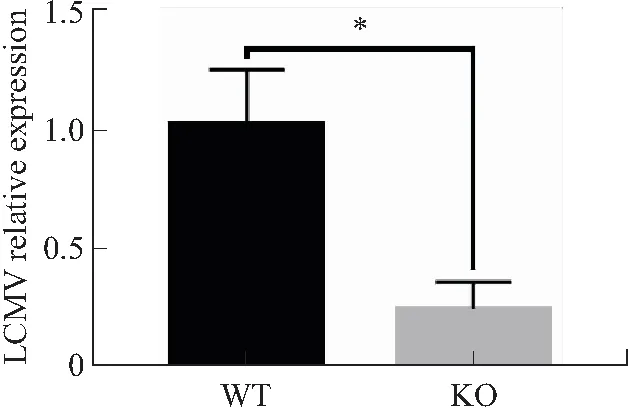
图5 ArntlF/FCD4cre+和野生型小鼠脾脏中病毒载量测定

图6 ArntlF/FCD4cre+和野生型小鼠T细胞分泌IFN-γ的比例变化
在固有免疫细胞中,Arntl似乎是抑制炎性反应的因子[15-16],但Arntl如何调控IFN-γ的表达尚无研究报道。在本研究中,敲除鼠(ArntlF/FCD4cre+)T细胞分泌IFN-γ显著增高,其具体机制需后续研究阐明。值得注意的是,本研究与HEMMERS[6]用了相似的病毒感染动物模型,但是他们的研究没有发现Arntl对CD8+T细胞产生IFN-γ的影响,这可能是因为两个研究对T细胞的处理是不同的。本实验在体外采用PDBU和Ionomycin刺激T细胞4 h后检测,而他们采用病毒抗原刺激。
综上所述,T细胞中特异性敲除Arntl基因不影响T细胞的发育,但在发生免疫应答的过程中,通过促进Th1细胞的分化及CD8+T细胞IFN-γ的分泌而增强机体抗病毒能力。
