千年桐嫁接愈合过程解剖结构与内源激素的变化
2021-05-14蓝金宣梁文汇黄晓露杨卓颖李宝财马锦林
蓝金宣,梁文汇,黄晓露,杨卓颖,李宝财,马锦林
(广西壮族自治区林业科学研究院 广西特色经济林培育与利用重点实验室,广西南宁 530002)
千年桐(Vernicia montana)又称木油桐、皱果桐,为大戟科(Euphorbiaceae)油桐属多年生落叶乔木,是我国特有的工业油料树种,与油茶(Camellia oleif⁃era)、核桃(Juglans regia)和乌桕(Triadica sebifera)并称为我国4 大木本油料植物[1-3],主要分布于四川、湖南、广西、广东、云南、贵州、浙江、江西、福建和台湾等地[4]。桐油含有60% ~80% 的桐酸,化学性质活泼,能发生多种化学反应,具有干燥快、附着力强、耐酸、耐碱及耐高温等特点,是最适用于制造环保型油漆的生物基质;桐油还具有优质的绝缘性能,广泛用于各种电子芯片的浸渍处理,利用前景广泛[5-8]。千年桐寿命长、抗枯萎病能力强,适合在强酸性土壤环境中种植,但因其雌雄异株,结果较晚,常有一半左右的雄株终生不结果,导致单位面积产量不高[9]。如采用千年桐高产无性系嫁接苗造林,则可大大提高单位面积产量。
千年桐嫁接体愈合是嫁接苗培育的关键问题。大量研究表明,嫁接体愈合与砧穗内部生化物质含量有关,且内源激素是影响嫁接口愈合的主要因素之一[10-13]。本研究通过对千年桐嫁接口愈合进程进行解剖观察,全面了解嫁接愈合过程中的组织机理,判断嫁接口愈合的关键时期,同时通过测定分析嫁接口结合部形成层及韧皮部内源激素的变化,探讨激素含量对愈合的影响,为嫁接苗培育技术在生产上的推广应用提供理论参考。
1 材料与方法
1.1 试验地概况
试验地设在广西壮族自治区林业科学研究院油桐山试验苗圃(108°56'E,22°56'N),海拔约80 m,属亚热带季风气候,年均气温21.7 ℃,≥10 ℃积温为7 200 ℃,最低气温-1.5 ℃,最高气温40.4 ℃,全年无霜期达360 天,年均降水量1 300 mm,年均日照时长1 550 h,年均相对湿度80%左右,干湿季节明显,降雨主要集中在4—9月[14]。
1.2 试验材料
2019年10月16日,以1年生千年桐地苗作为砧木,选取成年优树上健壮的当年生枝条作为穗条。取6 ~7 cm、含1 ~2个腋芽的茎段作为接穗,用切接法进行嫁接,共嫁接1 000 株。采用完全随机方法对成活的植株进行取样,嫁接后第5 天开始,每2 天取1 次样,共8 次;第20 ~55 天,每3 天取1 次样,共12 次,每次各取15 株,其中3 株截取1.0 ~1.5 cm 的嫁接口茎段放入FAA 固定液中固定,取样完成后统一切片,剩余12 株将嫁接口茎段皮部(包括愈伤组织)一起剥出,将剥出的部分经液氮冷冻后,放入-80 ℃冰箱保存,取样完成后统一测定内源激素含量。
1.3 试验方法
1.3.1 嫁接口切片
将样品从固定液中取出,在通风橱内用手术刀修剪嫁接口茎段的组织,将修切好的样品和对应的标签放入脱水盒,将脱水盒放入脱水机,用不同浓度乙醇对样品进行脱水,乙醇的浓度为60%、70%、80%、90%、95%、100%和100%。用甲基丙烯酸甲酯浸塑,经过3 次浸塑后,入包埋液抽真空,再用MMA 包埋、聚合。采用莱卡Histo Cut 全自动切片机切片,50%乙醇贴片,过夜烤片。依次将切片放入乙二醇乙醚乙酸酯Ⅰ中,在37 ℃条件下浸泡6 h,后放入乙二醇乙醚乙酸酯Ⅱ中,在37 ℃条件下浸泡过夜,再放入乙二醇乙醚乙酸酯Ⅲ中,在室温下浸泡10 ~15 min,接着放入乙二醇乙醚乙酸酯Ⅳ中,在室温下浸泡10 ~15 min,随后依次放入100%乙醇、95%乙醇、90%乙醇和80%乙醇中各浸泡10 min,最后用自来水清洗。切片入番红染液中染色3 ~5 s,自来水稍洗,洗去多余染料即可。依次放入50%、70%和80%梯度酒精中各3 ~8 s 进行脱色。放入固绿染液中染色4 ~6 s,无水乙醇三缸脱水。放入干净的二甲苯透明5 min,中性树胶封片。
1.3.2 内源激素测定
称取样品各1 g,冰浴下研磨成粉,装入10 mL离心管中,放入-80 ℃冰箱中保存。待全部采集完成后,干冰冷冻条件下寄往中国农业大学,采用酶联免疫吸附法测定吲哚乙酸(IAA)、脱落酸(ABA)、赤酶素(GA3)和玉米核苷(ZR)的含量。
1.4 数据处理
采用Excel 2010 和SPSS 17.0 软件对试验数据进行统计与分析。
2 结果与分析
2.1 嫁接口愈合过程中的结构变化
嫁接口愈合过程经历了5 个阶段,分别是隔离层形成期、愈伤组织分化形成期、愈伤组织连接期、形成层分化连接期和维管组织分化形成期。
嫁接后第5天,伤口发生愈伤反应,可观察到一些褐色的坏死组织,即隔离层(图1)。这些坏死组织在嫁接早期可防止水分过度蒸发并保护伤口不受外物侵染。

图1 隔离层形成期横切图Fig.1 Transverse section on formation stage of isolation layer
嫁接后第7 天,砧木和接穗伤口附近形成不规则多边形的薄壁细胞,即愈伤组织(图2a)。嫁接后第9天,这些不规则多边形的薄壁细胞逐渐增加,砧木和接穗产生的愈伤组织共同填充接缝(图2b)。

图2 愈伤组织分化形成期横切图Fig.2 Transverse section on formation stage of callus differentiation
嫁接后第11 ~15天,由于愈伤组织不断分化积累,基本填满了砧木和接穗间的连接处,使两者的愈伤组织连为一体,形成砧穗连接的愈伤组织桥(图3a ~c)。愈伤组织桥在维管束形成前的嫁接初期,是砧木向穗条提供水分和营养的主要通道。
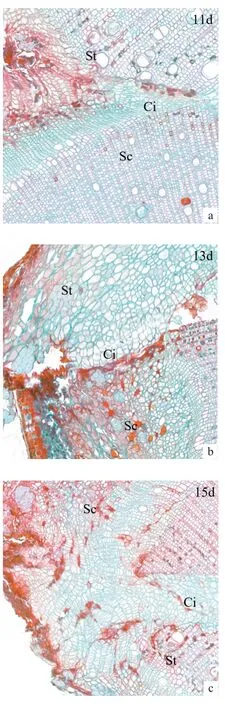
图3 愈伤组织连接期横切图Fig.3 Transverse section on callus connection stage
嫁接后第17 ~22天,砧木形成层向内分化出4 ~5 层木质部细胞,砧木形成层附近的薄壁细胞不断分化出新的形成层,穿过愈伤组织,连接砧穗形成层,形成完整的形成层带(图4a ~c)。连接完整形成层带的结构为扭曲带状。

图4 形成层分化形成期横切图Fig.4 Transverse section on the cambium differentiation and formation stage
嫁接后第25 天,连接完成的形成层带继续分化,向内分生出木质部,且在连接处可观察到新生导管形成(图5a)。嫁接后第31天,砧穗形成层和两者连接处形成层分化出较多的木质部,导管清晰可见(图5b)。嫁接后第34天,明显看到形成层向内分化形成更多的木质部且内含导管,向外分化出韧皮部,形成筛管(图5c),砧穗完整地连为一体。砧木和穗条可通过新形成的维管组织恢复对穗条水分和营养的供应,这是嫁接成活至关重要的时期。嫁接后第37天、第52天及第55天,木质部已形成(图5d ~f)。
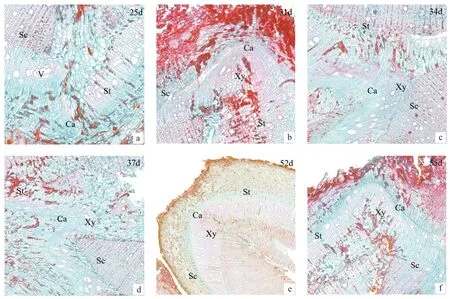
图5 维管组织分化形成期横切图Fig.5 Transverse section on vascular tissue differentiation and formation stage
2.2 嫁接口愈合进程中内源激素的变化
2.2.1 嫁接口愈合过程中IAA和ABA含量的变化
IAA 含量在嫁接后第7、15、19、28、37、49 天处于谷值,在第28 天最低(12.64 ng/g);在嫁接后第13、17、25、34、43 天处于峰值,在第17天最高(78.95 ng/g)(图6)。
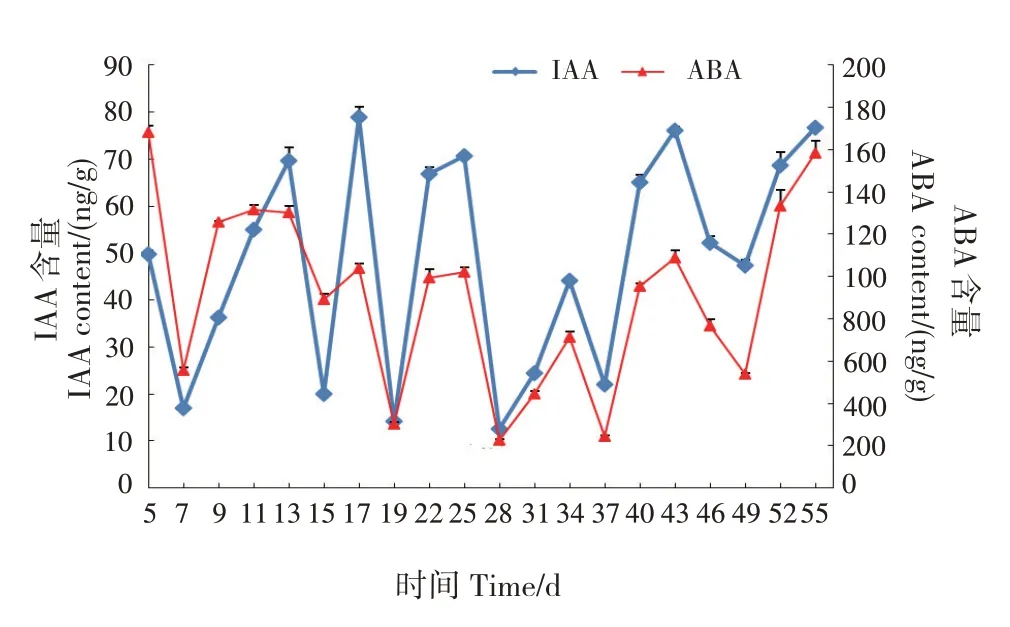
图6 千年桐嫁接愈合过程中IAA和ABA含量的变化Fig.6 Changes of contents of IAA and ABA in V.montana in graft healing
ABA 含量在嫁接后第7、15、19、28、37、49 天处于谷值,在第28 天最低(22.55 ng/g),这与IAA 含量的最低值出现的日期一致;在嫁接后第11、17、25、34、43 天处于峰值。
2.2.2 嫁接口愈合进程中GA3和ZR含量的变化
GA3含量在嫁接后第7、15、19、28、37 天处于谷值,在第28 天最低(2.33 ng/g);在嫁接后第11、17、22、34、46 天处于峰值(图7)。第40 ~55 天,GA3含量为12.15 ~16.10 ng/g,处于相对较高值。

图7 千年桐嫁接愈合过程中GA3和ZR含量的变化Fig.7 Changes of contents of GA3 and ZR in V.montana in graft healing
ZR 含量在嫁接后第7、11、19、28、37、46 天处于谷值,在第19 天最低(6.10 ng/g),其次是第28 天(6.45 ng/g);在嫁接后第9、13、25、43 天处于峰值。第28 ~37天,ZR含量持续较低(6.45 ~8.19 ng/g)。
3 结论与讨论
不同研究者对嫁接愈合阶段的划分不同,但愈合过程都会经历隔离层形成、愈伤组织形成、形成层分化及维管输导组织形成等阶段,兖攀等[15]将美国山核桃(Carya illinoinensis)嫁接愈合过程分为4个阶段,苏文川[11]将薄壳山核桃嫁接愈合过程分为5 个阶段。嫁接愈合所需的时间会因植物种类、年龄、嫁接时期和嫁接部位的不同而不同,美国山核桃嫁接后第30 天砧穗结合成一体[15],油茶(Camel⁃lia oleifera)芽苗砧嫁接后第35 天可形成维管束桥[10],黄瓜(Cucumis sativus)苗嫁接后第12 天愈合部位形成新的维管束[16]。本研究中千年桐嫁接愈合过程分为5 个阶段,即隔离层期(第1 ~5 天)、愈伤组织分化形成期(第5 ~9 天)、愈伤组织连接期(第9 ~17 天)、形成层分化连接期(第17 ~25 天)和维管组织分化连接期(第25 ~34 天)。嫁接后前9天是决定嫁接体能否形成的关键期,这与凌麓山等[9]的研究结果一致;前34 天是千年桐嫁接苗成活的重要时期。
植物内源激素是其嫁接体发育的控制因子之一[12-13,17]。IAA 含量在嫁接后第13、17、25、34 和43 天处于峰值,在第17 天最高;ABA 含量在嫁接后第11、25、34 和43 天处于峰值;GA3含量在嫁接后第11、17、22、34 和46 天处于峰值;ZR 含量在嫁接后第9、13、25 和43 天处于峰值。IAA、ABA、GA3和ZR 的含量在嫁接后第7、19、28 和37 天均处于谷值,IAA、ABA 和GA3的含量在嫁接后第28天均最低。
千年桐嫁接愈合过程中内源激素IAA、ABA、GA3和ZR 随着嫁接进程呈起伏变化,大体呈“W”型。嫁接后第25 天,IAA 及ZR 含量处于峰值,有利于诱导韧皮部和木质部的分化,形成维管组织。这与冯金玲等[10]、卢善发等[17]、Yin等[18]及孟庆伟等[19]的研究结果相似。嫁接后第5 ~7天,ABA含量呈下降趋势,有可能是伤口多酚抑制的结果,这与冯金玲[20]的研究结果相似;之后,ABA 含量的变化趋势与IAA大体一致,均是在嫁接的关键阶段含量较高,说明ABA 对嫁接口的发育可能有促进作用,因为ABA 含量上升是纤维次生壁发育的起始信号[21]。因此,在嫁接的特定阶段,适当使用相应的激素有利于提高嫁接成活率。
本试验只针对千年桐嫁接苗结合部位的4种内源激素的变化进行分析,各类激素的互作关系尚未清晰,同时生理指标对千年桐嫁接成活的影响也尚未明了,有待进一步的研究。
