鱼腥草素钠联合阿米卡星体外抗多重耐药鲍曼不动杆菌的作用分析*
2021-05-14毛建梅周孟杰
毛建梅,周孟杰,蔡 燕
1.川北医学院临床检验医学系,四川南充 637007;2.川北医学院附属医院产前诊断中心,四川南充 637000
鲍曼不动杆菌是导致医院内感染的常见革兰阴性杆菌,其感染多发于重症监护室和神经外科,以下呼吸道分泌物检出率最高。有研究报道,多重耐药鲍曼不动杆菌(MDR-AB)、耐碳青霉烯类鲍曼不动杆菌(CR-AB)的检出率超过60.00%,并且全耐药鲍曼不动杆菌(PDR-AB)检出率达16.67%[1]。随着经验性抗菌药物的使用,MDR-AB对临床上常用的抗菌药物,如青霉素类、β-内酰胺类、碳青霉烯类、喹诺酮类药物的耐药率为90.00%以上,对易导致不良反应的氨基糖苷类抗菌药物的耐药率为54.50%[2]。近年来,随着人们在中药抗菌方面的研究不断深入,具有抗菌活性的中药逐渐被报道,比如鱼腥草的活性成分鱼腥草素钠(SH)已被证实对铜绿假单胞菌、金黄色葡萄球菌、白色念珠菌及结核分枝杆菌都有一定的抗菌作用,并且能增强阿奇霉素、氟康唑、红霉素的抗菌活性[3-7]。本课题组前期预实验发现,SH对MDR-AB有一定的抑制作用,因此,本研究将在体外探讨SH与阿米卡星(AMK)是否具有联合抗菌作用,现将结果报道如下。
1 资料与方法
1.1一般资料 本实验所采用的10株MDR-AB菌株收集于川北医学院附属医院微生物室,其中6株来源于神经外科,4株来源于重症监护室,均为痰液标本。
1.2仪器与试剂 仪器:VITEK2全自动微生物分析仪及AST-GN鉴定卡(法国生物梅里埃有限公司),AST-GN16药敏卡及配套药敏纸片,台式恒温振荡器(上海跃进医疗),DHP420电热恒温培养箱(重庆永恒实验仪器厂),TECAN全波长全自动酶标仪(型号M200PR0)。试剂及药品:SH(10克/瓶,购自西安开来生物工程有限公司),AMK注射液(0.2克/支,川北医学院附属医院药房提供),四甲基偶氮唑盐(MTT,广州赛国生物科技有限公司),二甲基亚砜(DMSO,成都市科龙化工试剂厂)。培养基:水解酪蛋白(MH)肉汤培养基(海博生物技术有限公司),MH琼脂培养基(海博生物技术有限公司)。
1.3方法
1.3.1菌株筛选 采用VITEK2全自动微生物分析仪及AST-GN鉴定卡进行细菌鉴定,采用AST-GN16药敏卡及配套药敏纸片进行药敏试验。根据上述鉴定结果选择10株对3类及以上抗菌药物(包括AMK、环丙沙星、亚胺培南、青霉素、头孢他啶等)耐药的鲍曼不动杆菌。以ATCC19606作为质控菌株。
1.3.2细菌复苏及菌液稀释 将收集的10株MDR-AB菌株用30%甘油保存于-80 ℃冰箱中。实验时取2 μL保存菌液接种于1 mL灭菌的MH肉汤培养基中,放置于37 ℃恒温振荡器中培养过夜。次日观察到MH肉汤培养基出现浑浊后,8 000 r/min离心3 min后倒掉上清液,加入1 mL的生理盐水重悬细菌,用生理盐水将菌液调成570 nm处吸光度值(A值)为1.0 (相当于0.5麦氏浊度,1×108cfu/mL)后再稀释1 000倍备用。
1.3.3单用SH、AMK的最低抑菌浓度(MIC)值测定 (1)微量肉汤稀释法:称取SH粉末,用MH肉汤配制为不同水平的SH溶液(4 500、4 000、3 500、3 000、2 500、2 000、1 500、1 000、500 μg/mL),各取80 μL依次加入96孔板中。AMK原液100 mg/mL,用MH肉汤配制为不同水平的AMK溶液(81 920、40 960、20 480、10 240、5 120、2 560、1 280、640 μg/mL),各取10 μL依次加入96孔板中。各对应孔中加入10 μL菌液,用MH补足至100 μL。每个水平梯度均做3个孔,同时设置药物对照孔(不加细菌)、阳性对照孔(不加药物)、阴性对照孔(只加MH培养基)。接种完后将96孔板置于37 ℃台式恒温振荡器中培养8 h后观察细菌生长情况,当阳性对照孔细菌生长且药物对照孔和阴性对照孔均无菌生长时,每孔加入10 μL的MTT(用无菌磷酸盐缓冲液配制,水平为5 mg/mL),再次置于37 ℃台式恒温振荡器中培养1 h,肉眼观察培养孔中的颜色,黑色代表孔内有菌落,以无细菌生长的最低浓度作为该药物的MIC值。接着每孔加入100 μL的二甲基亚砜(DMSO),振荡摇匀10 min,用酶标仪检测490 nm处的A值并计算出各水平梯度的平均抑制率。(2)琼脂稀释法:SH琼脂平板的终水平同微量肉汤稀释法一致,取9支无菌试管,分别称取SH粉末溶于10 mL灭菌MH琼脂中,混匀并倒置平板冷却备用。取9支无菌试管依次加入AMK原液(100 mg/mL)1 638.4、819.2、409.6、204.8、102.4、51.2、25.6、12.8、6.4 μL,用灭菌MH琼脂补齐至10 mL,混匀后倒置平板备用。取2 μL稀释好的菌液依次点种于各琼脂平板上,每株菌在各平板上接种2个点,37 ℃电热恒温培养箱中培养8 h后观察细菌生长情况,并在菌落中滴加5 μL的MTT以读取该药物的MIC值。所有实验均重复3次。
1.3.4SH与AMK联用的MIC值测定 (1)微量肉汤稀释法:根据单药测得的MIC值,SH以2倍MIC、AMK以1倍MIC为最高浓度,分别按倍比稀释配制6个系列水平。取无菌的96孔板,按棋盘法设计将药物两两组合加入各孔中(SH 80 μL、AMK 10 μL),再加入10 μL菌液,并用MH肉汤补足至100 μL。(2)琼脂稀释法:根据单药的MIC值,SH水平梯度设为MIC、1/2MIC、1/4MIC、0,AMK水平梯度设为MIC、1/2MIC、1/4MIC、1/8MIC、1/16MIC、1/32MIC、0,分别配制两种药物各水平组合共28个琼脂平板。其余操作方法同1.3.3,所有实验均重复3次。分别记录最佳组合效应时两种药物联用时各自的MIC值及两种药物单用时的MIC值。计算出部分抑菌浓度指数(FICI)=MICSH联合/MICSH单用+MICAMK联合/MICAMK单用。判读标准:FICI≤0.5为协同作用;0.5
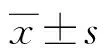
2 结 果
2.1单用SH、AMK的MIC值 微量肉汤稀释法:10株MDR-AB及质控菌株单用SH的MIC值为1 200~2 800 μg/mL,单用AMK的MIC值为8 192 μg/mL。琼脂稀释法:10株MDR-AB及质控菌株单用SH的MIC值为2 400 μg/mL,单用AMK的MIC值为16 384 μg/mL。见表1。
2.2SH与AMK联用的MIC值 结果显示,SH与AMK联用后AMK的MIC值降低至单用时的1/2,FICI值均处于>0.5~1.0,表现出“相加”的抗菌作用。见表1。当SH(MIC)单用时无细菌生长,与AMK联用时可见细菌生长,表明SH与AMK联用后可能存在促进细菌生长的作用。见图1、2。此外,根据酶标仪所测得SH(1/2 MIC)与AMK系列水平联用后的A值计算出10株菌的平均抑制率,结果显示,与单用AMK相比,SH与AMK(<1 024 μg/mL)联用时的抑制率降低,SH与AMK(≥1 024 μg/mL)联用时抑制率升高,且两者的差异有统计学意义(P<0.05)。见表2。
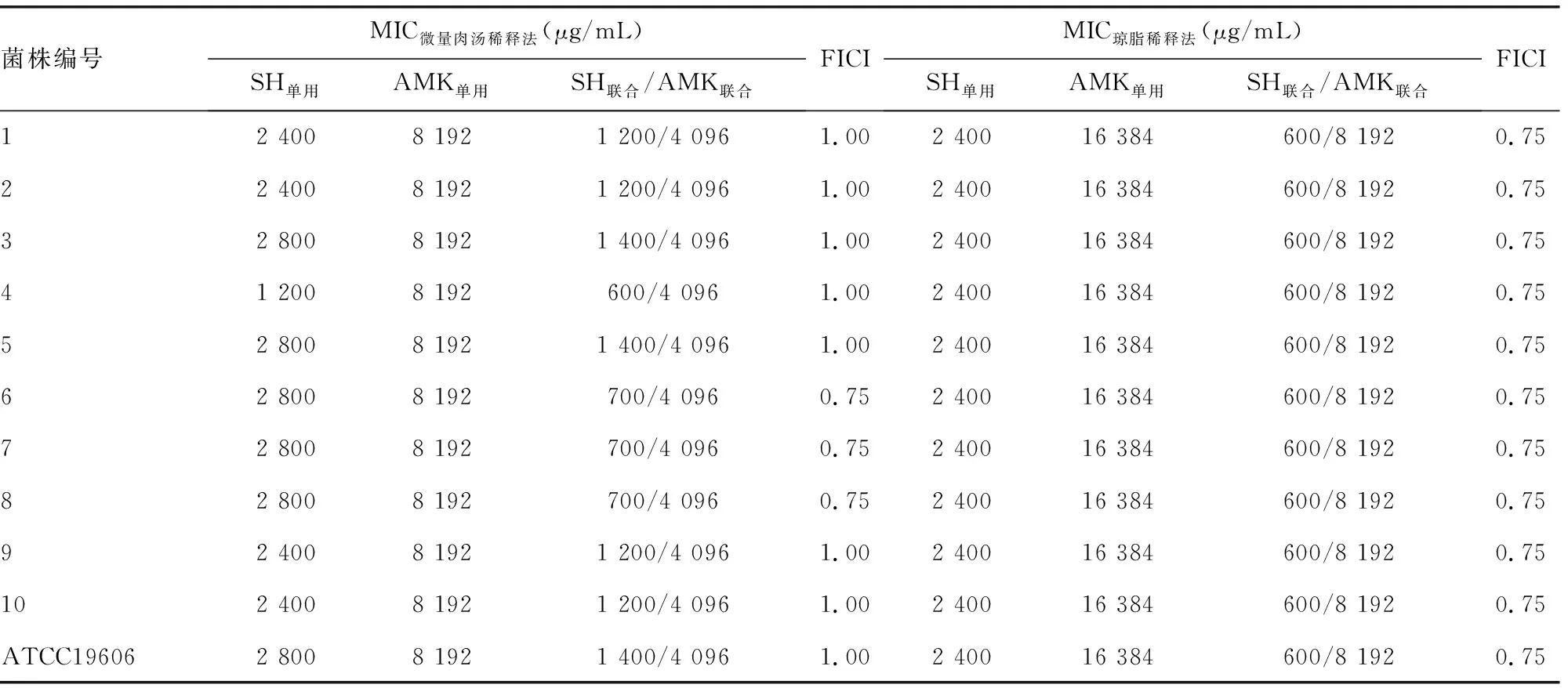
表1 SH、AMK单用及联用时检测MDR-AB的MIC值和FICI值

注:黑色代表有菌落生长。
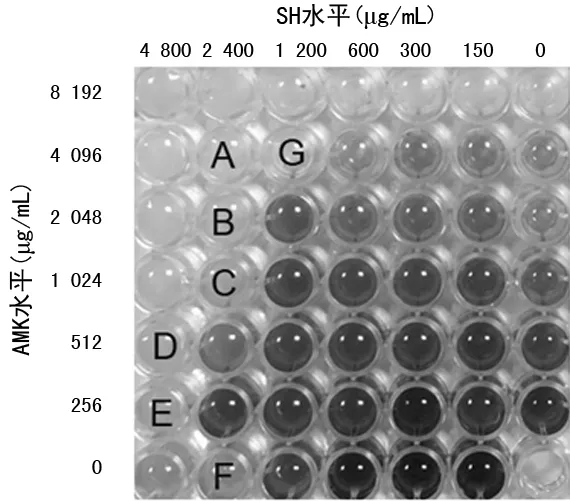
注:A、B、C、D、E、F、G均未见细菌生长,G为最佳抑菌浓度组合,FICI=1/2+1/2=1。
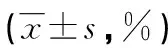
表2 不同水平AMK单用及与SH(1/2 MIC)联用时的平均抑制率比较
3 讨 论
鲍曼不动杆菌是导致医院内感染的主要革兰阴性杆菌之一,可能与患者住院时间长、接受侵入性操作及使用广谱抗菌药物有关。有关共识指出,针对MDR-AB感染可选用头孢哌酮/舒巴坦、氨苄西林/舒巴坦、碳青霉烯类抗菌药物,同时联合氨基糖苷类或喹诺酮类抗菌药物进行治疗[9]。随着MDR-AB、CR-AB的检出率逐渐升高,且对常用抗菌药物呈高度耐药性,多种药物的联用为鲍曼不动杆菌的治疗提供了新方案。AMK作为一种新型半合成氨基糖苷类抗菌药物,常用于鲍曼不动杆菌的治疗,当与其他抗菌药物,如替加环素、头孢哌酮钠/舒巴坦联用后的治疗效果更佳[2,10]。
近年来,相关研究发现SH对金黄色葡萄球菌、铜绿假单胞菌、白色念珠菌等都具有一定的抑菌作用[5-7],但对鲍曼不动杆菌是否具有抑菌作用少有报道。本研究中10株MDR-AB对SH的MIC值为1 200~2 800 μg/mL,表明SH能够在体外抑制MDR-AB,但是其单独使用的抗菌活性相对较低。MDR-AB对AMK也表现出较高的耐药性,与KUTI等[11]报道的结果一致,可见单用AMK对MDR-AB的治疗效果欠佳。因此,本研究进一步探讨SH能否增强AMK的抗菌作用,实验结果表明,当SH与AMK联用后表现出“相加”的抗菌作用。值得注意的是,从表2中可见SH与AMK(<1 024 μg/mL)联用时的抑制率低于单用AMK,表明两种药物联用后可能存在促进细菌生长的作用,导致上述现象的原因值得进一步探讨。
鲍曼不动杆菌对AMK的耐药机制包含以下几点:(1)鲍曼不动杆菌产生氨基糖苷类修饰酶(AMEs),编码的相关基因大多位于质粒转座子上,导致耐药基因在细菌间传播,并通过上述酶修饰、改变氨基糖苷类抗菌药物的活性,此为最主要的耐药机制;(2)产生16S rRNA甲基化酶,能够使细菌的30S rRNA亚单位上的16S rRNA位点甲基化,从而改变氨基糖苷类抗菌药物的作用靶点;(3)外排泵作用,通过促进药物外排来降低细胞内氨基糖苷类抗菌药物的浓度;(4)影响细菌细胞膜,即通过减少脂多糖所带的负电荷和下调孔蛋白的表达来阻止药物进入细胞[12]。目前报道SH主要是通过抑制细菌生物被膜的形成来达到抗菌作用[3-4],但是较少见AMK影响细菌生物被膜的相关报道。AMK因使用剂量不同而表现出不同的耐药机制的相关报道较少。本研究中,与单用AMK比较,SH与AMK联用后的抑制率先降低后升高的具体机制仍不清楚,笔者认为SH可能通过抑制细菌生物被膜、氨基糖苷类修饰酶、16S rRNA甲基化酶、外排泵的表达来达到抗菌作用。因此,后续研究将进一步对其抗菌机制深入探讨。
综上所述,SH能够在体外抑制MDR-AB,与单用AMK相比,联用后随着AMK水平的升高其抗菌作用先降低后升高。因此,建议使用AMK治疗的患者应合理选择食用鱼腥草及相关制剂。
