腐植酸对干旱胁迫下谷子幼苗叶片抗坏血酸-谷胱甘肽循环的影响
2021-05-13王玉国郭平毅原向阳
申 洁 王玉国 郭平毅 原向阳
(1长治学院生物科学与技术系,046011,山西长治;2山西农业大学农学院,030801,山西太谷)
据统计,全球每年因干旱导致的粮食减产占减产总量的50%以上,干旱成为影响粮食作物生长、产量及分布的最主要非生物胁迫之一[1-2]。谷子[Setariaitalica(L.) Beauv.]被誉为“五谷之首”,营养价值高,是我国北方旱作农业的主要粮食作物之一[3]。谷子具有基因组小、生长周期短及耐瘠耐旱性强等特点,是禾本科作物抗性机理研究的模式植物[4]。谷子虽然耐旱,但干旱仍然是制约其发展的重要因素之一。
近年来,应用外源物质缓解或减轻植物干旱胁迫已成为植物抗旱性研究的热点。腐植酸(humic acid,HA)是一类成分复杂的天然有机物,能通过根、茎和叶进入植物体,可提高植物光合作用,促进生长发育[5],改善形态生理特征,在缓解多种逆境对作物的胁迫中发挥重要作用[6-8]。因此,研究腐植酸对干旱胁迫下谷子幼苗叶片抗坏血酸-谷胱甘肽循环(ascorbate-glutathione cycle,AsA-GSH)的影响对探索提高谷子抗旱的途径具有重要意义。
腐植酸可通过控制植物体内活性氧类物质的含量来协助植物抵御逆境胁迫[9]。适宜浓度的黄腐酸钾可提高玉米细胞保护酶含量,降低丙二醛含量和膜脂过氧化程度,增加膜的稳定性,提高植物抗旱性[10]。李英浩等[11]研究表明,腐植酸可缓解干旱胁迫对燕麦光合系统Ⅱ(PSⅡ)光反应系统产生的伤害。关于腐植酸缓解谷子干旱胁迫的研究表明,腐植酸主要通过保持植物体内水分含量及提高PSⅡ和光合系统Ⅰ(PSⅠ)的实际光化学速率来促进光合作用,诱导渗透调节物质产生,提高抗氧化系统的作用,以提高谷子抗旱性,降低干旱对质膜的损伤,从而有效缓解干旱胁迫对谷子的伤害[12]。AsA-GSH是植物清除活性氧(ROS)的酶促系统,在植物抵抗逆境胁迫方面发挥着重要作用[13]。目前,腐植酸在农业领域应用广泛,但针对谷子方面的研究较少,腐植酸能否调控干旱胁迫下AsAGSH循环代谢,从而缓解干旱胁迫带来的损伤,目前尚不明确。本试验研究腐植酸对干旱胁迫下谷子幼苗叶片AsA-GSH循环中抗氧化物质及相关代谢酶活性的影响,探讨干旱胁迫下腐植酸调控AsAGSH循环代谢的机理,旨在为缓解干旱胁迫对植物的伤害提供新途径。
1 材料与方法
1.1 试验材料与试剂
供试谷子品种为普通优质谷子晋谷21号(由山西省农业科学院经济作物研究所提供)和杂交高产谷子张杂10号(由河北省张家口市农业科学院提供)。
腐植酸(C9H9NO6)分子量227.17,由山东西亚化学工业有限公司生产;泥炭土有机基质由丹麦品氏托普(集团)公司生产。
1.2 试验设计
试验于2018年6-8月在山西农业大学化学除草与化学调控实验室及露天天台进行。设置腐植酸处理浓度0、50、100、200和300mg/L(分别用T0、T1、T2、T3和T4表示),进行干旱胁迫,用不同浓度HA浸种12h,以蒸馏水浸种、不进行干旱胁迫为对照(CK)。浸种结束后,将种子置于滤纸上自然风干。
采用完全随机设计,将浸种后的晋谷21号和张杂10号均匀播种于装有基质的营养钵(13cm×15cm)中,每个处理重复3次,置于露天天台上自然生长,并用遮阳网进行50%遮阴保护。种子萌发后,每盆定植6株,每天正常浇水以确保幼苗正常生长,待幼苗长至3~5叶期时停止浇水(CK正常浇水),进行干旱胁迫处理(自然干旱),胁迫10d后测定各指标。利用土壤水分测定仪TDR300(Spectrum,美国)测定干旱10d的基质含水量,为19.30%。
1.3 测定项目及方法
参照Nakano等[14]的方法测定抗坏血酸过氧化物酶(APX)活性;参照金梦阳等[15]的方法测定谷胱甘肽还原酶(GR)活性;参照Hoque等[16]的方法测定单脱氢抗坏血酸还原酶(MDHAR)活性;参照Doulis等[17]的方法测定脱氢抗坏血酸还原酶(DHAR)活性;参照Jiang等[18]的方法测定还原型抗坏血酸(AsA)和氧化型抗坏血酸(DHA)含量;参照Nagalakshmi等[19]的方法测定还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)含量。
1.4 数据统计分析
利用Microsoft Excel 2010软件进行数据处理及作图,采用DPS 6.5软件进行数据统计分析,采用Duncan新复极差法进行差异显著性检验(α=0.05),图表中数据均以平均值±标准误表示。
2 结果与分析
2.1 腐植酸对干旱胁迫下谷子幼苗叶片AsA-GSH循环相关代谢酶活性的影响
由图1可知,干旱胁迫显著提高了晋谷21号幼苗叶片的APX、GR、MDHAR和DHAR活性,其中张杂10号的APX和DHAR活性分别较CK显著提高9.45%和10.12%,而MDHAR活性与CK相比无显著差异。随着HA浓度的增加,2个品种的APX、GR、MDHAR和DHAR活性均呈先升高后降低的趋势,T2处理的酶活性最强,张杂10号叶片T2处理的APX活性较T0增加了12.61%,差异显著;HA处理显著提高了2个品种的DHAR活性,其中晋谷21号和张杂10号T2处理分别较T0提高了15.20%和16.19%。这表明适宜浓度的HA处理可提高谷子幼苗抗氧化酶活性,可有效缓解了干旱胁迫对谷子的伤害。
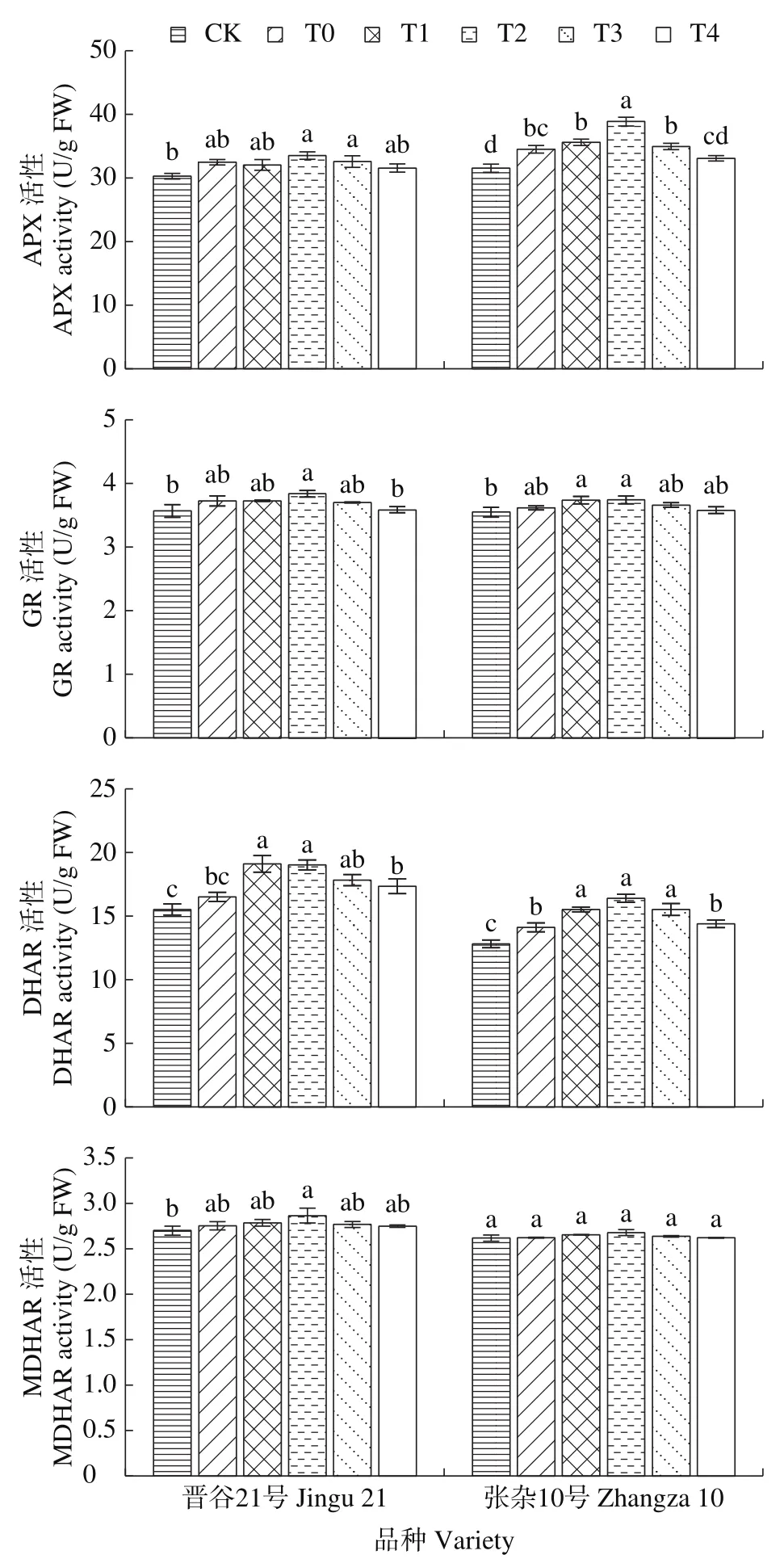
图1 腐植酸对干旱胁迫下谷子幼苗叶片APX、GR、MDHAR和DHAR活性的影响Fig.1 Effects of HA on APX, GR, MDHAR and DHAR activities in foxtail millet seedling leaves
2.2 腐植酸对干旱胁迫下谷子幼苗叶片抗坏血酸含量的影响
由表1可知,干旱胁迫显著提高了晋谷21号和张杂10号谷子幼苗叶片的还原型抗坏血酸(AsA)和总抗坏血酸(T-AsA)含量,其中AsA含量分别较CK增加了1.12和1.03倍,T-AsA含量分别增加了24.74%和44.65%。随着HA浓度的提高,2个品种的AsA和T-AsA含量基本呈先升高后降低的趋势,晋谷21号的AsA含量在T3处理时最高,较T0显著增加了14.84%,T-AsA含量在T2处理时最高,较T0显著增加了16.31%;张杂10号的AsA和T-AsA含量均在T2处理时最高,分别较T0显著增加了33.00%和17.27%。干旱胁迫下,HA对晋谷21号和张杂10号幼苗叶片DHA含量的影响相对较小,分别在T2和T3处理时DHA含量最高。
干旱胁迫下,谷子幼苗叶片AsA/DHA值显著增加,2个品种分别较CK增加了1.65和0.91倍。适宜浓度的腐植酸可提高AsA/DHA值,晋谷21号在T3处理时较T0显著增加了29.49%,张杂10号在T2处理时较T0增加了36.28%,且差异均显著(表 1)。
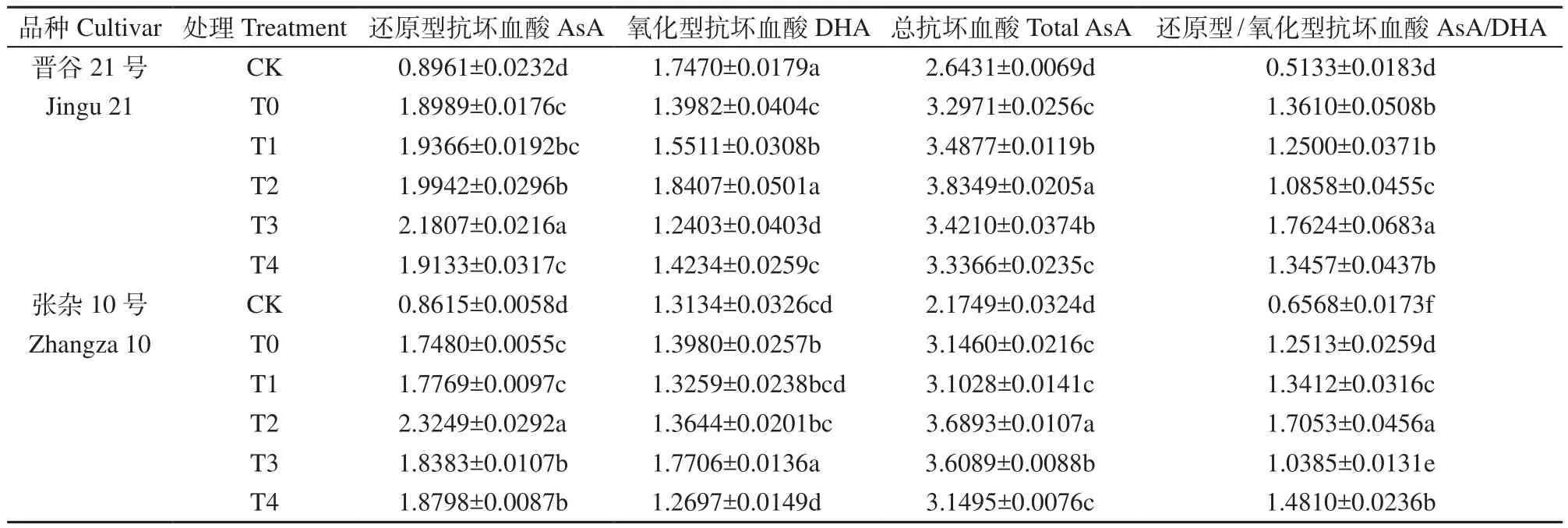
表1 腐植酸对干旱胁迫下谷子幼苗抗坏血酸含量的影响Table 1 Effects of HA on ascorbic acid contents in the seedlings of foxtail millet under drought stress nmol/µg FW
2.3 腐植酸对干旱胁迫下谷子幼苗叶片谷胱甘肽含量的影响
由表2可知,干旱胁迫下,晋谷21号和张杂10号谷子幼苗叶片GSH、GSSH和总谷胱甘肽(T-GSH)含量较CK均显著增加。随着HA浓度的增加,GSH和T-GSH含量出现上升的趋势,晋谷21号在T2处理下含量最高,GSH和T-GSH分别较T0增加1.35%和1.14%,且差异显著;张杂10号的GSH和T-GSH含量分别在T3和T2处理下最高,分别较T0显著增加1.38%和1.04%,随后开始下降,呈现先上升后下降的趋势,而HA处理下谷子幼苗叶片GSSG含量较T0无显著差异(除了张杂10号T3处理)。
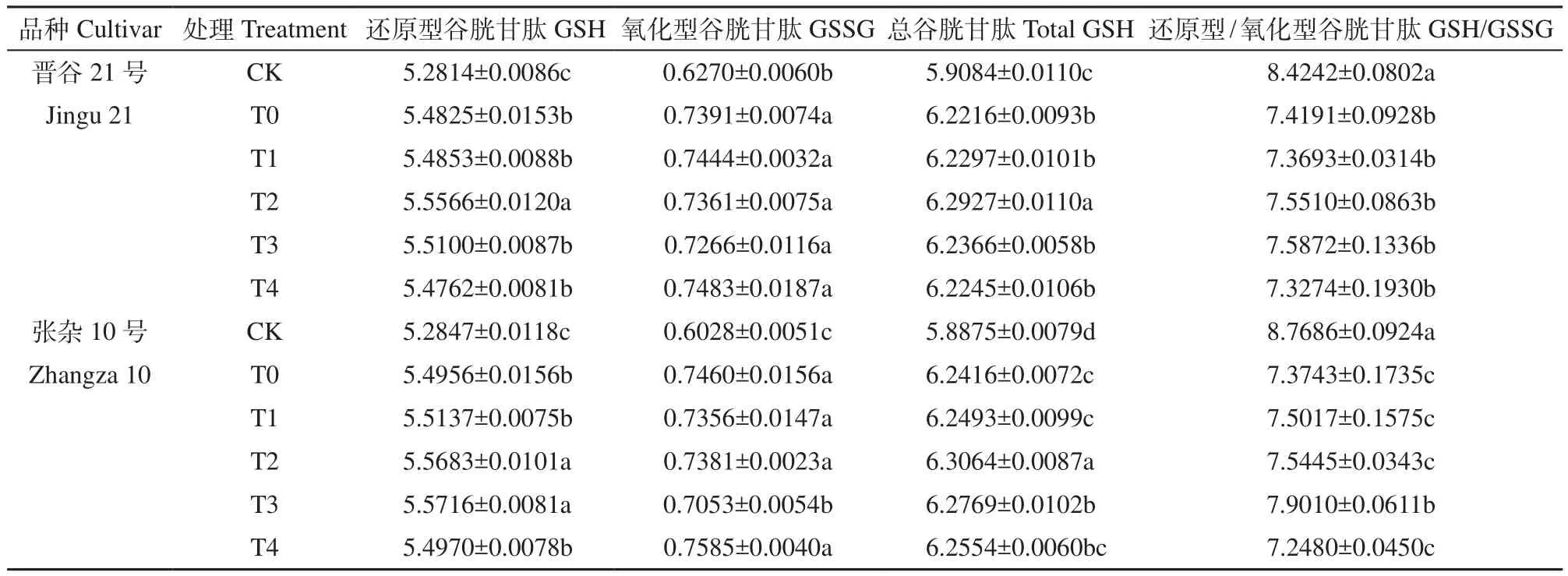
表2 腐植酸对干旱胁迫下谷子幼苗谷胱甘肽含量的影响Table 2 Effects of HA on glutathione contents in the seedlings of foxtail millet under drought stress nmol/mg FW
干旱胁迫下2个品种的GSH/GSSG值较CK显著降低,随着HA浓度的增加,GSH/GSSG值基本呈先上升后下降的趋势,2个品种的GSH/GSSG值均在T3处理时最大,分别较T0增加2.27%和7.14%,其中张杂10号差异达显著水平(表2)。
3 讨论
干旱使植物体内积累大量的O1、O2·、H2O2和·OH等活性氧(ROS)物质,造成膜脂过氧化,而植物为适应环境的改变,在漫长的进化过程中形成了抵抗ROS氧化毒害的抗氧化系统,精准调节植物体内的ROS代谢,从而维持或重建氧化还原平衡[20-21]。
AsA-GSH循环系统作为植物体内抗氧化系统的重要机制,是清除ROS的重要途径。APX、GR、MDHAR和DHAR是AsA-GSH循环系统的关键酶,对循环系统中抗氧化物质AsA和GSH的再生及循环的有效运转具有重要作用[22]。研究表明,HA可促进干旱胁迫下玉米[10]和甘蔗[23]活性氧的早期积累,并有效激活保护酶超氧化物歧化酶、过氧化物酶、APX和GR的活性。本研究中,干旱胁迫提高了晋谷21号和张杂10号的APX、GR、MDHAR和DHAR活性,这与董守坤等[24]的研究结果一致,杂交谷清除活性氧能力显著高于常规谷,说明杂交谷具有较强的抗旱性,充分体现了杂种优势。HA提高了谷子APX、GR、MDHAR和DHAR活性,尤其对APX和DHAR活性作用更明显,表明适宜浓度的HA处理可提高谷子幼苗AsA-GSH循环系统相关酶活性,从而促进干旱胁迫下谷子幼苗AsA-GSH循环的有效运转,缓解干旱胁迫对谷子的伤害。
AsA和GSH是AsA-GSH循环系统中主要的抗氧化物质,可抵御植物细胞活性氧造成的氧化胁迫[25],维持体内抗氧化系统的稳态[26]。AsA和GSH含量及其氧化还原状态的改变是植物应对胁迫的一种生理性调节[27],AsA、GSH含量及AsA/DHA、GSH/GSSH值的提高可维持细胞内抗氧化系统的平衡,从而减缓胁迫对植物造成的伤害[28]。本研究表明,干旱胁迫可显著提高谷子幼苗叶片中AsA、T-AsA、GSH、T-GSH含量及AsA/DHA值,降低GSH/GSSH值,这与郑清岭等[29]的研究结果一致。通过添加外源物质可提高抗氧化物质含量,从而缓解膜脂过氧化,本研究表明,腐植酸显著提高了谷子叶片AsA、T-AsA、GSH、T-GSH含量以及AsA/DHA值,减缓了GSH/GSSH值的降低,使GSH/GSSH值升高,这与外源物质减轻秋茄[30]和茶树[31]逆境胁迫伤害的研究结果一致。但也有研究表明外源物质可抑制逆境胁迫下AsA和GSH含量的升高[32],这可能与逆境胁迫类型、胁迫强度(时间长短)和试验材料等有关。本课题组前期研究表明,HA缓解和清除了干旱胁迫导致的ROS积累[12],这可能由于HA提高了AsA-GSH循环系统相关酶活性、抗氧化物质含量以及提高了AsA/DHA和GSH/GSSH值,从而使AsA-GSH循环系统有效运转,这与刘建新等[22]研究外源物质缓解燕麦逆境胁迫的结果一致。
4 结论
HA可提高干旱胁迫下APX、GR、MDHAR和DHAR活性,促进抗氧化物质AsA和GSH再生,使AsA/DHA和GSH/GSSH值增加,从而有效清除干旱胁迫引起的ROS积累,降低干旱胁迫对植物细胞膜的氧化损伤,有效缓解干旱胁迫对谷子幼苗生长的伤害。
