猪繁殖与呼吸综合征病毒GP5蛋白的原核表达及鉴定
2021-05-13秦义娴高金源周飞燕吴华伟
秦义娴,刘 丹,高金源,周飞燕,吴华伟*
(1. 中国兽医药品监察所,北京100081; 2. 武汉科前生物股份有限公司,武汉 430070)
猪繁殖与呼吸综合征是由猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus, PRRSV)引起的以母猪繁殖障碍和各日龄猪只呼吸道疾病为特征的病毒性传染病[1]。该病自1987年在北美首次报道以来[2],已蔓延至大部分国家和地区,给全球养猪业造成极大经济损失,我国也不例外。
PRRSV属于动脉炎病毒科动脉炎病毒属,基因组为不分节段的单股正链RNA,全长约15 kb,包含10个开放阅读框(ORFs),其中ORF5、ORF6和ORF7分别编码病毒的主要结构蛋白GP5、M和N[3]。GP5蛋白作为病毒的主要糖基化结构蛋白,具有较好的免疫原性,能够诱导机体产生中和抗体,而且其诱导的抗体中和能力强于GP4诱导产生的抗体[4-5]。GP5与M蛋白可形成GP5/M异源二聚体,对病毒装配起重要作用,并介导病毒吸附宿主细胞过程[6-7]。此外GP5蛋白又是PRRSV变异最大的结构蛋白,基因1型与2型间GP5的氨基酸序列相似性为52%~57%,同型毒株间氨基酸序列相似性为88%~99%[8-9]。这些都使得GP5蛋白成为发展新型疫苗和诊断试剂的良好候选蛋白。本研究以原核表达系统成功表达了NADC30-like毒株PRRSV 46D的GP5蛋白,并对其进行鉴定与纯化,以期为下一步GP5单克隆抗体的制备奠定物质基础。
1 材料与方法
1.1 细胞、毒株、表达载体 Marc-145细胞、PRRSV 46D(NADC30-like毒株)、pCold-TF表达载体,均由中国兽医药品监察所保存。
1.2 主要试剂 Rossetta (DE3)、Top10感受态细胞购于博迈德生物;病毒RNA提取试剂盒,质粒小提试剂盒购于北京天根生物公司;BamH I、Hind Ⅲ、T4 DNA连接酶、KOD酶高保真PCR试剂盒、反转录试剂盒、DNA Marker、Protein Marker购于TaKaRa公司;DNA纯化回收试剂盒购于北京百泰克生物技术有限公司;pEasy-Blunt Simple Cloning Kit购于北京全式金公司;SDS-PAGE凝胶制备试剂盒购于碧云天生物技术有限公司;PRRSV阳性血清由实验室保存;HRP标记的兔抗猪IgG为Sigma公司产品。
1.3 ORF5基因原核表达载体的构建及表达
1.3.1 引物的设计与合成 根据GenBank上发表的PRRSV NADC30-like毒株序列设计一对针对ORF5基因的特异性引物,上游引物ORF5-F为5’-ATGTTGGGGAAGTGCTTGAC-3’,下游引物ORF5-R为5’-CTAGAGATGACCCATCGTT-3’,预期扩增长度为603 bp。在上下游引物上分别添加BamH I和Hind III酶切位点,即5’-CGGGATCCATGTTGGGGAAGTGCTTGAC-3’和5’-CCAAGCTTCTAGAGATGACCCATCGTT-3’,引物由北京六合华大基因科技股份有限公司(后简称华大基因)合成。
1.3.2 ORF5基因的克隆及序列测定 按照病毒RNA提取试剂盒说明书提取PRRSV 46D毒株的RNA,反转录为cDNA,再以KOD高保真酶进行PCR扩增,回收目的片段后与pEasy-Blunt Cloning 载体连接,转化入Top10感受态细胞,挑取菌落于2 mL LB培养液中37 ℃振荡培养16 h,进行PCR鉴定,取鉴定正确的菌液送华大基因测序。将测序正确的菌液保菌并提取质粒,质粒命名为pEasy-Blunt-GP5。
1.3.3 重组质粒的构建 以pEasy-Blunt-GP5质粒为模板,应用含酶切位点的引物和KOD高保真酶进行PCR扩增,回收含酶切位点的目的片段。与pCold-TF原核表达载体同时进行BamH I/Hind III双酶切,回收后进行连接,连接体系为:载体2 μL,目的片段6 μL,10×T4 Buffer 1 μL,T4 DNA连接酶1 μL。16 ℃,连接1 h。转化,挑取菌落,于5 mL LB培养液中37 ℃振荡培养16 h,小提质粒,将质粒命名为pCold-TF-GP5。将重组质粒按照下述体系进行双酶切:质粒3 μL,10×Cusamart Buffer 1 μL,BamH I/Hind III各0.5 μL,ddH2O 5 μL。1%琼脂糖凝胶电泳鉴定,将鉴定正确的质粒送华大基因测序。
1.3.4 重组质粒的诱导表达 将测序正确的重组质粒0.5 μL转化100 μL Rosetta DE3感受态细胞,挑菌于2 mL含100 μg/mL Amp的LB培养液中37 ℃振荡培养12 h,获得种子菌。按1∶100(V/V)接种于3 mL LB培养液中,37 ℃,200 r/min培养。培养至OD=0.6,加入IPTG(1 mmol/L)诱导,37 ℃,200 r/min培养4 h。
1.4 PRRSV GP5重组蛋白的鉴定
1.4.1 SDS-PAGE 取1 mL诱导的菌液,12000 r/min,离心2 min,弃上清,沉淀用100 μL PBS(1/15 mol/L,pH7.2)吹散,加入25 μL 5×SDS-PAGE上样缓冲液,煮沸10 min,12000 r/min离心2 min,取上清进行SDS-PAGE检测,同时设置空载体对照及未诱导对照。
1.4.2 Western blot 按1.4.1方法进行SDS-PAGE后,转印至 0.45 μm PVDF膜,PBST洗涤3次,加入5%W/VPBST脱脂牛奶室温封闭1 h。加入1∶100稀释的PRRSV阳性血清室温孵育1 h。PBST洗涤5次。加入1∶10000稀释的HRP标记的兔抗猪IgG室温孵育1 h。PBST洗涤5次。依照DAB显色试剂盒操作说明,进行避光显色,流水终止显色。
1.5 重组蛋白的大量表达及表达形式的检测 接2 μL活化的菌液到20 mL LB液体培养基中,200 r/min 37 ℃培养。将培养的菌液转接到1000 mL LB液体培养基中,200 r/min 37 ℃培养至OD=0.6,IPTG(0.5 mmol/L)16 ℃诱导过夜。6000 r/min,离心5 min,弃上清。菌体用30 mL 10 mmol/L Tris-HCl(pH8.0)溶液吹散,超声波破碎(500 W,60次,每次10 s,间隔15 s)。取100 μL超声后的菌悬液,12000 r/min离心10 min,取50 μL上清至另一EP管,上清去除干净后沉淀用50 μL 10 mmol/L Tris-HCl(pH8.0)溶液吹散。SDS-PAGE电泳检测表达形式。
1.6 重组蛋白的纯化 用去离子水洗镍柱,至pH7.0。挂镍,至pH 2~3。用去离子水洗柱至pH7.0。用100 mL 10 mmol/L Tris-HCl(pH8.0)溶液平衡镍柱。用50 mL含0.5 mol/L氯化钠的10 mmol/L Tris-HCl(pH8.0)8 mol/L尿素的溶液平衡镍柱。稀释样品,使样品含氯化钠终浓度为0.5 mol/L,上样。上样结束后,用含0.5 mol/L氯化钠的10 mmol/L Tris-HCl(pH8.0)溶液洗柱。分别用含15 mmol/L咪唑、60 mmol/L咪唑、300 mmol/L咪唑的10 mmol/L Tris-HCl(pH8.0,含0.5 mol/L氯化钠)溶液洗脱,分别收集蛋白峰。SDS-PAGE电泳检测蛋白纯化效果。
2 结果与分析
2.1 ORF5基因的扩增、克隆及序列测定 应用设计的特异性引物ORF5-F和ORF5-R对PRRSV 46D毒株进行PCR扩增,得到一条长度约为603 bp的目的条带(图1),与预期片段大小一致。将目的片段克隆至pEasy-Blunt Cloning载体后测序得到该基因的正确序列。
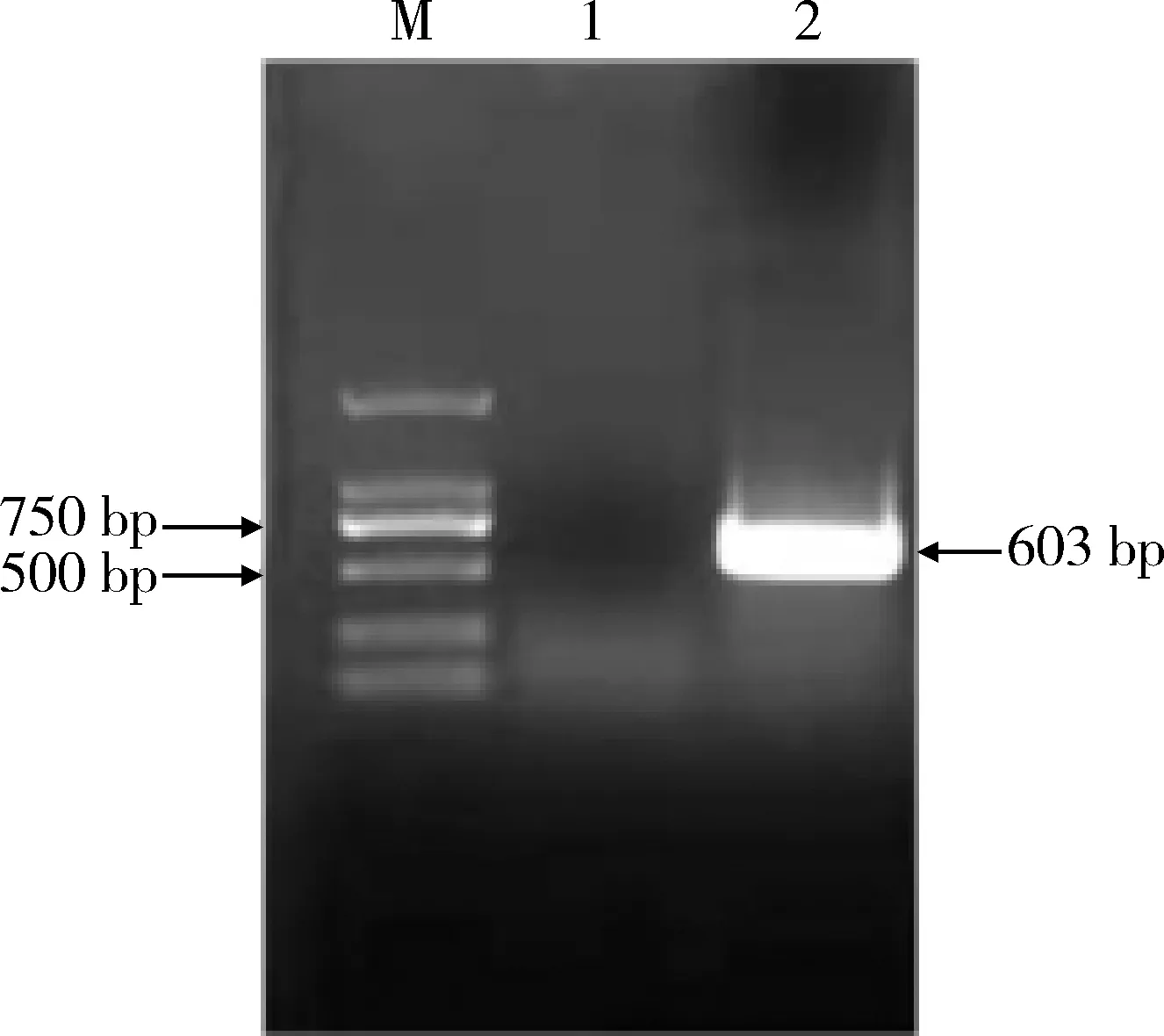
M. DNA标准DL2000;1.阴性对照;2.PCR产物M. DNA Marker DL 2000; 1. Negative control; 2. PCR products图1 PRRSV ORF5基因的PCR扩增Fig 1 PCR amplificaiton of PRRSV ORF5 gene
2.2 重组质粒pCold-TF-GP5的双酶切鉴定 对构建的重组质粒pCold-TF-GP5进行双酶切鉴定。结果显示,大小5769 bp左右的条带为切开的载体片段,大小619 bp左右的条带是目的片段(图2)。
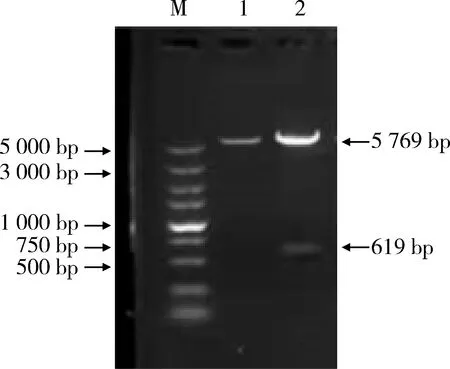
M. DNA标准DL5000; 1. pCold-TF 空载体;2. pCold-TF-GP5重组质粒M. DNA Marker DL 2000; 1. pCold-TF control;2. pCold-TF-GP5 recombinant plasmid图2 重组质粒pCold-TF-GP5的双酶切鉴定Fig 2 Identification of recombinant plasmid pCold-TF-GP5 by double enzyme digestion
2.3 pCold-TF-GP5重组蛋白的SDS-PAGE分析 取1 mL诱导表达的菌液进行SDS-PAGE,结果在72 ku处可见表达条带,与预期蛋白大小一致(图3)。
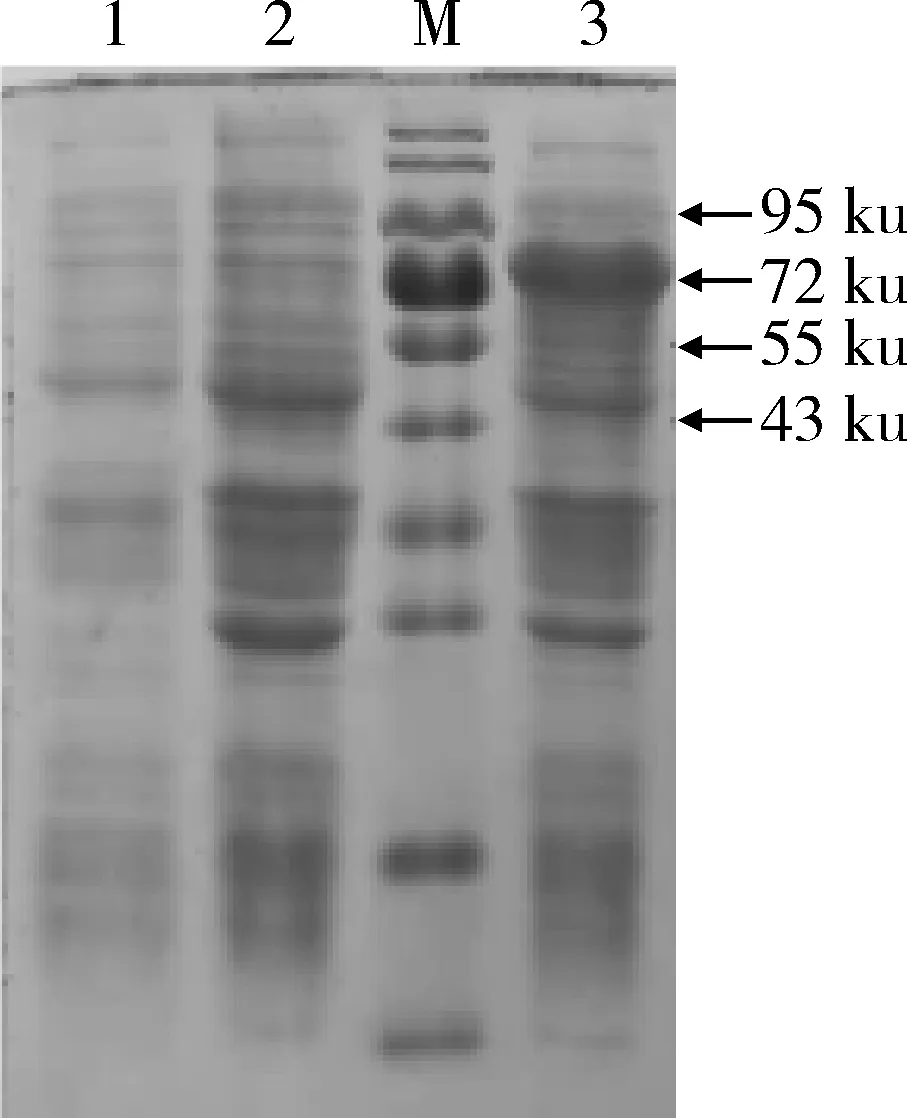
M.蛋白分子质量标准;1.pCold-TF空载体;2.pCold-TF-GP5未诱导;3.pCold-TF-GP5诱导M. Protein molecular weight Marker; 1. pCold-TF control;2. pCold-TF-GP5 no induced; 3. pCold-TF-GP5 induced.图3 pCold-TF-GP5重组蛋白的SDS-PAGE鉴定Fig 3 SDS-PAGE identification of pCold-TF-GP5 recombinant proteins
2.4 pCold-TF-GP5重组蛋白的Western blot分析 DAB显色后,在72 ku处有特异性条带,而空载体对照无此特异性反应。证明构建的重组质粒在大肠杆菌表达系统中能够准确表达(图4)。

M. 蛋白分子质量标准;1. pCold-TF空载体;2. pCold-TF-GP5诱导M. Protein molecular weight Marker;1. pCold-TF control; 2. pCold-TF-GP5 induced图4 pCold-TF-GP5重组蛋白的Western blot鉴定Fig 4 Western blot identification of pCold-TF-GP5 recombinant proteins
2.5 pCold-TF-GP5重组蛋白表达形式的检测超声裂解诱导后的菌液,将菌液上清和沉淀分别进行SDS-PAGE电泳,表达的GP5蛋白主要出现在上清中,提示该蛋白在上清中表达(图5)。

M. 蛋白分子质量标准;1. 超声后全菌;2. 超声后上清;3. 超声后沉淀M. Protein molecular weight Marker; 1. Total bacteria after ultrasound;2. Ultrasound supernatant; 3. Precipitation after ultrasound图5 pCold-TF-GP5重组蛋白表达形式的SDA-PAGE检测Fig 5 Detection of expression of pCold-TF-GP5 recombinant protein by SDS-PAGE
2.6 pCold-TF-GP5重组蛋白的纯化 将表达蛋白挂镍柱后用不同浓度的咪唑(15 mmol/L、60 mmol/L、300 mmol/L)洗脱,分别收集蛋白峰,进行SDS-PAGE电泳检测,结果显示咪唑洗脱的最佳浓度为300 mmol/L。最终获得纯度较高的GP5重组蛋白,浓度为0.5 mg/mL(图6)。

M:蛋白分子质量标准;1. 蛋白原样;2:流穿;3:15 mmol/L 咪唑洗脱;4:60 mmol/L 咪唑洗脱;5-7:300 mmol/L 咪唑洗脱;8:0.5 mg/mL BSA; 9:1 mg/mL BSAM:Protein molecular weight Marker; 1:Original protein;2:Flow through; 3:15 mmol/L imidazole elution;4:60 mmol/L imidazole elution;5-7: 300 mmol/L imidazole elution;8: 0.5 mg/mL BSA; 9: 1 mg/mL BSA图6 pCold-TF-GP5重组蛋白的纯化Fig 6 Purification of pCold-TF-GP5 recombinant protein
3 讨论与结论
自1996年由郭宝清等首次从我国疑似PRRS病例中分离到PRRSV以来[10],该病已在我国存在二十余年,成为影响我国养猪业发展的重要疾病之一,特别是2006年高致病性猪繁殖与呼吸综合征的出现及2013年以来NADC30-like毒株在我国的逐步流行,使得PRRSV流行形势越来越复杂,这些都给我国养猪业带来前所未有的挑战。目前,预防PRRS主要的疫苗是弱毒苗和灭活苗,两种疫苗各有优缺点,保护效果有限,越来越多的学者试图研究新型基因工程疫苗,而GP5蛋白因其良好的免疫原性及较强的中和活性,已成为优秀的候选蛋白。
表达GP5蛋白常采用原核表达和真核表达两种方式,白晶等[11]扩增出ORF5基因后将其克隆至真核表达载体pCI-neo并转染Marc-145细胞,成功表达出目的蛋白;李志杰等[12]则将ORF5基因克隆至pCDNA3.1(+)真核表达载体,转染BHK-21细胞后获得目的蛋白的正确表达。相比于真核表达,原核表达具有操作简单、经济快捷、应用范围广等优点,且经原核表达的GP5蛋白仍具有免疫原性。因GP5蛋白含有31个氨基酸信号肽和3个跨膜功能区[13],如果将ORF5基因全长克隆至原核表达载体,蛋白表达难度较大,故目前的研究中,原核表达时构建GP5重组质粒的策略通常是将信号肽删除或将部分跨膜区去掉[14-15],但这样可能会对表达蛋白的抗原性产生影响,也不利于抗原表位的鉴定。本研究以pCold-TF为载体,转化Rosetta(DE3)表达菌,充分利用了pCold-TF作为冷休克载体可高效可溶性表达其他系统中难以表达蛋白的优点及Rosetta(DE3)可提供稀有密码子的特点,成功获得了表达PRRSV ORF5基因全长的可溶性蛋白,为下一步制备针对GP5蛋白的单克隆抗体提供了物质保障。
