针刺四神聪、风池穴对血管性痴呆模型大鼠病理形态学及PTEN、Akt表达的影响*
2021-05-13陈英华王浩宇李俊峰苏晓庆秦瑞琦孙忠人
陈英华,王浩宇,孙 玮,李俊峰,苏晓庆,秦瑞琦,孙忠人△
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040; 2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
血管性痴呆(Vascular dementia,VD)是老年人常见的神经精神障碍性疾病,指由缺血性卒中、出血性卒中以及影响记忆、认知和行为等脑区低灌注的脑血管疾病所致的一种严重认知功能障碍综合征,是仅次于Alzheimer病(Alzheimer disease,AD)的第二常见痴呆症[1]。VD具有病程长、疾病负担重和致残率高等特点,严重影响了患者及其家庭的生活质量,目前 FDA仍无批准用于治疗 VD 的药物[2-3]。现代医学主要从前期预防、后期改善为主进行治疗[4],但并不能有效地阻止神经细胞的继发性凋亡和迟发性坏死,故多数患者存在偏瘫和认知功能障碍等后遗症[5]。针刺在脑血管疾病防治临床应用上具有独特的优势,已受到医学界的公认和肯定[6-8]。本研究团队前期研究发现,针刺四神聪穴、风池穴能够抑制VD模型大鼠核因子κB(NF-κB)信号通路产生肿瘤坏死因子α(TNF-α)和白细胞介素1β(IL-1β),进而抑制神经元细胞凋亡[9]。但针刺如何调控PTEN/PI3K/Akt信号通路对血管性痴呆产生影响,迄今未见报道。本实验通过针刺VD模型大鼠的四神聪穴、风池穴,在光镜下观察针刺对VD模型大鼠海马组织病理形态学的影响,同时运用RT-PCR技术,探讨针刺对大鼠海马区PTEN、Akt表达的影响,为针刺防治VD提供科学依据。
1 材料与方法
1.1 实验动物
利用Morris水迷宫测试对168只健康的SD大鼠(体质量220±30 g,由黑龙江中医药大学实验动物中心提供)进行行为学检测,并记录大鼠对水迷宫的学习与记忆的获取能力,筛选出符合条件的大鼠。
1.2 主要仪器与试剂
1.2.1 仪器 台式离心机(型号:1-14型;德国SIGMA公司);高速冷冻离心机(型号:AVANTI J-15R;Beckman贝克曼);-20℃冰箱(型号:HYCD-282;中国青岛海尔电器有限公司);-80℃冰箱(型号:MDF-U53V;日本SANYO公司);电热恒温水浴锅(型号:HWS-24;上海一恒科学仪器有限公司);电子天平(型号:PL203;瑞士梅特勒-托利多)、台式PH计(型号:FE28;瑞士梅特勒-托利多);梯度PCR仪(型号:5331;德国Eppendorf公司);凝胶成像系统(型号:Gel Doc XR+;美国Bio-Rad公司);全自动图像分析系统(型号:Kontron IBAS 2.5;德国Kontron公司);电热恒温干燥箱(型号:DGH-9241A;宁波莱福科技有限公司);可见紫外分光光度计(型号:6010;上海安捷伦科技有限公司)。
1.2.2 试剂 TaKaRa PrimeScript RT-PCR Kit(货号:RR014B)、TaKaRa DL2 000 DNA Marker(批号:3427B),均购自中国大连宝生物工程有限公司;琼脂糖(电泳级)(批号:111860),购自西班牙BIOSCIENCE公司;DNA Green(10 000×)(批号:G7410),购自中国天泽基因工程有限公司;引物合成(批号:A035),由中国上海捷瑞生物工程有限公司提供。
1.3 动物分组
从实验样本中随机筛选30只实验大鼠,将其平均分为正常组与假手术组。同时将45只VD造模成功实验大鼠随机分为模型组、手针组和电针组各15只。
1.4 造模方法
采用4-VO制备VD大鼠模型[10]。术前大鼠禁食水。麻醉,固定,消毒,行背侧颈正中切口,分离,用电凝针于每侧翼小孔内烧灼双侧的椎动脉成永久性闭塞,手术部位予适量青霉素防感染并缝合。24 h后,麻醉,固定,消毒,行腹侧颈正中切口,分离双侧颈总动脉,以“4”号丝线穿线牵拉双侧颈总动脉用微动脉夹夹闭5 min后松开,反复夹闭3次,每隔1 h夹闭1次,造成全脑缺血。再通后,手术部位予适量青霉素抗感染后缝合。饲养观察,连续7 d注射青霉素8万U以抗感染。
1.5 干预方法
1.5.1 正常组、假手术组、模型组 不予任何治疗,只予同等条件抓取。
1.5.2 手针组 以2007年李忠仁主编《实验针灸学》[11]为参考,对样本实验大鼠左右神聪穴、风池穴进行针刺。操作方法:造模后第7天,针刺大鼠左、右神聪穴,选取0.30 mm×13 mm毫针,左、右神聪穴平刺2.5 mm,双侧风池穴斜刺5 mm,捻转1 min,中间休息1 min,进行3次,留针,治疗频率为30 min/d。以7 d为周期对实验大鼠进行相关指标观察,并记录相关数据,最后进行行为学测试,观察小鼠状态。
1.5.3 电针组 7 d后对造模组实验大鼠进行针刺操作,按照手针组操作且对应穴位一致,使用长城牌KWD-808Ⅰ型脉冲电疗仪对实验大鼠同侧穴位进行操作,选择连续波形,调节波幅大小以见到大鼠肢体微颤为宜,留针30 min,每日针刺1次。
1.6 取材
各组大鼠分别于治疗第7天、治疗第14天和治疗第21天的3个时间点进行灌注固定、大鼠断头处死,在放冰块的搪瓷盘中剪开大鼠颅骨,迅速取出脑组织,分离出海马称重,标记标本的组别和时间点,分别置于4%多聚甲醛中固定待用,进行HE染色病理形态学检测和将海马放入液氮中待测,进行RT-PCR检测。
1.7 海马区PTEN mRNA、Akt mRNA表达水平的RT-PCR检测
采用反转录-聚合酶链式反应(RT-PCR)检测,测定VD大鼠海马内PTEN、Akt 的mRNA转录表达水平。选取大鼠海马区组织100 mg并使用RNA提取试剂盒提取海马组中总RNA。对RNA进行逆转录,生成cDNA,应用Premier 5.0软件完成引物设计,同时对其扩增。以β-actin为内参进行RT-PCR,见图1。引物的序列分别为:PTEN mRNA扩增引物:上游5′gCgAgCTgTTTTTCCACCTCT 3′,下游5′TgATgTCgCggTACACCACAT3′;Akt mRNA扩增引物:上游5′CCTG GACTACTTGCACTCCg3′,下游5′CTgAgTAggAgAACTgggggA3′;β-actin扩增引物:上游5′CAACCgTgAAAAgATgACCCA3′,下游5′AATgCCAgTggTACgAC CAgA3′。

注:M:DNA Marker DL2000;1、正常组;2、假手术7 d组;3、假手术14 d组;4、假手术21 d组;5、模型7 d组;6、模型14 d组;7、模型21 d组;8、手针7 d组;9、手针14 d组;10、手针21 d组;11、电针7 d组;12、电针14 d组;13、电针21 d组。
1.8 统计学处理

2 结果
2.1 各组大鼠海马组织病理学改变
2.1.1 正常组 大鼠海马区神经细胞排列紧密,神经元形态规整,核仁清晰,有少量胶质细胞,无炎细胞浸润。
2.1.2 假手术组 各时间点大鼠海马区神经细胞排列较紧密,神经元形态尚规整,核仁清晰,胶质细胞数目有所增多,散见少量凋亡小体和炎细胞。
2.1.3 模型组 各时间点大鼠海马区神经细胞排列紊乱,神经元形态欠规整,核仁不清晰,胶质细胞数目明显增多,可见大量神经元凋亡小体和炎细胞。其中尤以第21天表现最为明显。
2.1.4 手针组和电针组 经过手针和电针治疗后,大鼠海马区病理改变较模型组相应时间点有明显改善。主要表现为神经细胞排列较规整,核仁较清晰,胶质细胞数目有所减少,凋亡小体和炎细胞数量有所减轻。这种改变随治疗时间的延长而表现更为明显,表明针刺可以减少炎性浸润,抑制神经元凋亡,减轻神经细胞病理变化,从而起到改善学习记忆的作用。见图2。

图2 各组治疗第7 d、14 d、21 d大鼠海马组织HE染色
2.2 各组大鼠海马区PTEN mRNA比较
与正常组、假手术组相比较,模型组大鼠在治疗第7天、治疗第14天和治疗第21天各时点PTEN mRNA均明显升高(P<0.01);与模型组比较,手针组、电针组大鼠在治疗第7天、治疗第14天、治疗第21天各时点PTEN mRNA明显降低(P<0.05或P<0.01);与手针组比较,电针组大鼠在治疗第14天、治疗第21天时点PTEN mRNA降低更为显著(P<0.05)。见表1、图3。

表1 各组大鼠海马组织中不同时间PTEN mRNA相对表达量比较

注:M:DNA Marker DL2000;1、正常组;2、假手术7 d组;3、假手术14 d组;4、假手术21 d组;5、模型7 d组;6、模型14 d组;7、模型21 d组;8、手针7 d组;9、手针14 d组;10、手针21 d组;11、电针7 d组;12、电针14 d组;13、电针21 d组。
2.3 各组大鼠海马区Akt mRNA比较
与正常组、假手术组相比较,模型组大鼠在治疗第7天、治疗第14天和治疗第21天各时点Akt mRNA均明显降低(P<0.01);与模型组比较,手针组、电针组大鼠在治疗第7天、治疗第14天、治疗第21天各时点Akt mRNA明显升高(P<0.05或P<0.01);与手针组比较,电针组大鼠在治疗第7天、治疗第14天、治疗第21天各时点Akt mRNA升高更为显著(P<0.05或P<0.01)。见表2、图4。

表2 各组大鼠海马组织中不同时间Akt mRNA相对表达量比较
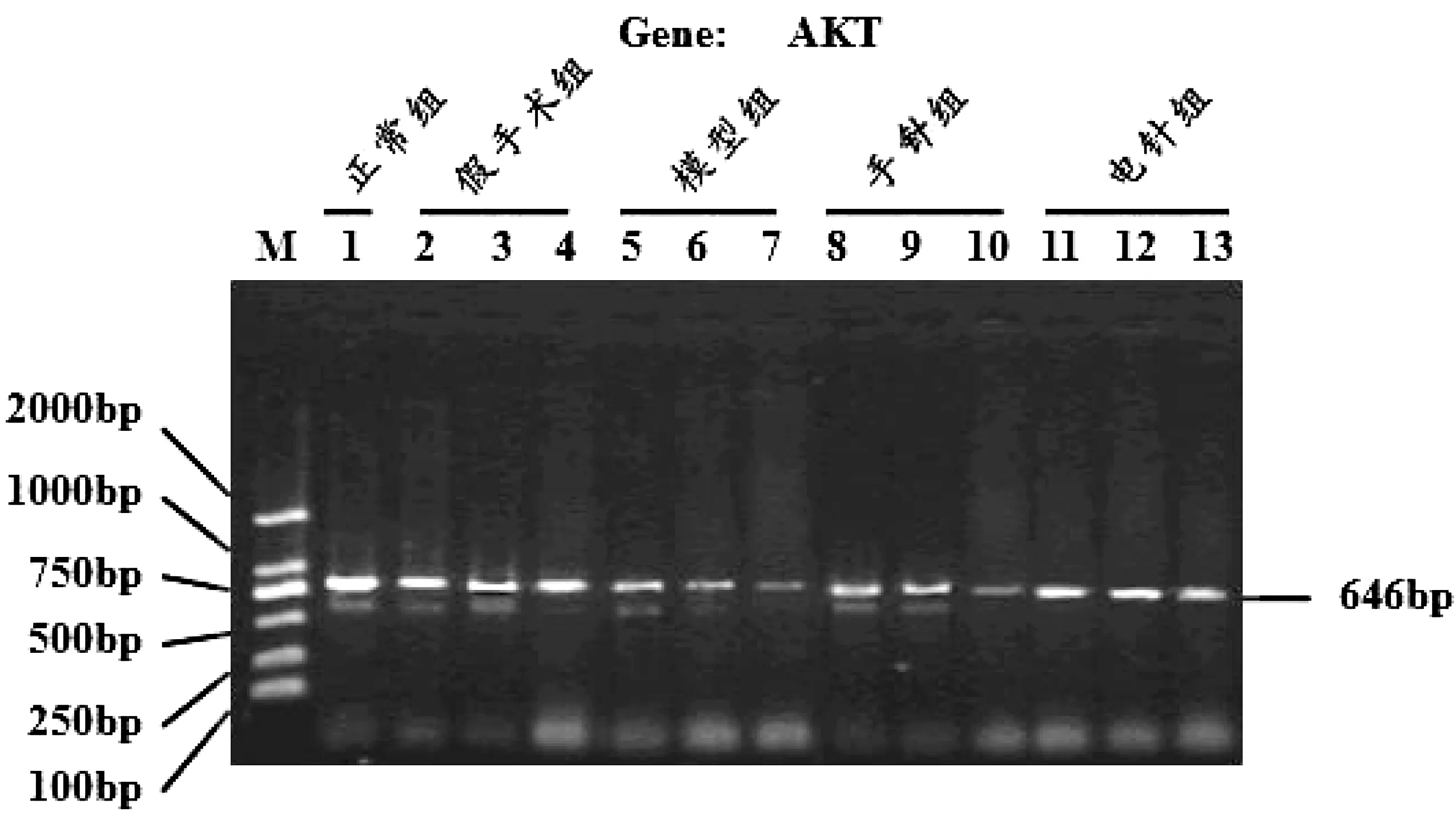
注:M:DNA Marker DL2000;1、正常组;2、假手术7 d组;3、假手术14 d组;4、假手术21 d组;5、模型7 d组;6、模型14 d组;7、模型21 d组;8、手针7 d组;9、手针14 d组;10、手针21 d组;11、电针7 d组;12、电针14 d组;13、电针21 d组。
3 讨论
VD属于中医学“健忘”“善忘”“呆病”与“文痴”等范畴[12],清代医家林佩琴在其著作《类证治裁·卷之四》中指出:“脑为元神之府,精髓之海……老人健忘者,脑渐空也。”当代国医大师张琪教授认为,VD其本在于心肾两虚,气血运行受阻,虚而致瘀,本虚标实,痰瘀阻滞脑络,脑髓海失养,神明失用[13]。故本病病因病机为肾虚髓亏,痰瘀闭阻脑络,神志灵机失用,治疗上采用补肾益髓、活血化痰和醒脑益智为治则大法。我课题组在长期临床实践中应用“四神聪”“风池”穴治疗VD效果较为理想[14]。四神聪穴具有健脑调神、调和气血的作用[15]。风池穴位于头项交界处,正好是进入头部的通道,既可以祛外风,又可息内风,治疗和头有关的疾病,具有醒脑开窍、明目益聪和疏通经络的功效[16]。现代医学认为脑血流供应来自前循环和后循环,前循环即颈内动脉系统供应额叶、颞叶、顶叶以及基底节等大脑半球前3/5部分血流,后循环即椎基底动脉系统供应脑后部的2/5部分血流。而四神聪穴位于额、颞、顶三叶的投射区,与人的思维、记忆和精神紧密相关[17]。风池位于枕骨之下,头项交界处,正好是椎动脉的投射区,通过针刺两穴可以有效地改善大脑前、后循环的血液供应,使脑部血流量增加,调节大脑功能,改善智能作用。
由于缺血造成脑细胞凋亡作为VD中重要的病理生理机制[18],细胞凋亡与痴呆程度呈正相关,其也参与了脑缺血损伤机制形成的过程。PTEN/PI3K/Akt 信号通路对调控脑缺血损伤的发生与发展十分重要[19]。作为新发现的抑癌基因PTEN在调节细胞生长、分化、凋亡和迁移等方面起到了重要作用[20],其主要底物三磷酸磷脂酰肌醇(Phosphatidylinositol triphosphate,PIP3)是PI3K的产物。由于PTEN具有磷酸酯酶活性,能调控PI3K/Akt信号通路,该通路广泛存在于各类神经细胞中,PTEN不仅能逆转二磷酸磷脂酰肌醇(PIP2)向PIP3 的转化,而且对PI3K/Akt信号通路起到负向调节作用[21-22]。在PI3K/Akt信号通路中,有多种效应分子分布在PI3K下游,Akt通路激活可作用于下游多个靶点,促进抗凋亡基因转录和表达,使抗凋亡作用充分发挥,促进细胞存活[23]。在细胞存活和凋亡中,PI3K/Akt信号通路起着重要的作用,可介导抗凋亡信号及促生长信号,对脑缺血损伤起着重要保护作用[24]。而PTEN可以通过有效拮抗PI3K/Akt信号通路阻止细胞生长、代谢、增殖和存活,因此具有抑制效应。因此,PTEN/PI3K/Akt 信号通路是调控细胞生长、增殖、存活和凋亡的十分重要的信号通路。研究表明,与正常组、假手术组相比较,模型组大鼠在治疗第7天、治疗第14天和治疗第21天各时点PTEN mRNA均明显升高(P<0.01),Akt mRNA均明显降低(P<0.01);与模型组比较,手针组、电针组大鼠在治疗第7天、治疗第14天、治疗第21天各时点PTEN mRNA明显降低(P<0.05或P<0.01),Akt mRNA明显升高(P<0.05或P<0.01);与手针组比较,电针组大鼠在治疗第14 d、治疗第21天时点PTEN mRNA降低更为显著(P<0.05),在治疗第7天、治疗第14天和治疗第21天各时点Akt mRNA升高更为显著(P<0.05)。
综上所述,针刺四神聪、风池穴可能抑制PTEN /PI3K/Akt信号通路上游负性调节因子PTEN mRNA表达水平,促进Akt mRNA转录表达,激活PI3K/Akt信号通路,调控脑区低灌注的脑血管疾病所引起一系列损伤级联反应,改善脑缺血所致脑组织神经元损伤,减少神经元细胞凋亡,改善VD大鼠的学习、记忆能力,起到防治VD的作用。
