基于浮游植物完整性指数的太湖主要河口生态健康评价
2021-05-13马廷婷范亚民李宽意胡忠军吴召仕
马廷婷,范亚民,李宽意,4,胡忠军,吴召仕
(1.上海海洋大学水产科学国家级实验教学示范中心/ 农业部鱼类营养与环境生态研究中心/ 上海水产养殖工程技术研究中心,上海 201306;2.中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008;3.江苏省环境工程技术有限公司,江苏 南京 210036;4.中国科学院大学中丹学院,北京 100049)
作为水生态系统的初级生产者,浮游植物对水生态系统稳定与功能发展起到了至关重要的作用[1],因其种类多,生活周期短,对水温、pH值、营养盐等水环境因子的变化反应灵敏[2],常被应用于水域生态系统健康状况评估[2-3]。KRUK等[4]首次提出了浮游植物形态功能群的概念,将浮游植物分为7个类群,通过形态与功能性特征的联系,阐释其对生境变化的响应。其中Ⅲ组和Ⅶ组浮游植物释放藻毒素等,造成水环境污染,能反映水质状况。
生物完整性指数(index of biotic integrity,IBI)结合了被研究生境的理化特征,且代表了群落中分类和功能单元。在构建过程中生物完整性指数包含众多与群落结构和多样性等有关的备选参数。与单一因素相比,生物完整性指数可以综合反映生态系统状态[5]。有研究表明生物完整评价方法完全适用于淡水生态系统健康评价领域[6]。生物完整性指数最初的研究对象为鱼类[7],随后广泛应用于大型底栖无脊椎动物、水生植物、附着藻类等水生生物类群[8-10]。在欧盟水框架指示中,浮游植物完整性指数是重要参数之一,被一些学者用于水域生态系统健康评估研究。目前,关于河流健康评价的研究主要侧重于底栖无脊椎动物和鱼类生物完整性指数的构建等[11],对浮游植物完整性指数(P-IBI)的关注较少,且其指数组成因研究区域而异[12]。
太湖流域处于经济高度发展的长江三角洲地区,人口聚集、城市化水平高。河口地理位置优越,受到当地社会经济发展的影响,人类活动干扰严重[13]。其次,作为河流和湖泊之间能量流动和物质交换过程的过渡区域,河口生态系统较为脆弱和敏感,受陆域污染源(如人类活动)沿河不断汇入以及河流和湖泊的双重影响。目前,针对浮游植物,学者主要利用多样性指数(如Shannon-Wiener、Margalef和Pielou指数等)以及功能类群等对太湖进行水质生物学评价[14-16]。如龚蕾婷[17]选用了包括浮游植物Shannon-Wiener指数等多个指标综合评估太湖流域入湖河流健康。此外,蔡琨等[18]以冬太湖为例,基于总分类单元数、硅藻门分类单元、Simpson指数、密度、硅藻门密度和绿藻门密度6个指标构建太湖浮游植物完整性指数。在全流域调查的基础上,WU等[19]以浮游植物密度、叶绿素 a(Chl-a)和Menhinick指数构建了太湖流域主要河流的P-IBI,且其能有效区分主要污染因子(总氮、总磷、氨氮和高锰酸盐指数等)。有关太湖流域河口的生态健康状况信息较少,其状况仍有待进一步研究。
笔者于2018—2019年对太湖流域主要河口进行4次季度调查,获取浮游植物定量数据,分析其群落结构特征,采用WU等[19]构建的P-IBI评价体系和标准对主要河口生态健康状况进行定量评价,并从理化因子和形态功能类群进行验证。该研究明确了太湖主要河口的生态系统健康状况现状,有利于分析河流生态环境问题,可为太湖流域及其他河流的保护和修复提供参考。
1 研究区域与方法
1.1 研究区域与样点布设
太湖流域地处长江三角洲,总面积为36 900 km2,河道纵横交错,河道总长约1.2×105km,河道密度达3.25 km·km-2,被称为“江南水网”[20]。纵横交织的河流水网不仅是重要的交通航运枢纽,连接城镇与村落的重要纽带,而且是水体交换和资源共享的通道[20]。根据太湖环湖河道的分布状况,在主要河口分别布设18个采样点位(图1)。
1.2 样品采集与分析
于2018—2019年进行4次季度采样。现场使用YSI-多参数水质监测仪现场测定水体表层温度(WT)、pH值、电导率(Cond)、溶解氧(DO)浓度。总氮(TN)、总磷(TP)、氨氮(NH4+-N)、正磷酸盐磷(PO43--P)、硝态氮(NO3--N)、亚硝态氮(NO2--N)浓度和高锰酸盐指数(CODMn)参照《水和废水监测分析方法》[21]测定,Chl-a浓度采用热乙醇法测定。
浮游植物定量样品取用1 L充分摇匀后的混合水样,加入φ=1%体积的鲁戈试剂固定,静置48 h,定容至30 mL。定量样品于10×40倍光学显微镜下观察鉴定计数,每个样品计数重复3次,取其平均值(误差范围±15%),生物量的测定采用体积转化法。浮游植物分类参照《中国淡水藻类系统、分类及生态》[22]。形态功能类群的分类参考KRUK等[4],其将浮游植物种类划分为7个类群(Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ和Ⅶ),其中Ⅲ组仅包括蓝藻、Ⅶ组由蓝藻和绿藻组成。这2类功能群的浮游植物能够释放藻毒素等,并且蓝藻在太湖中大量繁殖,造成水体环境污染,因此将这2组藻类放在一起研究。
1.3 浮游植物完整性指数
采用WU等[19]建立P-IBI的方法,由浮游植物总密度、Chl-a和Menhinick指数构建P-IBI(PIBI)指数,其计算公式如下:
(1)
式(1)中,Ci为第i种参数的标准化值。各指数的标准化方法见表1。
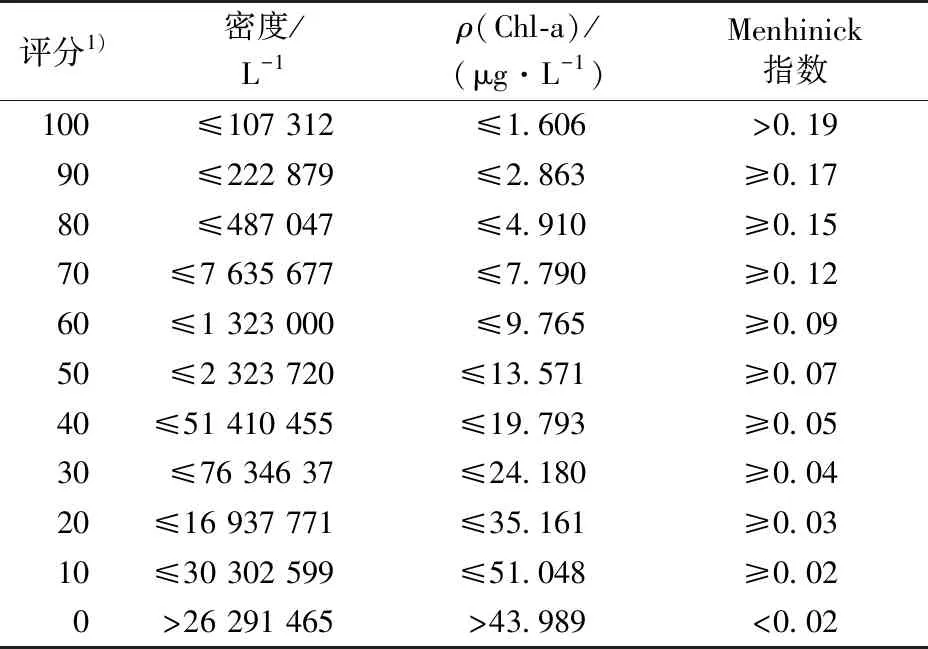
表1 用于P-IBI计算的指数标准化方法Table 1 An exponential normalization method for phytoplankton index of biotic integrity calculations
1.4 数据分析
采用Excel 2010和Origin 8.5软件对数据进行统计和分析。采用ArcGIS 10.5软件进行采样点位图的绘制。采用SPSS 19.0软件对P-IBI与环境因子、浮游植物形态功能类群进行Spearman相关性分析。
2 结果与分析
2.1 水体理化指标
太湖流域水质总体呈弱碱性,ρ(DO)季节均值范围为5.60~9.16 mg·L-1,部分监测点低于3.0 mg·L-1。ρ(TN)季节均值范围为2.90~3.42 mg·L-1,呈现春高夏低的特征。ρ(TP)季节均值范围为0.12~0.19 mg·L-1,ρ(PO43--P)季节均值范围为0.02~0.08 mg·L-1,TP与PO43--P浓度季节均值变化趋势一致,均在秋季最高,冬季最低。CODMn季节均值范围为3.69~7.09 mg·L-1,夏季较高,冬季较低。ρ(Chl-a)季节均值范围为12.67~76.57 μg·L-1,与CODMn变化趋势一致,夏季最高,冬季最低(表2)。

表2 太湖流域主要河口水体理化特征Table 2 Physicochemical characteristics of water in major estuaries of Lake Taihu
2.2 浮游植物密度和生物量分布
2.2.1浮游植物空间变化
太湖主要河口浮游植物密度平均值为8.91×106L-1,蓝藻为主要优势门类,平均相对密度百分比为94.68%。空间上密度最高值出现在18#,为8.55×107L-1,7#和1#次之,分别为2.51×107和1.20×107L-1,其他点位的密度均较小(图2)。蓝藻在各点位占比变化较大,最大值和最小值分别出现在18#(89.72%)和16#(0.14%)。硅藻在部分点位的密度较高,如4#为8.77×105L-1,且该点位的硅藻相对密度百分比为87.66%。金藻仅在6#检出,密度为1.82×105L-1,占该点位总密度的27%。绿藻和隐藻密度均在18#取得最大值,分别为2.47×105和1.64×105L-1。甲藻和裸藻密度均较小,最大值分别为2.0×105和4.45×103L-1。调查期间,太湖主要河口浮游植物平均生物量为1.46 mg·L-1,最大值同样出现在18#(9.84 mg·L-1),其中蓝藻生物量为8.98 mg·L-1,是造成该点位生物量较高的主要原因;7#次之,最低值出现在16#(0.32 mg·L-1)。
2.2.2浮游植物季节变化
密度上,总密度和蓝藻密度均在夏季取得最大值,分别为2.35×107和2.23×107L-1(图3);冬季浮游植物总密度和蓝藻密度最低,分别为3.84×105和1.40×105L-1。硅藻密度在夏季取得最大值(6.21×105L-1),秋季最低,为6.34×104L-1。自春季至夏季绿藻密度不断增加,之后不断下降。金藻仅在秋季出现,其密度为4.05×104L-1。4次调查过程中隐藻密度不断下降,最大值和最小值分别为5.76×104和42.71×103L-1。甲藻和裸藻密度较少,最大值分别出现在夏季(9.43×103L-1)和春季(4.57×103L-1)。春夏秋季蓝藻密度相对百分比均在90%以上,冬季较低。冬季硅藻对总密度贡献较大,其相对密度百分比为57.87%。
主要河口的浮游植物总生物量与密度存在较为一致的时间变化趋势,最高值出现在夏季(4.06 mg·L-1),春季次之,冬季最小(0.36 mg·L-1)。蓝藻生物量是引起总生物量季节变化的重要因素,其次是硅藻。甲藻生物量约占冬季总生物量的50%,隐藻相对生物量占比在春季取得最大值,为10.72%。春季和秋季绿藻的相对生物量占比较大,特别是春季(18.71%)。裸藻和金藻对总生物量的贡献较小,各季节均不超过10%。
2.3 浮游植物形态功能类群的时空变化特征
除了Ⅱ组,其他各组生物量均在夏季达到最大值。Ⅰ、Ⅳ、Ⅶ组生物量最小值均出现在冬季,Ⅲ组最小值出现在春季,Ⅴ、Ⅵ组生物量最小值均出现在秋季,Ⅱ组仅出现在秋季。春季Ⅶ组生物量最高(占总生物量的58.31%),其次是Ⅴ组。夏季Ⅲ组生物量最高(占总生物量的68.93%),其次是Ⅶ组。秋季Ⅱ组生物量较高(占总生物量的52.00%),其次是Ⅲ组。冬季Ⅴ组浮游植物生物量最高(占总生物量的61.36%),其次是Ⅵ组。Ⅲ组和Ⅶ组的浮游植物生物量之和在夏季最大(占总生物量83.27%),其次春季和秋季,冬季最小(占总生物量12.32%)。
2.4 基于P-IBI的水生态健康状况
如图4和图5所示,空间上太湖流域主要入湖河口的P-IBI平均值为42.64,主要状态是较差(占所有点位的55.56%),其次是一般,2个点位(1#和11#)处于极差状态。P-IBI最大值出现在3#,为64.17;最小值出现在11#,为21.67。
季节上,主要河口的P-IBI表现出明显的季节分布特征。夏季仅14#为良好状态,冬季所有采样点的生态条件比极差状态好,其中3#、4#、6#和14#为良好。P-IBI平均值在冬季最大(53.15),夏季最小(27.59)。春夏秋冬季的水生态健康等级依次为较差、较差、一般、一般。秋季有33.33%的水质处于良好水平,夏季仅有5.56%的水质处于良好水平,冬季的水质均在差水平以上(图6)。
2.5 P-IBI与环境因子的相关性分析
根据Spearman秩相关分析结果,P-IBI与水温、pH值、CODMn呈显著负相关(P<0.05),相关系数分别为-0.394、-0.504、-0.297;P-IBI值与NO3--N浓度呈显著正相关(P<0.05),相关系数为0.248(表3)。
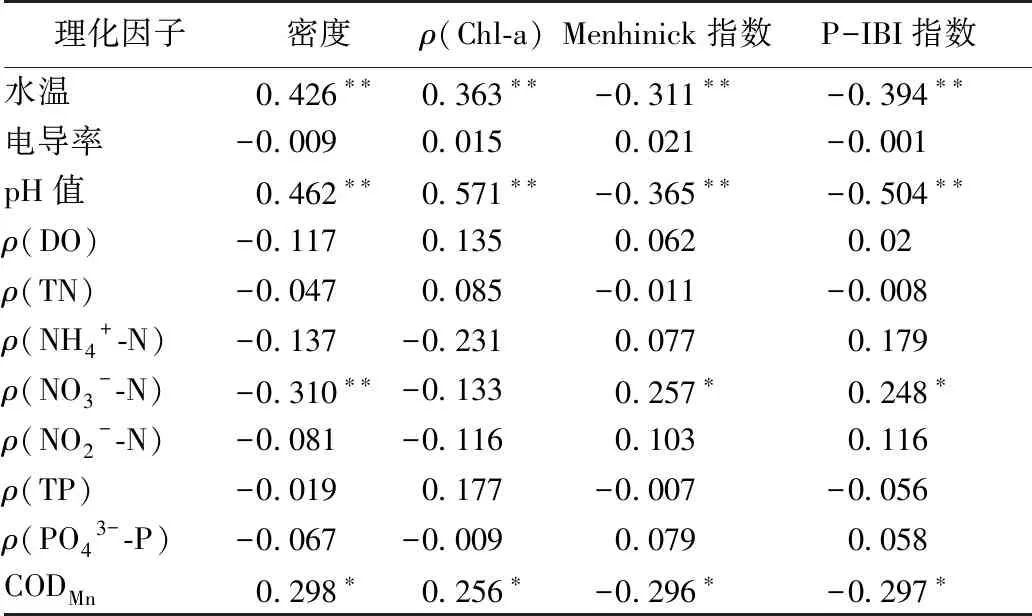
表3 P-IBI与理化因子间的Spearman相关性分析Table 3 Spearman correlation analysis of the P-IBI values and Physicochemical factors
2.6 P-IBI与浮游植物形态功能类群相关性分析
P-IBI与浮游植物形态功能类群相关性分析结果显示,P-IBI与Ⅲ组、Ⅶ组和Ⅲ+Ⅶ组生物量均呈显著负相关(P<0.05),相关系数分别为-0.739、-0.550、-0.807(表4)。

表4 P-IBI与浮游植物形态功能类群(Ⅲ和Ⅶ)的相关系数Table 4 Correlation coefficients among the P-IBI values and phytoplankton morphologically based functional group
3 讨论
3.1 P-IBI与其他生物学评估结果对比
太湖流域主要入湖河口的水生态系统健康状况主要处在较差水平,且存在显著的时空差异。评估结果上,该研究与以往太湖流域研究存在较好的一致性。基于全太湖流域水系河流的调查,WU等[19]构建了P-IBI评价体系和标准,对主要河流的生态健康状况进行评价,结果表明太湖流域河道水生态状况整体处于较差状态。利用大型底栖动物相对重要性指数(BPI)和Wright指数,吴召仕等[23]研究发现太湖流域水系整体为中污染状态,且不同水系之间存在差异,其中苕溪水系最好,南河和洮滆次之,沿江最差。杜东[24]构建了包括河流水文、河岸带状况、河流形态结构、河流水质理化参数、水生生物指标的河流水环境健康评价体系,结果表明太湖流域主要河流水环境健康状况较差,其中太滆运河为亚健康水平,梁溪河处于差水平。
笔者研究表明,太湖流域河口的水生态健康状况存在明显的季节差异,春夏秋冬的水生态健康依次为较差、较差、一般、一般。夏季主要河口的P-IBI值显著低于其他季节,冬季最好,这与笔者前期基于整个太湖流域的研究结果一致[19]。利用水质综合指数(WQI),刘福兴等[13]研究表明太湖贡湖湾主要河口水质状况具有显著的季节性差异,夏季的水质状况总体评价为中等,冬季总体评价为好。
3.2 P-IBI评价与水质指标的相关性
P-IBI与常见水体污染表征因子(如TN,NH4+-N,TP浓度和CODMn)之间的相关性较弱,仅发现P-IBI与CODMn之间存在显著的负相关关系。总氮、总磷和氨氮浓度的季节变化主要受流域内降雨及春耕等人类活动影响[20]。如TN浓度在冬春季较高,夏秋季较低,一方面可能是由于春耕,农田大量施肥流入河流,导致水体TN浓度增加;另一方面由于夏秋季降水量较大,营养盐得到稀释,且夏季温度较高,促进反硝化作用,消耗水体中的TN浓度[24];WU等[19]研究指出P-IBI评估结果能较好区分主要水体污染因子,但在季节尺度上,P-IBI与基于水体常规理化指标评估的结果存在明显的季节差异。此外,河流冲刷作用也在一定程度影响河口浮游植物的生长[25],导致浮游植物完整性指数与水体营养盐等指标的关系不明显。
在评价河流健康工作中,常用的理化指标能在一定程度上反映水体的受污染程度。然而,由于水体的流动性,理化指标仅表示瞬时状态,不能反映污染物对生物体的联合效应以及长期效应。浮游植物长期存在于水体中,汇集了整个生活时期的环境因素,其群落结构变化可对水质健康情况作出最直接的响应[20]。
3.3 P-IBI评价与浮游植物群落结构的相关性
冬季和秋季的P-IBI评价结果均为一般,春季和夏季P-IBI评价结果均为较差。浮游植物密度和生物量的定量分析表明,太湖主要河口春夏两季浮游植物较多,间接说明春夏两季水质较差,这与P-IBI评价结果一致。
基于浮游植物形态功能类群的划分,Ⅲ组主要是由鱼腥藻、伪鱼腥藻和颤藻等具有气囊的丝状体蓝藻组成,能在营养盐高且水体浑浊的环境中生存,Ⅶ组主要由微囊藻、平裂藻和隐球藻等具有胶被的群体蓝藻细胞组成。这2类功能群较耐高温和高光强[1],适合在氮磷浓度较高的富营养水体中生长[16],易形成蓝藻水华。值得注意的是,这2类功能群的浮游植物能够释放藻毒素,造成水环境污染,因此将这2组藻类放在一起研究。通过图5发现,Ⅲ组和Ⅶ组生物量所占总生物量比例依次为夏季>春季>秋季>冬季,与P-IBI平均值变化一致。同时,通过P-IBI与浮游植物形态功能类群相关性分析,进一步表明P-IBI评估结果较为准确可靠。P-IBI评价体系可以反映太湖流域河口的浮游植物群落结构变化,揭示其水生态健康状况及水华风险程度,预测水质状态。
4 结论
基于浮游植物完整性指数评价体系对太湖主要河口进行了生态健康评价。研究结果显示,太湖流域河口目前整体水质处于较差状态,水生态健康状况存在明显的季节差异,春夏秋冬依次为较差、较差、一般、一般。
研究表明,3个指标(浮游植物总密度、Chl-a和Menhinick指数)构建的P-IBI评估结果与以往研究存在较好的一致性,且与2组表征水质状况的形态功能类群的相关性较好,可以用于太湖流域河口水生态系统健康状况的评估。
