粪便中病原微生物快速检测方法研究进展
2021-05-13傅子鹏刘成斌李秋菊
傅子鹏,刘成斌,李秋菊,毛 舜
(同济大学环境科学与工程学院/ 污染控制与资源化研究国家重点实验室,上海 200092)
人体粪便中含有众多微生物,其中病原微生物包括志贺氏菌(Shigellaspp.)、沙门氏菌(Salmonellaspp.)、幽门螺杆菌(Helicobacterpylori)、大肠杆菌(Escherichiacoli)、霍乱弧菌(Vibriocholerae)、诺如病毒(Norwalk virus)等。这些病原体通过污染食物或水源感染人类,引发腹泻、肠胃炎、败血症等疾病,发病率高[1]。另外,粪便中的肠道微生物组与人体健康直接相关,影响着从代谢疾病到胃肠道疾病和结肠直肠癌等慢性疾病的发展[2]。不卫生的如厕条件、粪便等污染物的不安全排放导致全球每年约150万儿童感染疾病,是非洲地区引起儿童死亡的主要因素[3]。国内很多农村地区厕所环境不佳,雨天污染物容易溢出致使病原菌扩散;同时,厕所生物污染物容易传播疾病,增加人群发病率[4]。近年来,随着国家和社会对农村厕所环境的愈发关注,国家大力推动“厕所革命”,将农村厕所改造成无害化卫生厕所[5]。在改厕的过程中仍然存在粪便污染物的分布及风险不明、资源化转化过程(如堆肥)中污染物迁移转化机理不清的问题。因此,对粪便中的病原微生物进行快速、准确的检测对推动农村厕所环境改善和厕所粪便的资源化利用具有重要的意义。
针对粪便中病原微生物的检测,传统的培养检测法一般使用纸片、纸膜、胶片等作为培养基载体,将特定的培养基和显色物质附着在上面,通过微生物的生长、显色来进行测定。以粪便中的沙门氏菌检测为例,首先对粪便进行采样制备,在适宜条件下培养增菌,之后进行分离观察鉴定[6]。培养检测法结果准确可靠,是全世界用于检测微生物的基本工具;但其缺点在于需要专业人员操作,对实验材料有特定要求,检测耗时长,通常需要5~7 d[7]。因此,培养检测法往往不能满足快速检测的需要。
近年来,粪便中病原微生物的快速检测方法受到环境分析领域的关注。根据检测原理,病原微生物的快速检测方法可分为基于核酸的检测方法、基于免疫学的检测方法和基于生物传感器的检测方法。基于核酸的检测方法通常对目标序列进行放大扩增,可以检测目标病原体的特定基因,检测准确度高;基于免疫学的检测方法利用抗原-抗体杂交反应,据此开发的试剂盒能够快速简便地检测目标物;基于生物传感器的检测方法主要依靠光学原理和电化学原理,样品制备简单,能够实现检测系统的微型化、模块化和集成化。
1 粪便样品的前处理
粪便样品中除了肠道细菌外,还有腐殖质、肠道内壁脱落细胞及碎片、各种有机物和无机物等[8]。粪便样品作为一种生物样品,成分复杂多样,在分析之前需要进行前处理,去除干扰物,使待测物纯度达到仪器要求[9]。粪便样品的前处理目前缺乏标准化程序[10],通常取样后在低温环境下保存样品,经过离心、破碎、稀释等步骤后,依据商用试剂说明书进行DNA提取操作和后续分析。较为常用的商用DNA提取试剂盒处理方法有E.Z.N.A Bacterial DNA Kit法、E.Z.N.A Mag-Bind Soil DNA Kit法、FastDNA Spin Kit for Soil法、QIAamp DNA Stool Mini Kit法、QIAamp Powerfecal DNA Kit法、TIANGEN细菌基因组DNA提取试剂盒法和Wizard®Genomic DNA Purification Kit法等[11]。BECKMAN等[12]检测粪便中的幽门螺杆菌时,首先将粪便样品于-20 ℃条件下冷冻保存,之后使用QIAamp快速粪便试剂盒提取DNA进行后续检测。ZHANG等[13]使用TIANGEN公司生产的TIANamp stool DNA试剂盒从46个临床样品中提取DNA,然后利用环介导等温扩增技术(loop-mediated isothermal amplification,LAMP)进行分析,成功检出粪便样品中的志贺氏菌。ZHAO等[14]开发了一种通过声流处理粪便样品的微流控芯片,借助声换能器件产生的涡流将粪便样品缓冲液以高达30 μL·min-1的流速进行均质化,并过滤掉碎屑,通过100 mm宽的微柱阵列进一步纯化粪便样品(图1)。通过该方法制备的粪便样品能够保证细菌具备一定的形态完整性和生存力,便于后续检测。
2 基于核酸的快速检测方法
核酸检测在疾病诊断、基因表达和生物鉴定等领域应用较广。由于核酸通常是痕量的,基于核酸的检测方法一般需要通过有效地放大目标序列来扩增其含量,即核酸扩增技术。核酸扩增技术根据操作时温度的差别可大致分为2类:热循环扩增技术和等温扩增技术[15]。在热循环扩增技术方面,聚合酶链反应(polymerase chain reaction,PCR)是用于检测微生物最为常用和成熟的技术,该方法可用于分离,扩增和定量短DNA序列。
在传统PCR的基础上拓展出一些其他的扩增方法,如实时荧光定量PCR(quantitative real-time PCR,qPCR),该方法通过荧光标记的探针能够在扩增过程中检测靶标PCR,结合光学传感器使其具有更高的灵敏度,比常规的PCR更容易进行定量检测。BECKMAN等[12]评估了使用粪便标本检测幽门螺杆菌的可能性,使用qPCR检测294个粪便标本,227个样本为阳性,表明在人类粪便样本中可以检测到幽门螺杆菌,因此无需进行胃活检就可以确定该细菌的存在。逆转录PCR(reverse transcription PCR,RT-PCR)可以区分活细胞和非活细胞,弥补了传统PCR无法检测活细胞的缺点,并且可以检测处于生长期的细菌。巢式PCR(nested PCR)能够在提取RNA后借助DNA库对多个样品同时进行测序,大大加快了病毒的测序速度,被用于检测粪便中的脊髓灰质炎病毒(poliovirus)[16]。作为热循环扩增技术,以上的方法需要昂贵的测试平台,并且需要设计合适的引物,且过程繁琐耗时,不适合在缺乏相关设备的地区对粪便中病原微生物进行快速检测。
等温扩增技术省去了热循环扩增技术中的变性、退火步骤,无需特殊的控温设备即可实现靶序列循环扩增,大大缩短了检测时间,能够方便地用于病原微生物的高效检测。其中较为成熟的技术是LAMP技术。该技术基于链置换原理[17],通过DNA聚合酶催化进行反应,可分为以哑铃状模板构造的形成过程和扩增循环2个步骤[14]。该方法简单快速,与PCR技术相比,不需要复杂的设备和专业人员进行操作,甚至可以在简单的水浴装置中进行。在LAMP技术的基础上,ZHANG等[13]结合磁敏免疫分析技术(magnetic immunocaptured-loop-mediated isothermal amplification assay,IC-LAMP)来检测粪便样品中的志贺氏菌,该方法能够比传统LAMP技术更有效地富集病原体细胞而无需提取基因组DNA,检测限为8.7 cfu·mL-1,比PCR技术对志贺氏菌的检测更为灵敏、特异且可靠。除此以外,等温扩增技术还包括杂交链反应技术(hybridization chain reaction)[18]、滚环扩增技术(rolling circle amplification)[19]和链置换扩增技术(strand displacement amplification)等,这些技术对某些影响分子扩增效率的抑制物质的耐受性优于PCR[20]。
3 基于免疫学的快速检测方法
基于免疫学的快速检测方法利用了特异性抗原-抗体反应,针对目标物的抗原或抗体对目标物进行定量、定性检测[21]。该类方法包括酶联免疫法,生物发光免疫法、化学发光免疫法等,具有检测速度快、特异性强、灵敏度高等优势。
在免疫学方法中,酶联免疫法(enzyme-linked immunosorbent assay,ELISA)是在病原体检测方面使用最为广泛方法之一。为了满足测定需求,ELISA通常可分为直接ELISA、夹心ELISA和竞争性ELISA(图2)。直接ELISA首先将目标分析物(抗原)粘附于平板表面,然后将酶标记的抗原特异性结合,最后引入该酶的生色试剂产生颜色变化;夹心ELISA通常使用2种抗体,一种作为吸附剂固定以捕获抗原,另一种通过酶标记的抗体作为信号标记产生显色反应;竞争性ELISA主要应用于抗原缺乏抗体的结合位点,原理是标记的抗体与样品竞争抗原的结合位点[22]。在沙门氏菌、李斯特菌(Listeriaspp.)和大肠杆菌等多种食源性致病微生物的检测中均借助了酶联免疫方法,取得了很好的检测效果。BOLTON等[23]研究了沙门氏菌的ELISA检测,试剂盒的检出限低至0.04 cfu·g-1。相比于培养法,基于免疫学的病原微生物检测方法特异性强、灵敏度高,是病原菌检测中常用的方法;然而这些方法有耗时长、存在交叉反应、产生假阴性等缺点。
4 基于生物传感器的快速检测方法
近年来,各种新型微生物检测方法发展迅速,基于纳米材料的生物传感器在微生物快速检测中表现出优异性能,受到广泛的研究关注。纳米材料尺寸小、结构可控、具有良好的生物相容性,可以利用其优异的光学、电化学性质检测微生物的蛋白质、DNA或RNA。此外,将纳米材料与传感器结合对微生物的目标信号物进行特异性识别检测和信号传递有利于提高检测的特异性和灵敏性[24-25]。基于抗体、适配体等对细菌或病毒特定结构的亲和力,结合纳米材料的信号放大和转换作用,生物传感器可实现对病原微生物的实时、原位、高灵敏度检测。与传统的培养检测方法相比,该方法检测速度快,多数情况下能在1 h左右得到结果。但该类技术仍处于发展阶段,需要与可靠性强的检测技术相结合,以获得准确的检测结果。
4.1 光学生物传感器
光学生物传感器通过荧光、散射、吸收等光学现象,借助信号转换器将生物信号转化为可分析的光信号;将与病原微生物特征物具有特异性反应的抗原、抗体或适配体(检测探针)修饰于光学材料上,通过检测探针与特征物的结合引起光学特性变化,以此定量检测病原微生物的浓度。与传统的检测方法相比,光学生物传感器检测时间短、灵敏度高、无需具备专业知识的人员便可进行快速检测操作。光学生物传感器按检测原理可分为比色光学生物传感器、表面离子共振生物传感器、荧光生物传感器等。
4.1.1比色光学生物传感器
比色光学生物传感器的检测原理基于比色分析法。比色分析法是通过溶液本身的颜色对光的选择性吸收,在特定波长范围产生吸收并用肉眼观察或光学仪器进行分析的一种方法。利用这种方法可以通过肉眼观察反应结果,简化鉴定步骤。在比色生物传感器中最具代表性的是侧流层析技术(lateral flow assay,LFA),该方法能够在短时间内得到检测结果,适用于现场快速检测。LFA技术虽作为一种即时现场检测手段被广泛运用,但仍存在灵敏度较低、定量检测能力有限、无法重复利用等缺陷。在溶液样品检测方面,TRAM等[26]开发了一种试纸比色传感方法,利用细菌的DNA酶探针作为分子识别元件,检测过程中尿素通过脲酶水解增加溶液pH值;通过将脲酶与磁珠上的DNA酶偶联,通过pH值的变化可检测细菌的存在和浓度。由于其快速、简单、结果易观测,能够适用于现场快速检测,但该方法灵敏度较低,若要进行更为准确的检测需要增加富集培养步骤。
4.1.2表面离子共振(surface plasmon resonance,SPR)生物传感器
SPR传感器通常由光源、接收器、棱镜、偏振片、金属膜以及能够与检测目标物特异性结合的识别元件组成,光源发射入射光透过偏振片,以一定的角度射入棱镜,激发金属膜上的等离子体,当负载在金属膜表面的识别元件结合了目标物后会引起表面的折射率发生变化,在检测器中产生信号响应,以此定量检测目标物的含量[27](图3)。TORUN等[28]利用磁性纳米颗粒对目标物进行分离,采用SPR传感器对大肠杆菌进行检测,检测限低至3 cfu·mL-1。将SPR技术与纳米材料和其他检测技术联用能够提高检测灵敏度、响应速度,优化传感器性能。ZHOU等[29]将免疫磁分离、免疫磁性试纸与SPR技术相结合,通过免疫磁分离富集副溶血性弧菌(Vibrioparahaemolyticus),与PCR技术相比大幅提高了检出限和检出速度,检测限为10 cfu·mL-1,能在55 min内得到检测结果。EL等[30]将MoS2-石墨烯复合材料与局部表面等离振子共振(localized surface plasmon resonance)生物传感器相结合,大幅提高了传感器的灵敏度。SPR生物传感器是食源性致病菌检测中应用较多的一类生物传感器,然而细菌细胞质与水的折射率相似,在一定程度上限制了检测的准确性,且SPR生物传感器在实验室分析中仍需要大型设备,可与微流控技术相结合来减小设备尺寸和降低检测的复杂性[31]。
4.1.3荧光生物传感器
荧光生物传感器是基于荧光发生原理,当目标分析物受到紫外光照射时,原子被激发产生能级跃迁从而产生荧光,通过检测荧光强度从而实现对目标物的定量分析。荧光生物传感器设备简单且响应速度快,结合新型纳米材料能消除背景荧光,提升信噪比[32]。SRINIVASAN等[33]设计了2种无标记的荧光适体传感器检测鼠伤寒沙门氏菌(Salmonellatyphimurium)。第1种采用“荧光淬灭”方式,首先将适体插入SYBR核酸染料(SYBR GREEN I,SG),产生强荧光信号;加入鼠伤寒沙门氏菌,与适配体特异性结合并释放SG,导致荧光强度线性下降,这种方法获得的最低检测限为733 cfu·mL-1。第2种采用“荧光增强”方式,当适体和金纳米颗粒与罗丹明B(rhodamine B,RB)混合时,罗丹明的荧光通过荧光共振能量转移(forster resonance energy transfer,FRET)并被显著淬灭;加入鼠伤寒沙门氏菌(S.typhimurium),与适配体特异性结合,导致淬灭的罗丹明B的荧光恢复,从而通过荧光信号强度变化对鼠伤寒沙门氏菌进行检测,最低检测限为464 cfu·mL-1。
HU等[34]设计了一种纳米荧光微球用于快速检测大肠杆菌O157:H7,通过化学方法将荧光素固定于SiO2纳米微球内,并将针对大肠杆菌O157:H7的抗体修饰于磁珠和SiO2纳米微球表面,从而用于识别和捕获大肠杆菌O157:H7。通过磁分离富集后加入NaOH以释放SiO2微球中的荧光素来检测大肠杆菌O157:H7的浓度。在最优条件下,该方法的检测限低至3 cfu·mL-1,检测过程可在75 min内完成。荧光生物传感器在实际检测应用中常以试剂盒和试纸条的形式出现,灵敏度高、检测时间短、操作简便。
4.2 电化学生物传感器
电化学传感器一般由换能器和识别元件等组成,其中识别元件与病原体微生物的目标检测物特异性结合,引发电化学系统中的阻抗、电流等的变化,通过电信号的测量来检测病原微生物的浓度,其组件与检测模式如图4所示[35]。
4.2.1安培型/伏安型生物传感器
安培型传感器检测病原微生物的基本工作原理是在给定的电势下测定电极表面由氧化还原反应而产生的电流,分析物浓度与电流值呈线性关系[36],与之对应的伏安型生物传感器则在电势扫描下测定对应的电流,生成的伏安图中电流强度与分析物的浓度成正比。另外,伏安法的类型根据电势的控制形式可分为差分脉冲伏安法、循环伏安法和方波伏安法[37]。
根据安培型生物传感器的检测原理,目前已经开发了一系列用于检测病原微生物的相关传感器。SAVAS等[38]开发了一种能够检测粪便样本中痕量的鼠伤寒沙门氏菌的传感器,基于免疫学原理对DNA探针和目标物菌用辣根过氧化物酶(horse radish peroxidase)标记,在固定电势下连续测量电流,以检测固定在传感器表面的DNA探针与目标物之间发生的杂交反应,从而定量检测鼠伤寒沙门氏菌的DNA浓度,检测限低至1 cfu·mL-1。在安培型生物传感器中,石墨烯也常被用做通道材料将生物信号转换为电学信号。HUANG等[39]设计了一种基于石墨烯的生物传感器,能够以高灵敏度和特异性检测大肠杆菌。通过化学气相沉积法生长大尺寸石墨烯薄膜,通过连接子将大肠杆菌抗体修饰于石墨烯薄膜上,未防止非特异性反应,使用乙醇胺将未反应的连接子分子猝灭,同时使用吐温20将未涂覆石墨烯的区域覆盖,最后利用抗体与大肠杆菌的抗原-抗体特异性反应对大肠杆菌进行特异性识别,检测限低至10 cfu·mL-1(图5)。ODUNDO等[40]根据免疫学原理研发了一种能够检测粪便样本中血吸虫抗原的伏安型生物传感器,由纳米带、金纳米颗粒以及血吸虫抗原组成。将血吸虫抗原负载在金纳米颗粒上,在检测过程中抗原与血吸虫抗体特异性结合,利用循环伏安法进行分析,检测限低至8.4×10-2ng·mL-1。
4.2.2阻抗型生物传感器
阻抗型生物传感器利用电化学阻抗谱(electrochemical impedance spectroscopy,EIS)对电化学系统施加一个频率变化的交流信号,通过测量交流信号中电压与电流的比值,即阻抗值来分析目标物。EIS对检测界面非常敏感,因此可以用于表征生物传感器构建过程中各种反应的特性[37]。在生物传感器中通常利用能够与目标检测物特异性结合的探针增强传感器的灵敏性和特异性。MALVANO等[41]设计了一种基于乳链菌肽的阻抗型生物传感器。乳链菌肽是一种抗微生物肽,可以攻击细菌并破坏其细胞膜,在生物传感器中可用作分子识别元件。将乳链菌肽分子固定在金电极上,利用电化学阻抗谱研究该传感器对不同细菌的响应情况。在检测沙门氏菌细胞时检测限低至1.5×101cfu·mL-1。SHI等[42]采用对大肠杆菌O157:H7具有高亲和力的聚合肽作为识别原件,经修饰后在金电极上进行自组装,之后利用阻抗谱分析大肠杆菌O157:H7,其检测限低至20 cfu·mL-1。在阻抗型生物传感器中,石墨烯由于其高比表面积、优异的导电性能以及可修饰性,也常被用作检测材料。JAISWAL等[43]将羧基化的石墨烯与氧化锌纳米棒结合,并在电极表面固定大肠杆菌O157:H7的特异性DNA探针,以检测大肠杆菌O157:H7。GUPTA等[44]利用丝网印刷技术,将氧化石墨烯制备成电极,并在其表面用2-氨基对苯二甲酸进行功能化,利用抗原-抗体反应对大肠杆菌进行检测。该传感器检测限低至2 cfu·mL-1,且响应速度快(检测时间少于4 min),稳定性好(2个月)。
4.3 微流控技术在生物传感器中的应用
近年来,微流控技术发展迅速,广泛运用于生物样品的快速检测。生物传感器与微流体集成的检测系统能够在单一设备上进行样品的添加、分离、制备和分析,具有检测时间短、多通量、自动化、便携性,多功能性和所需样品量小等多种优点[45]。ZHAO等[14]开发的微流控芯片可以与样品分析单元相结合(如生物传感器等),简化样品处理步骤,在设计便携式粪便诊断平台方面具有广阔的应用前景。MCGUIRE等[46]对粪便样品进行加热挥发处理,通过气相色谱方法并结合电子鼻技术,对艰难梭菌(Clostridiumdifficile)进行检测。微流控技术能够从复杂样品中有效分离致病菌,进而便于病原体的精确检测。将微流控技术与生物传感器技术相结合,有望开发更为实用的便携式现场病原微生物检测设备,满足疾病控制、食品、环境监控等方面的需求。
5 检测方法对比
前文介绍了粪便中病原微生物快速检测方法,表1对这些方法的优缺点进行了总结。传统的培养镜检法能够准确地检测常见微生物种类,但缺点在于微生物培养时间较长,通常在5~7 d内才能给出检测结果。相较于培养镜检法,核酸检测方法、免疫学检测方法和生物传感器检测方法往往能够快速得到检测结果。其中光学生物传感器和电化学生物传感器检测尤为方便,结合微流控技术能够快速分析成分复杂的粪便样品。

表1 粪便中病原微生物快速检测方法优缺点对比Table 1 Comparison of advantages and disadvantages of fast detection methods for pathogenic microorganisms in faeces
表2总结了粪便中病原微生物快速检测方法的各项指标,表中提到的检测方法均能在2 h内完成检测。生物传感器由于检测结构、识别元件、换能器等各不相同,其性能相差明显,对不同目标检测物的检测时间由2 min到2 h不等。通过设计不同的识别元件,生物传感器能够检测不同的微生物;另外选择合适的纳米材料作为换能器能够大幅提高传感器的检测性能。因此,生物传感器在病原微生物检测方面有望得到进一步研究和推广。
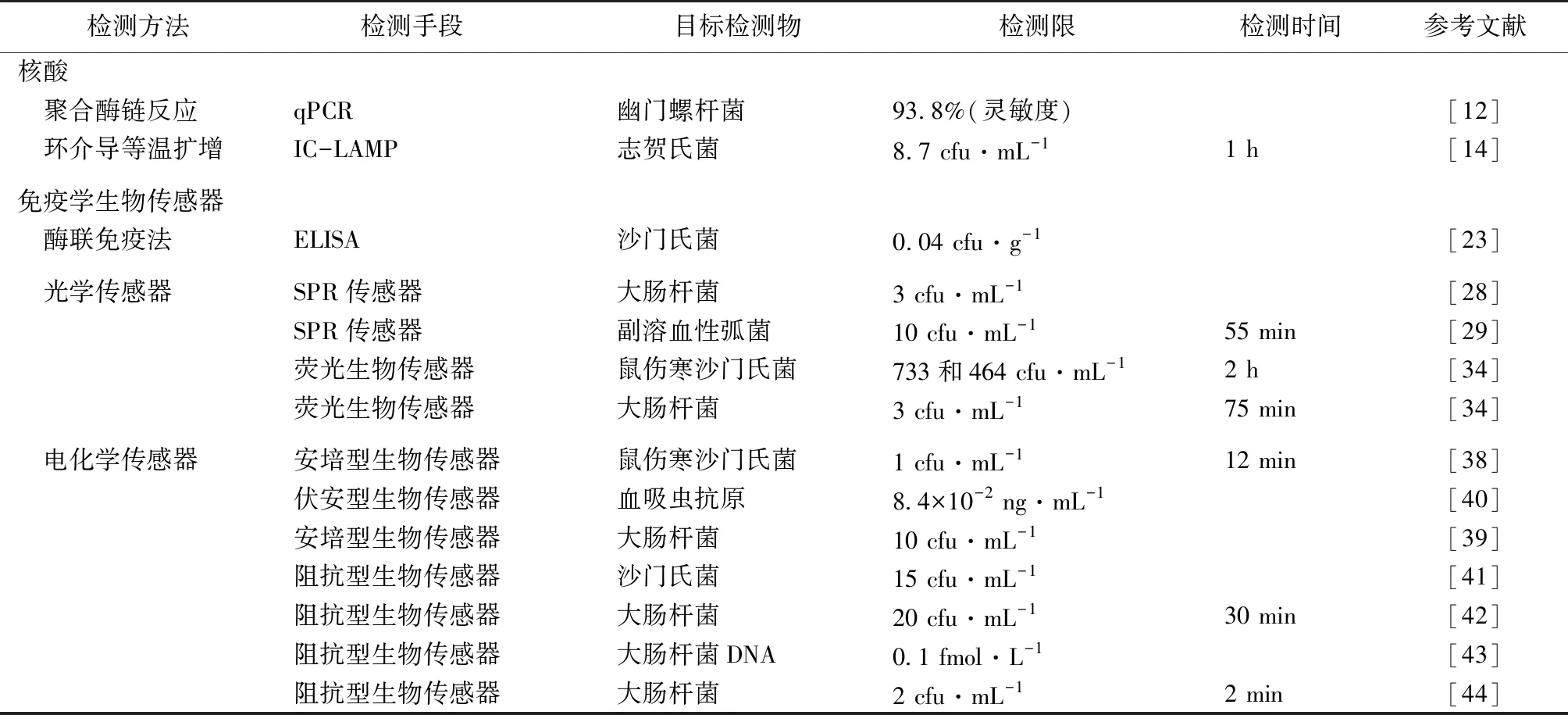
表2 粪便中病原微生物检测方法对比Table 2 Comparison of detection methods for pathogenic microorganisms in faeces
6 总结与展望
针对粪便中病原微生物的检测,传统的培养检测法依然是常用且准确有效的检测方法。但由于该方法需要耗费较长时间进行微生物培养,操作步骤繁多,难以满足快速检测需求。该文根据检测原理,介绍了核酸检测法、免疫学检测法和生物传感器检测法。相较于传统的培养检测法,这些方法通常能在数小时内完成对目标物的检测。
核酸检测法主要依靠核酸的扩增,通过对于特定的基因片段扩增最终得到基因序列,与已知的目标微生物的核酸序列比对便可鉴定检测微生物类别[47]。近年来,核酸检测法在医学领域已经得到了充分的实践应用,在新冠疫情的鉴定排查方面,许多国家也运用该方法研制了相应的核酸试剂盒来对疑似感染者进行筛查。核酸检测技术作为微生物检测的金标准,有着特异性强、灵敏度高等特点,但需要在实验室进行分析,难以满足现场检测需求。免疫学检测方法基于抗原-抗体反应原理,检测结果较为可靠,但同样依赖实验室条件,这限制了其在现场原位检测的应用。生物传感器基于光学、电学分析原理,能够特异性检测目标病原微生物,同时具备高灵敏度,并且具有成本低、检测过程简单、无需专业人员操作,可现场快速检测等优势。但目前多数生物传感器对粪便样品的检测仍处于研究阶段,没有统一的标准,各种不同的传感器设计结构导致其性能差异巨大。如何提高传感器的重复性、稳定性和抗干扰能力,使其能够方便地应用于实际检测当中是需要解决的问题。另外,生物传感器往往对分析样品的条件状态有一定限制,因此粪便样品的快速前处理方法也是亟需研究的问题之一。生物传感器结构设计灵活,通过结合性能优异的纳米功能材料,这类传感器显现出极高的检测能力,具有巨大的研究价值和应用潜力。
