循环肿瘤细胞的分离与鉴定研究进展*
2021-05-13综述徐克前审校
张 偎 综述,徐克前 审校
1.中南大学湘雅医学院医学检验系,湖南长沙 410013;2.中南大学湘雅三医院检验科,湖南长沙 410013
高效分离和准确鉴定循环肿瘤细胞(CTC)对肿瘤的早期诊断具有重要意义。目前,CTC的分离方法按原理可以分为物理分离和免疫分离两大类,且各自分为许多亚类。分离后的细胞通常需要进一步鉴定分析,这是因为单纯依靠分离方法捕获的细胞纯度较低,混杂了许多白细胞。通过对细胞表面分子标记、内部核酸等进行定性、定量分析,不仅能够得到高纯度的CTC,还可以根据细胞分型的结果鉴别不同来源的肿瘤,为肿瘤的转移、用药和监测提供可靠的帮助。现对CTC的分离和鉴定方法进行综述。
1 CTC的分离
1.1物理分离方法 物理分离方法也称为“无标签分离”,目前主要有密度梯度离心法、基于细胞大小分离法,以及与电学、声学、光学分离相结合的微流控技术。
1.1.1密度梯度离心法 CTC核质比较高,根据沉降系数的差异可将CTC分离开。目前开发出的平台主要有Ficoll-Hypaque、Percoll和OncoQuick。Ficoll-Hypaque分离范围较窄,多用于分离外周血单个核细胞,而Percoll利用不同浓度的离心剂,大大拓宽了分离范围。带有多孔筛的OncoQuick有效减少了白细胞污染[1]。密度梯度离心法操作简单、成本低,但分离纯度低,一般作为预富集方法。
1.1.2基于细胞大小分离法 CTC与血细胞相比体积通常较大,根据此差异可分离细胞。ISET、ScreenCell、Parylene-C、FMSA、CellSieve、3D钯滤光片、镍微孔筛等平台均为微孔过滤装置,平台间的差异主要体现在滤膜材料、孔径大小上,各类微孔滤膜的比较见表1。这些平台分离出的细胞可以帮助监测疾病的进展。如通过CellSieve微滤器分离结直肠癌切除术后患者肺静脉血液中的CTC,可及早发现结直肠癌的肺部转移[2];通过分析CellSieve膜上捕获的细胞,发现循环癌基质细胞和CTC的区别及两者与肿瘤进展的相关性[3]。微孔滤膜法捕获效率高,但体积较小,有变形性的CTC可能被漏检。
新发展的铁流体动力学细胞分离(FCS)并不像大多数传统方法一样在膜上进行,而是利用生物相容性的铁磁流体,对不同大小的细胞进行分离[4]。在癌细胞加标率约为每毫升100个的情况下,对肺癌、乳腺癌、前列腺癌来源的多种癌细胞系进行富集分离,平均捕获率达92.9%[5]。FCS具有较高的生物相容性,细胞活力不受影响,但该方法仍无法从癌症患者的血液中富集低浓度的CTC。

表1 各类微孔滤膜的比较
1.1.3微流控技术 微流控技术利用细胞惯性差异来分离细胞,不同质量的细胞在流动过程中产生不同的方向和速度。质量较大的CTC主要受惯性升力作用向内壁移动,而质量较小的血细胞主要受迪安流影响向外壁迁移。为提高分离效果,通道可设计成不同的形状。如Vortex通道设计为直线形,ClearCell FX通道设计为对细胞活性更友好的螺旋形,而CTC-ΔChip平台采用出口逐渐加宽的楔形设计,有效解决了出口堵塞问题。EDD 等[6]还报道了一种可用于分离CTC簇的微流体通道,该装置以30 mL/h的速度将CTC簇捕获在载玻片大小的装置上。
微流控技术近几年来发展迅速的一个重要原因是它可以与许多分离方法联合使用,如电场分离、声场分离、光学分离,在实现快速分离的同时有效保留细胞生物活性。ApoStream和LIFF是与电场分离相结合的微流控装置,细胞介电特性的差异使CTC向带有电极的方向移动,而血细胞被排斥流向洗脱液[7]。LIFF在原有的基础上增加了电极数目,提高了分离速度[8]。Acoustic Chip是与声学分离相结合的微流体装置,产生驻波的压电转换器是设备的关键组件,不同体积和密度的细胞在声场中产生不同的压力节点而被分离[9]。光学分离根据折射率差异提示细胞间的差异,如流式细胞仪的前向散射光可反映细胞体积大小,侧向散射光可反映细胞内容物、核含量等信息,但该方法分离的细胞群常有交叉,需要质控和定期校正。
1.2免疫分离方法 免疫分离方法主要通过抗原抗体、适配体等免疫相关物质之间的特异性结合达到分离的目的。
1.2.1磁场中分离 在磁性载体上包被特异性抗体或适配体,利用外加磁场的作用分离细胞,根据载体靶向细胞的不同,可分为正向和负向两种富集策略。
基于正向富集建立的平台有Cellsearch、MACs等,其中Cellsearch已被广泛应用。但肿瘤在转移过程中容易发生上皮间质转化,导致上皮细胞黏附因子(EpCAM)低表达甚至不表达,因此,其他分子标记也正被逐步应用到CTC的分离中。如在磁纳米粒子上包被脂质体和衍生物[10]及EpCAM和N-钙黏附蛋白[11]或表皮生长因子受体(EGFR)[12]的双抗体,有效提高了不同肿瘤CTC的捕获效率。
正向富集法的另一个缺点在于分离过程中可能丢失分子标记,不利于后续鉴定分析和细胞培养,此时,负向富集法的优势得以显现。负向富集法建立的平台有Cyttel、EasySep、MagSweeper等。其中,Cyttel、EasySep以磁珠为载体,MagSweeper利用磁性棒作为载体以减少非特异吸附。虽然负向富集法可以有效解决漏检的问题,但捕获纯度有待提高。
1.2.2流动相分离 流动相分离CTC可分别在体外和体内进行。CTC的体外分离主要是通过微流控芯片来实现,捕获的细胞可直接在芯片内计数与鉴定,也可以通过洗脱收集细胞。出现早且应用广的平台有CTC-Chip、HB-Chip、CTC-iChip和Nanovelcro芯片等。CTC-Chip易造成样品堵塞;HB-Chip由于采用了透明材料,可用于高分辨率成像;由两个模块构成的CTC-iChip有较高的捕获纯度效率;Nanovelcro芯片以纳米纤维为捕获基质,极大提高了捕获效率。有报道利用激光显微切割系统分离Nanovelcro芯片捕获的单个CTC,发现肺腺癌与间变性淋巴瘤激酶(ALK)基因重排[13]和EGFR突变[14]有较强的相关性,可以有效监测疾病进展和耐药反应。
最近也出现了一些新的微流控检测平台,这里报道一种二维分选装置,它对细胞表面标志物进行两次分型,从而精细化地将细胞分选为不同亚群,可以有效评估肿瘤的转移、恶化[15]。由于分离过程中的血细胞干扰是较大的影响因素,LI等[16]制造了红细胞膜模拟表面的捕获基质以吸附血细胞,并利用靶向配体的连接实现Hela细胞的高捕获率(91%)和高纯度(89%)。
高科技的发展也推动了体内分离技术的进步,但目前出现的装置并不多,主要是CellCollector和微型电机。CellCollector是涂覆有EpCAM抗体的医用不锈钢丝,将钢丝置于静脉血管内30 min即可捕获CTC[17]。微型电机以肿瘤患者体内的H2O2作为推进能源,电机表面涂覆抗体快速定位靶细胞[18]。体内富集方法无需采血,保证了充足的样本来源,但影响因素多,如存在高脂血症、黄疸等导致的非特异吸附问题,其安全性也还需进一步验证。
2 CTC的鉴定
目前,鉴定CTC的方法主要有免疫荧光染色法、核酸分析法、光谱分析法及蛋白质分析法。
2.1免疫荧光染色法 免疫荧光染色法利用荧光素标记对细胞进行鉴定,常用的细胞标记有核染色(DAPI、Hoechst)、上皮细胞表面抗原(CKs)、间充质蛋白和白细胞分化抗原(CD)等。许多新的标志物也不断被学者应用到肿瘤的研究中,以往的研究发现高表达CD44、CD47的肿瘤细胞有更强的迁移和侵袭能力,这些细胞标志物可以帮助患者选择用药以提供精准的治疗方案,如GUIBERT等[19]检测非小细胞肺癌患者肿瘤组织和细胞的程序性死亡蛋白配体-1(PD-L1)水平,以筛选可用于免疫检查点抑制剂治疗的患者,荧光显微镜、自动化图像识别设备和多参数的流式细胞分选系统可以用来观测荧光染色结果。荧光显微镜适用于样本量较小的研究,CellSearch即是通过此种方法鉴定CTC,但存在人工镜检造成的主观偏倚。自动化图像识别设备克服了上述缺点,捕获的细胞经光纤阵列扫描后,传感器将图像呈递给软件进行处理,常应用于芯片、膜等固体化捕获装置的成像分析,但该方法要求固相载体保持一定清洁度,且细胞为单层排列。多参数流式细胞分选系统使用多种细胞表面标记,在鉴定细胞表型的同时可以高效分选细胞,SEN等[20]利用流式分选系统实现了多种肿瘤细胞系的分离。
2.2核酸分析法 检测细胞内部核酸的核酸分析法主要以分子杂交、PCR和基因测序为代表。
分子杂交法利用生物探针与细胞核酸杂交可对细胞定性、定位。Canpatrol通过与捕获细胞的mRNA分子杂交,检测准确度达80%。最近报道的一种TPN生物探针,能够渗透进入活细胞与线粒体特异结合,根据线粒体的发光差异来区分肿瘤细胞和血细胞[21]。这种探针对细胞活力和完整性影响很小,可以作为鉴定CTC的新工具。
OncoCEE和AdnaTest应用实时荧光定量PCR技术,通过检测多种乳腺癌相关基因来评估转移性乳腺癌的发生与发展。除了鉴定细胞系别,PCR技术还可以用于建立肿瘤模型。有研究表明,从不同细胞系中分离出的EpCAM(+)和HER2(+)亚群用于建立更接近原位的3D乳腺癌肿瘤模型,可以更准确地评估新的治疗策略和药物[22]。ZHAO等[23]通过PCR检测发现CTC-3细胞上皮间质转化和干性标志物的水平较MCF-7细胞更高,提示CTC-3细胞是研究乳腺癌恶性行为的更好模型。近年来,液滴/微孔PCR发展迅速,并可对多种遗传信息如CRISPR/Cas9改进的KRAS突变、乳腺癌PIK3CA热点突变进行快速、可靠、准确的定量检测,该技术有广阔的发展前景,未来有望逐步取代传统的PCR。
基因测序目前应用最广泛的是单细胞测序。XU等[24]对早期肺癌患者外周血中单个CTC进行外显子DNA测序,检测到包括细胞侵袭、DNA修复等相关基因的突变,有利于进一步探索肿瘤的异质性信息。单细胞测序还能通过拷贝数变异检测存在异常的基因组,通过在数据库中进行比对,从而在分子水平上分析单个细胞。
核酸分析法的关键在于检测的基因与所研究疾病要有较强的关联程度,与免疫荧光法相比,它可以提供客观、可量化的结果,但需要裂解细胞,难以提供形态学方面的数据。
2.3光谱分析法 光谱分析技术广泛应用于生物化学领域,如今也有用于鉴定CTC的报道,主要是微核磁共振检测技术和拉曼检测技术。
与磁场分离有异曲同工之处,微核磁共振检测系统中包被抗体的磁纳米颗粒与细胞结合后经磁响应而被分离,但后者产生的核磁共振信号起到了微小放大的作用,有效提高了检测灵敏度,研究表明对大肠癌有较好的诊断价值[25]。拉曼检测技术利用包被特异性抗体的活性纳米探针与细胞结合,根据不同类型细胞特征谱线的差异鉴定CTC,这些纳米探针由不同的拉曼报告分子(主要是有机化学物质)和纳米颗粒构成,如CHO等[26]利用金纳米颗粒构成的活性探针鉴定出了乳腺癌的5种亚型。拉曼检测技术还可以无损伤地对细胞内部核酸进行分析,具有高灵敏度、高分辨率的特点,但目前主要用于检测循环游离DNA和DNA损伤修复,相信未来在CTC鉴定方面有进一步的发展。
2.4蛋白质分析法 蛋白质分析法在基因翻译水平通过检测蛋白质水平来鉴定CTC,电泳技术、Northern杂交是常见的检测手段,这里介绍的蛋白质芯片/微阵列即是基于以上技术原理而开发的。ProteinSimple公司研发的Milo是第一个可用于CTC鉴定的蛋白质芯片,由1 000~2 000个用于容纳单细胞的微孔构成,细胞被裂解后电泳,并加入多种荧光抗体标记同时检测数十种靶蛋白,与传统检测方法相比,可以进行单个细胞水平的鉴定分析。除此之外,通过检测一系列代谢基因编码的蛋白质,蛋白质分析法可以发现CTC高表达的基因,探索肿瘤与代谢基因的关系,并提示肿瘤的恶性变化。CHEN等[27]利用蛋白微阵列检测前列腺癌患者的肿瘤细胞,确定磷酸甘油酸激酶(PGK1)和葡萄糖六磷酸脱氢酶(G6PD)可以作为CTC的最佳代谢标志物,且患者体内PGK1和G6PD水平与前列腺癌转移程度呈正相关。但由于不同核酸的基因表达产物可能相似或一致,检测靶蛋白前,需要确定涉及的相关基因的表达产物是否有交叉,否则无法得到真实可靠的结论。目前已经发展起来的CTC鉴定方法见表2。
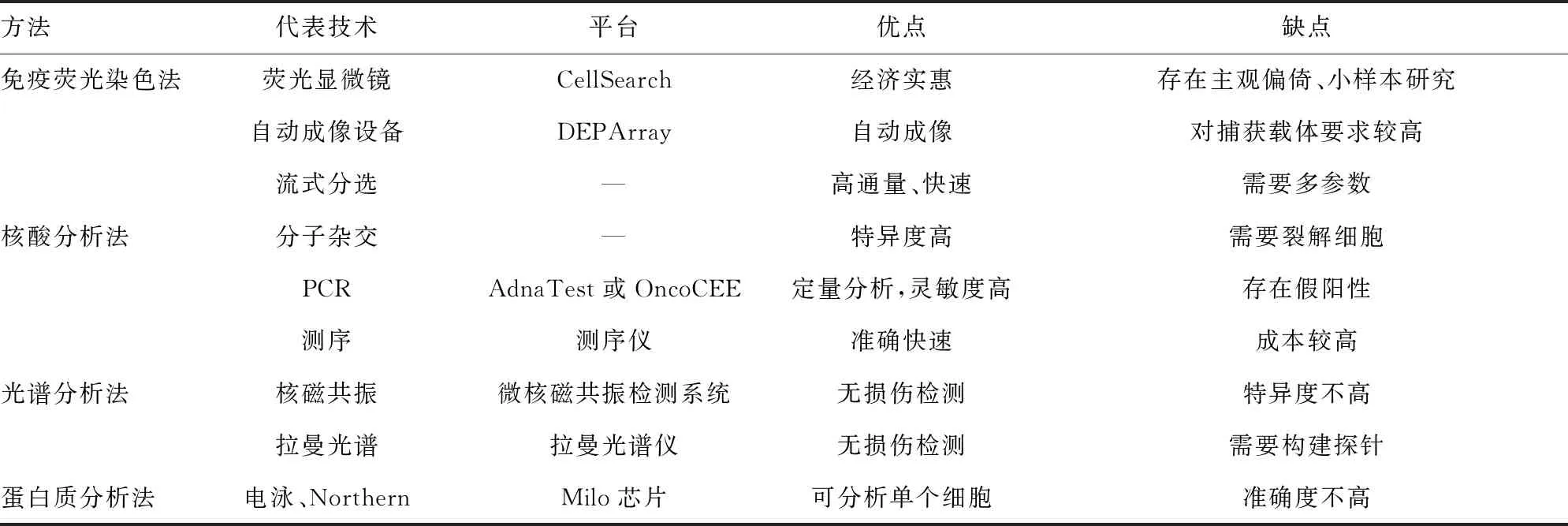
表2 CTC的鉴定方法
3 总结与展望
美国食品药品管理局(FDA)将CTC正式批准为癌症进展监测中新的生物标志物,它的分离、鉴定对于肿瘤早期诊断、病情监测十分重要,因此,发展了许多技术方法。物理分离方法无需抗体标记或染色,可以较好地保留细胞的完整性和生物学活性,有利于后续细胞培养;而免疫学分离方法可能造成细胞抗原的丢失、改变。这些分离富集的方法推动了肿瘤疾病中整个基因组的研究,因此,需要通过各种分子标记、核酸分析、光谱分析等方法对细胞分离、鉴定。目前,检测CTC仍处于临床前阶段,限制其临床应用的主要因素是缺乏可靠的临界值,以及用于分离、鉴定CTC的工具尚未成熟,还需要进行大量的临床试验来提供有效的证据。未来,相信CTC的检测平台会向着分离、鉴定一体化、多种技术联合应用的方向发展,并能够以简便快速、准确可靠、低成本、高通量的检测优势服务于临床与科研。
