不同大小角膜微切口超声乳化白内障摘出术对术后角膜愈合过程的影响
2021-05-12任宁孙丽霞崔红李正日李承霖金海燕李英俊
任宁 孙丽霞 崔红 李正日 李承霖 金海燕 李英俊
延边大学附属医院眼科,吉林省延吉市 133000 任宁现在沈阳市第四人民医院眼科 110000
白内障手术技术的进步主要体现在角膜切口的减小、白内障超声乳化能量的降低、效率的提高和角膜内皮细胞损失的减少[1]。自闭性透明角膜切口可以实现手术零出血,减少术后散光,并且能够更快地恢复术后视觉质量[2]。虽然目前白内障手术追求微切口,但术后切口的恢复和角膜内皮完整性对术后视功能的恢复影响很大[3-5]。临床研究发现,太小或太紧的角膜切口会增加白内障超声乳化术时的切口应力,从而导致术后角膜切口变形[6-8]。因此,关于微切口白内障手术最佳切口的大小目前仍存在争议。以往常通过镜面反射显微镜观察白内障术后角膜损伤情况,但是该方法仅限于观察角膜中央1.0 mm2范围内的角膜内皮,无法评估全角膜情况[9-10]。此外,镜面反射显微镜不能提供切口部位准确的角膜厚度和角膜水肿程度。近年来,光相干断层扫描(optical coherence tomography,OCT)和Scheimpflug相机等新型成像技术被用于评估自闭性透明角膜切口结构。非接触式眼前节光相干断层扫描(anterior segment OCT,AS-OCT)作为一种安全、快捷的眼前节成像系统,可以清晰地显示自闭性透明角膜切口的二维形态,并能准确测量角膜切口部位的角膜厚度等相关数据。Pentacam Scheimpflug成像系统是一种基于Scheimpflug相机的三维分析仪,用于评估角膜厚度、角膜容积、角膜曲率和前房深度等参数[11]。目前关于不同大小角膜微切口超声乳化白内障摘出术对术后角膜愈合过程影响的对比研究较少,本研究采用AS-OCT和Pentacam眼前节分析仪测量并比较1.8 mm和2.2 mm同轴微切口超声乳化白内障摘出术后角膜构型变化,为临床上超声乳化白内障摘出术中角膜切口大小的选择提供参考依据。
1 资料与方法
1.1 一般资料
采用前瞻性非随机对照临床研究,选取2016年5月至2017年5月于延边大学附属医院行超声乳化白内障摘出联合人工晶状体植入术的年龄相关性白内障患者76例76眼,其中男40例,女36例;年龄50~82岁,平均(68.01±9.32)岁。纳入标准:(1)患者出现视物模糊、无痛性视力下降,经眼科检查诊断为年龄相关性白内障;(2)晶状体混浊,核硬度(参照LOCS Ⅲ标准)为Ⅱ~Ⅲ级;(3)术前角膜散光<1.0 D,角膜散光规则,眼睑结构和功能正常。排除标准:(1)有角膜病变、明显老年环、各种原因所致的角膜不规则散光者;(2)瞳孔不能散大或形态不圆者;(3)曾有眼外伤、葡萄膜炎、青光眼、高度近视、糖尿病等病史者;(4)有眼部手术史者;(5)有长期眼部用药史者;(6)合并严重心脏、肾脏和肝脏等疾病,全身情况欠佳无法耐受手术者;(7)神志不清、精神异常无法配合检查者。按照透明角膜切口大小的不同分为2.2 mm切口组和1.8 mm切口组,其中2.2 mm切口组37例37眼,年龄52~82岁,平均(66.82±9.42)岁;1.8 mm切口组39例39眼,年龄50~81岁,平均(69.14±8.31)岁。2个组患者性别构成比、年龄、术前眼压、晶状体核硬度分级比较,差异均无统计学意义(均P>0.05)(表1)。本研究遵循《赫尔辛基宣言》,经延边大学附属医院伦理委员会批准(批文号:2015153)。所有患者均签署知情同意书。

表1 2个组白内障患者术前基线资料比较Table 1 Comparison of baseline data between the two groups组别眼数性别构成比a(男/女,n/n)年龄b(mean±SD,岁)术前眼压b(mean±SD,mmHg)晶状体核硬度分级b(mean±SD)2.2mm切口组3720/1766.82±9.4212.80±2.852.41±0.711.8mm切口组3920/1969.14±8.3112.90±3.142.43±0.62χ2/t值0.0590.6400.6460.474P值0.8100.5200.5200.640 注:(a:χ2检验;b:独立样本t检验) 1mmHg=0.133kPa Note:(a:χ2test;b:Independent-samples t test) 1mmHg=0.133kPa
1.2 方法
1.2.1手术方法 手术均由同一位主刀医师完成。采用质量分数0.4%盐酸奥布卡因滴眼液(日本参天制药株式会社)表面麻醉,于11:00位用2.2 mm双锋角膜刀(美国爱尔康公司)和1.8 mm单锋角膜刀(美国博士伦公司)分别做2.2 mm和1.8 mm透明角膜隧道切口,于2:00位用1.0 mm穿刺刀(美国爱尔康公司)和15°穿刺刀(美国博士伦公司)分别作辅助侧切口,前房内注入黏弹剂(美国博士伦公司),撕囊镊连续环形撕囊,直径5.5 mm,充分水分离、水分层,2.2 mm和1.8 mm切口组分别使用Intrepid Infiniti系统和Stellaris系统行超声乳化摘出晶状体核,自动灌注系统吸除残留皮质,注入黏弹剂至囊袋内,2个组均使用HydroportPS27晶状体植入器植入M160人工晶状体,抽吸残余黏弹剂,前房形成,水密闭角膜切口。采用妥布霉素地塞米松眼膏(美国爱尔康公司)涂眼,包扎术眼。术后使用妥布霉素地塞米松眼膏涂眼,睡前1次,至术后15 d。
1.2.2观察指标 术中记录累积释放能量(cumulated dissipated energy,CDE)和有效超声乳化时间。CDE表示在扭动模式下超声时段内使用功率的平均百分比,计算方法:CDE=扭动振幅×扭动时间×0.4。术前、术后第1天、第1周和第1个月,使用Pentacam三维眼前节分析诊断系统(德国Oculus公司)测量角膜内皮细胞数量、中央角膜厚度(central corneal thickness,CCT)、直径3.0 mm范围角膜体积(corneal volume at 3.0 mm,CV3)和直径10.0 mm范围角膜体积(corneal volume at 10.0 mm,CV10);采用AS-OCT观察角膜切口内口哆开、基质水肿、外口哆开、后弹力层局部脱离和内皮错位发生情况,并测量角膜切口部位角膜厚度(图1)。
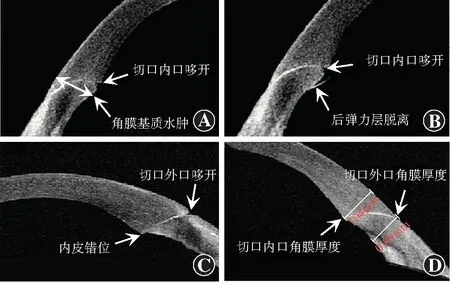
图1 角膜内外切口形态构型的AS-OCT图像 A:角膜切口内口哆开、角膜切口处基质水肿 B:角膜切口内口哆开、后弹力层脱离 C:角膜切口外口哆开及内皮错位 D:测量角膜切口内外口处角膜厚度Figure 1 AS-OCT image of the morphology of the corneal incision A:Endothelial gaping and stromal edema at the corneal incision B:Endothelial gaping and descemet flap at the corneal incision C:Epithelial gaping and endothelial dislocation at the corneal incision D:Corneal thickness measurement at epithelial and endothelial side of the incision
1.3 统计学方法
采用SPSS 21.0统计学软件进行统计分析。所有计量资料的数据经Shapiro-Wallis检验证实呈正态分布,以mean±SD表示。2个组患者性别构成比、术眼发生角膜切口内口哆开的发生率、愈合率和角膜内皮错位发生率比较采用χ2检验,2个组间年龄、术前眼压、术前晶状体核硬度分级、术中CDE、术中有效超声乳化时间、内皮细胞丢失率比较采用独立样本t检验。2个组术前和术后不同时间点角膜内皮细胞数量、CCT、CV3、CV10的总体差异比较采用重复测量两因素方差分析,两两比较采用LSD-t检验。2个组角膜切口内口角膜厚度与CDE的相关性采用线性回归分析。P<0.05为差异有统计学意义。
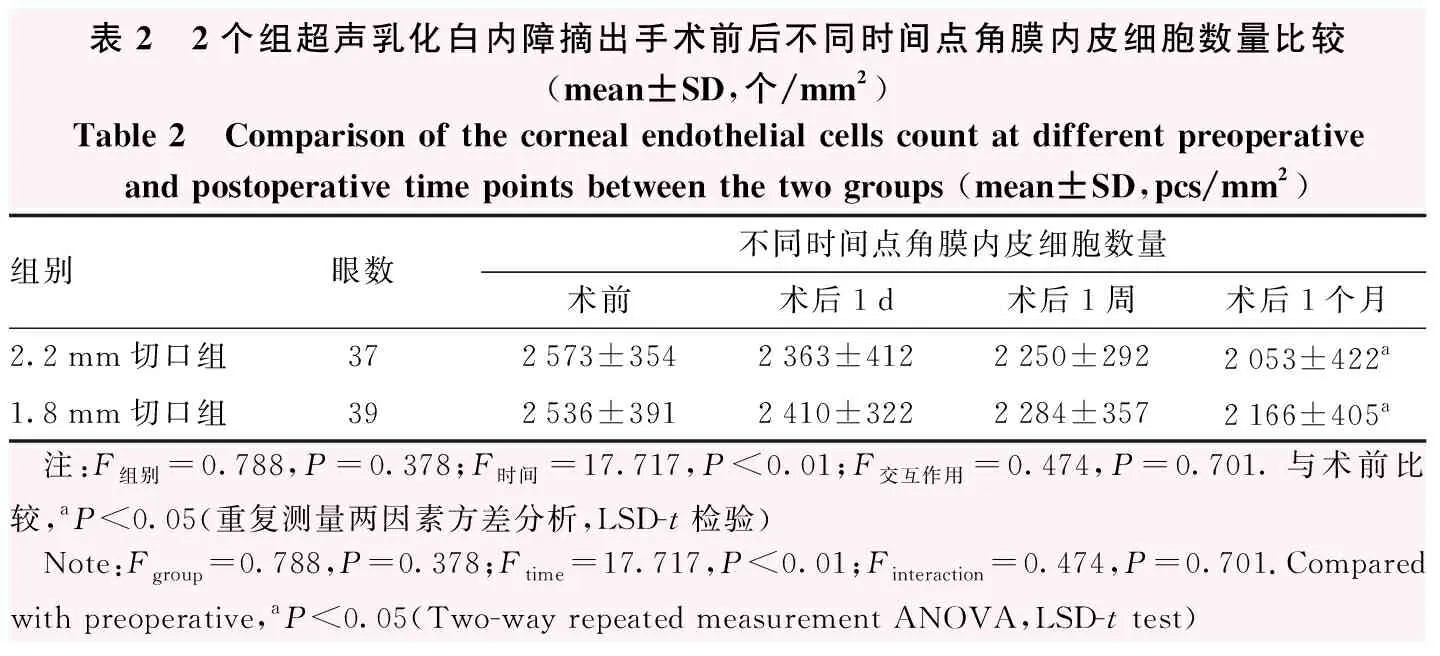
表2 2个组超声乳化白内障摘出手术前后不同时间点角膜内皮细胞数量比较(mean±SD,个/mm2)Table 2 Comparison of the corneal endothelial cells count at different preoperative and postoperative time points between the two groups (mean±SD,pcs/mm2)组别眼数不同时间点角膜内皮细胞数量术前术后1d术后1周术后1个月2.2mm切口组372573±3542363±4122250±2922053±422a1.8mm切口组392536±3912410±3222284±3572166±405a 注:F组别=0.788,P=0.378;F时间=17.717,P<0.01;F交互作用=0.474,P=0.701.与术前比较,aP<0.05(重复测量两因素方差分析,LSD-t检验) Note:Fgroup=0.788,P=0.378;Ftime=17.717,P<0.01;Finteraction=0.474,P=0.701.Compared with preoperative,aP<0.05(Two-way repeated measurement ANOVA,LSD-t test)
2 结果
2.1 2个组超声乳化白内障摘出术中CDE和有效超声乳化时间比较
2.2 mm切口组和1.8 mm切口组术中CDE分别为(19.56±4.51)%和(19.69±5.42)%,2个组比较差异无统计学意义(t=0.817,P=0.420)。2.2 mm切口组和1.8 mm切口组术中有效超声乳化时间分别为(5.87±2.43)s和(6.02±3.11)s,2个组比较差异无统计学意义(t=1.771,P=0.08)。
2.2 2个组超声乳化白内障摘出手术前后角膜后表面形态学改变及角膜内皮细胞数量变化比较
超声乳化白内障摘出术后1.8 mm切口组的角膜后表面的形态学构型发生显著变化,与术前相比角膜后表面的各位点高度明显改变(图2)。2.2 mm切口组和1.8 mm切口组角膜内皮细胞数量总体比较差异无统计学意义(F组别=0.788,P=0.378);手术前后角膜内皮细胞数量总体比较差异有统计学意义(F时间=17.717,P<0.01)。2个组术后随着时间推移角膜内皮细胞数量逐渐减少,术后1 d、1周角膜内皮细胞数量与术前比较差异均无统计学意义(均P>0.05),术后1个月角膜内皮细胞数量较术前明显减少,差异均有统计学意义(均P<0.05)(表2)。术后1个月2.2 mm切口组和1.8 mm切口组角膜内皮细胞丢失率分别为(20.20±4.90)%和(14.60±3.45)%,差异无统计学意义(t=1.543,P=0.127)。

图2 1.8 mm切口组手术前后角膜后表面地形图 术后1 d,1.8 mm切口组的角膜后表面各位点高度较术前明显改变 A:术前 B:术后1 d C:手术前后差异Figure 2 Topographic map of the posterior corneal surface before and after surgery in the 1.8 mm incision group On day 1 after surgery,the height of each point of the postoperative posterior corneal surface in the 1.8 mm incision group was significantly changed compared with that before surgery A:Before surgery B:One day after surgery C:Differences between before and 1 day after surgery
2.3 2个组超声乳化白内障摘出手术前后CCT比较
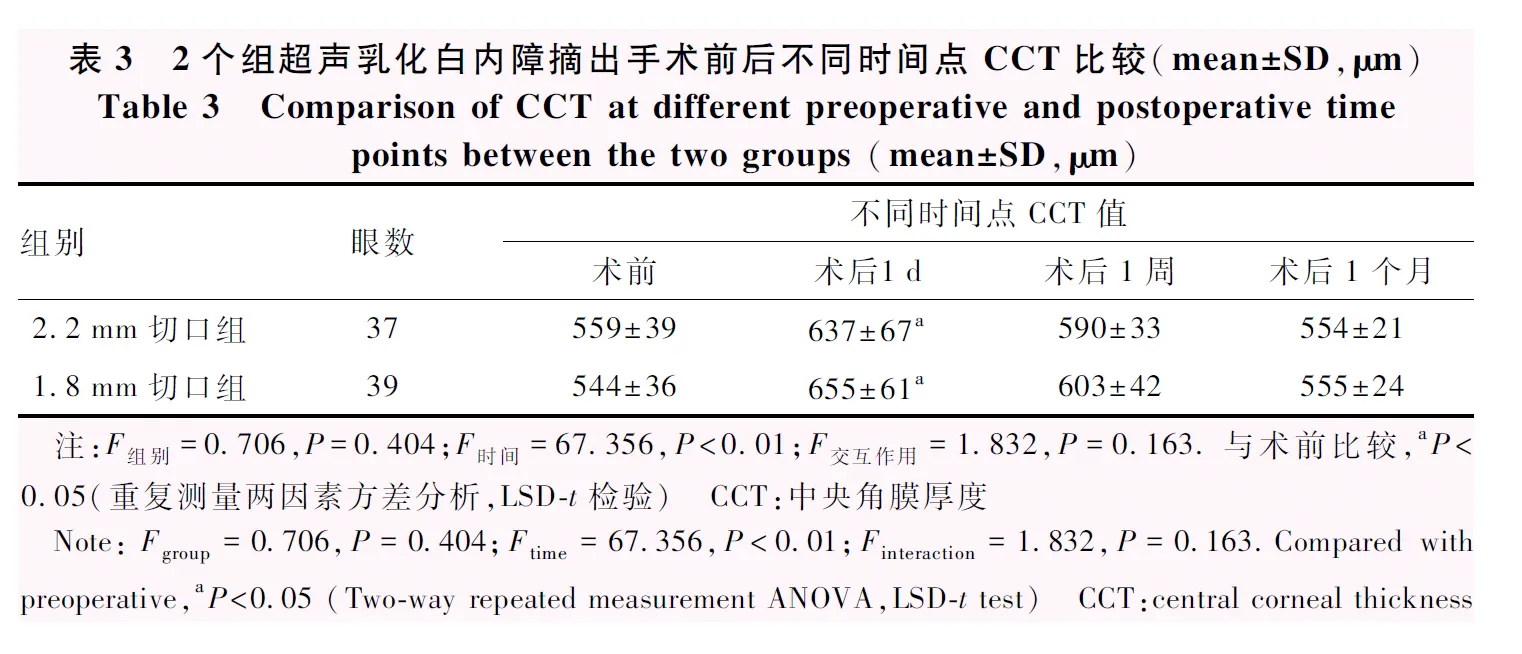
2.2 mm切口组和1.8 mm切口组CCT总体比较差异无统计学意义(F组别=0.706,P=0.404);手术前后CCT总体比较差异有统计学意义(F时间=67.356,P<0.01)。术后1 d,2个组CCT均较术前明显增厚,差异均有统计学意义(均P<0.05);随着时间推移,2个组CCT逐渐恢复至术前水平,术后1周、1个月CCT与术前相比差异均无统计学意义(均P>0.05)(表3)。
术前2个组距角膜中央不同距离的角膜厚度均无明显差别;术后1 d,1.8 mm切口组距角膜中央6~10 mm处角膜厚度较2.2 mm切口组明显增厚;术后1周,2个组周边角膜厚度逐渐趋于一致(图3)。

图3 2个组手术前后不同时间点距角膜中央不同距离角膜厚度变化图 术后1 d,1.8 mm切口组周边(6~10 mm)角膜厚度较2.2 mm切口组明显增厚;术后1周,2个组周边角膜厚度趋于一致(各图中虚线为参照线位置)Figure 3 The corneal thickness changes at different distances from the center of cornea at different preoperative and postoperative time points between the two groups The peripheral (6-10 mm) corneal thickness in the 1.8 mm group was significantly thicker than that in the 2.2 mm group on the first day after surgery,and it tended to be the same in the two groups at one week after surgery (Dashed lines referred to the position references)
2.4 2个组超声乳化白内障摘出手术前后角膜体积比较
2.2 mm切口组和1.8 mm切口组CV3总体比较差异无统计学意义(F组别=3.692,P=0.106);手术前后CV3总体比较差异有统计学意义(F时间=17.577,P<0.01)。术后1 d,2个组CV3均较术前明显增加,差异均有统计学意义(均P<0.05);随着时间推移,2个组CV3逐渐恢复至术前水平,术后1周、1个月与术前比较差异均无统计学意义(均P>0.05)(表4)。

2.2 mm切口组和1.8 mm切口组CV10总体比较差异无统计学意义(F组别=4.341,P=0.041);手术前后CV10总体比较差异有统计学意义(F时间=13.559,P<0.01)。术后1 d,2个组CV10均较术前明显增加,差异均有统计学意义(均P<0.05);随着时间推移,2个组CV10逐渐恢复至术前水平,术后1周、1个月与术前比较差异均无统计学意义(均P>0.05)(表5)。

2.5 2个组超声乳化白内障摘出手术前后角膜切口结构比较
术后1 d,1.8 mm切口组和2.2 mm切口组术眼角膜切口内口哆开的发生率分别为54%(21/39)和38%(14/37),2个组比较差异无统计学意义(χ2=1.958,P=0.16);术后1 d,1.8 mm切口组和2.2 mm切口组术眼角膜内皮错位发生率分别为78%(30/39)和56%(21/37),2个组比较差异无统计学意义(χ2=3.498,P=0.06)。术后1个月,1.8 mm切口组术眼角膜切口内口哆开的发生率为12.8%(5/39),明显高于2.2 mm切口组的0.0%(0/37),2个组比较差异有统计学意义(χ2=5.078,P=0.024);术后1个月,1.8 mm切口组术眼角膜内皮错位的发生率为5.1%(2/39),高于2.2 mm切口组的2.7%(1/37),但2个组比较差异无统计学意义(χ2=0.295,P=0.590)。
2.6 2个组超声乳化白内障摘出手术前后切口处角膜厚度变化
2.2 mm切口组和1.8 mm切口组角膜切口外口处角膜厚度变化总体比较差异无统计学意义(F组别=4.182,P=0.074);手术前后角膜切口外口处角膜厚度总体比较差异有统计学意义(F时间=80.076,P<0.01)。术后1 d,角膜切口外口处平均角膜厚度较术前显著增加,差异均有统计学意义(均P<0.05);随着时间推移,角膜水肿逐渐消退,术后1周、1个月2个组角膜切口外口处角膜厚度与术前比较,差异均无统计学意义(均P>0.05)(表6)。

表6 2个组超声乳化白内障摘出手术前后不同时间点角膜切口外口处角膜厚度比较(mean±SD,μm)Table 6 Comparison of corneal thickness at epithelial side of the incision at different preoperative and postoperative time points between the two groups (mean±SD,μm)组别眼数不同时间点角膜切口外口处角膜厚度术前术后1d术后1周术后1个月2.2mm切口组37771±52904±50a847±73776±671.8mm切口组39786±61923±79a866±60791±52 注:F组别=4.182,P=0.074;F时间=80.076,P<0.01;F交互作用=0.022,P=0.997.与术前比较,aP<0.05(重复测量两因素方差分析,LSD-t检验) Note:Fgroup=4.182,P=0.074;Ftime=80.076,P<0.01;Finteraction=0.022,P=0.997.Compared with preoperative,aP<0.05 (Two-way repeated measurement ANOVA,LSD-t test)
2.2 mm切口组和1.8 mm切口组角膜切口内口处手术前后不同时间点角膜厚度总体比较,差异均有统计学意义(F组别=11.906,P=0.032;F时间=307.198,P<0.01)。术前2个组角膜切口内口角膜厚度比较,差异无统计学意义(P=0.749);术后1 d,2.2 mm切口组和1.8 mm切口组角膜切口内口角膜厚度较术前显著增加,差异均有统计学意义(均P<0.01),与2.2 mm切口组比较,1.8 mm切口组角膜切口内口角膜厚度明显较厚,2个组间比较差异有统计学意义(P=0.042)(表7)。
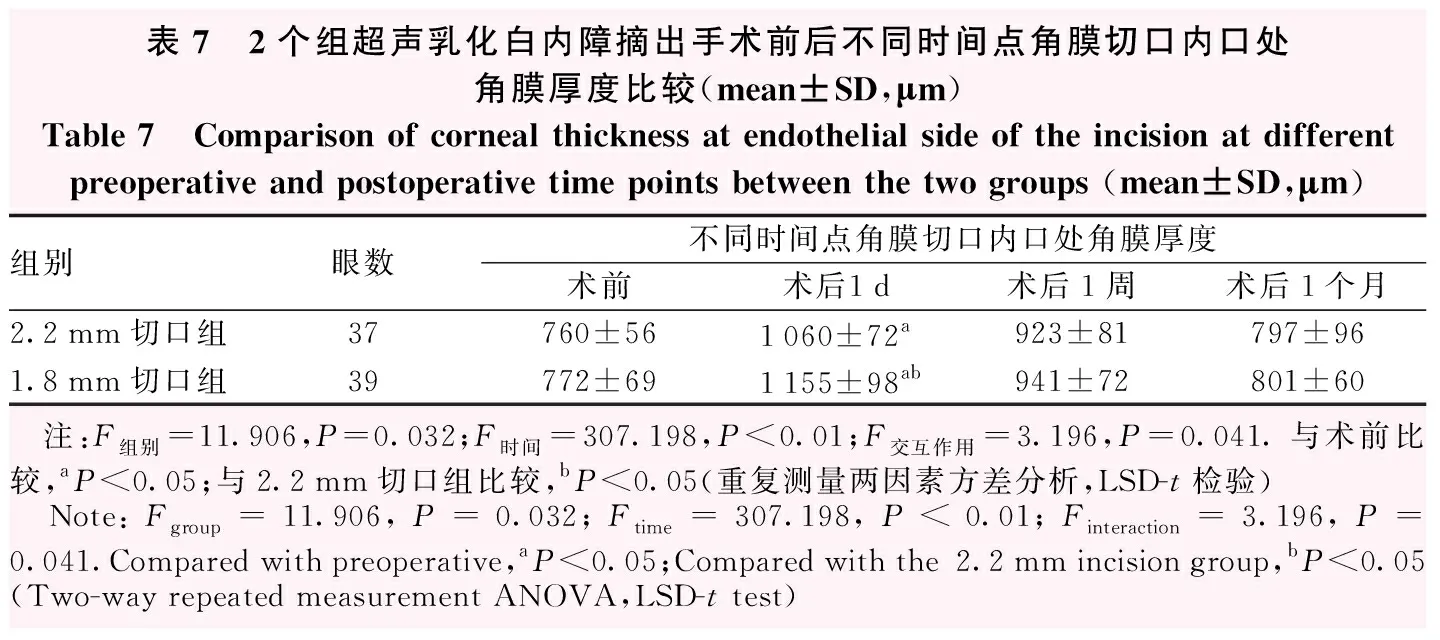
表7 2个组超声乳化白内障摘出手术前后不同时间点角膜切口内口处角膜厚度比较(mean±SD,μm)Table 7 Comparison of corneal thickness at endothelial side of the incision at different preoperative and postoperative time points between the two groups (mean±SD,μm)组别眼数不同时间点角膜切口内口处角膜厚度术前术后1d术后1周术后1个月2.2mm切口组37760±561060±72a923±81797±961.8mm切口组39772±691155±98ab941±72801±60 注:F组别=11.906,P=0.032;F时间=307.198,P<0.01;F交互作用=3.196,P=0.041.与术前比较,aP<0.05;与2.2mm切口组比较,bP<0.05(重复测量两因素方差分析,LSD-t检验) Note:Fgroup=11.906,P=0.032;Ftime=307.198,P<0.01;Finteraction=3.196,P=0.041.Compared with preoperative,aP<0.05;Compared with the 2.2mm incision group,bP<0.05 (Two-way repeated measurement ANOVA,LSD-t test)
术后1 d,2.2 mm切口组和1.8 mm切口组角膜切口内口角膜厚度与CDE均呈正相关(r=0.231,P=0.025;r=0.347,P=0.003)(图4)。

图4 2个组CDE与角膜切口内口处角膜厚度的相关性分析 术后第1天,1.8 mm切口组和2.2 mm切口组的CDE与角膜切口内口处角膜厚度均呈正相关(r=0.231,P=0.025;r=0.347,P=0.003) A:1.8 mm切口组 B:2.2 mm切口组 CDE:累积释放能量Figure 4 Correlation analysis between CDE and corneal thickness at the endothelial side of the incision in two groups The CDE of the 1.8 mm incision group and the 2.2 mm incision group were positively correlated with the corneal thickness at the endothelial side of the incision on postoperative day 1 (r=0.231,P=0.025;r=0.347,P=0.003) A:1.8 mm incision group B:2.2 mm incision group CDE:cumulated dissipated energy
3 讨论
随着手术技术及设备的不断改善,白内障手术正朝着缩小手术切口、减小手术源性散光、缩短术后恢复时间的方向发展。虽然较小的角膜切口在白内障手术中通常是优选的,但必须考虑其可能带来的切口恢复及术后角膜内皮完整性等相关并发症[12]。微切口白内障手术是指角膜切口小于2.0 mm的超声乳化白内障摘出术[2]。既往研究表明,同轴微切口白内障手术较标准切口(3.0~3.2 mm)白内障手术具有恢复时间短、切口渗漏发生率低、术源性散光低及角膜内皮细胞损伤程度低等优势[4]。超声乳化白内障摘出术后在透明角膜切口部位常发生角膜内皮损伤和角膜形态学的变化,而角膜形态学的变化对切口渗漏和眼内炎等术后并发症的发生、切口愈合速度、手术源性散光的大小及术后视力情况有直接影响[5]。因此,观察透明角膜切口的形态学构型变化和角膜水肿程度对超声乳化白内障摘出术后视功能的恢复有重要意义。
白内障术后发生角膜水肿的直接原因是角膜内皮细胞损伤[7],角膜内皮细胞是保持角膜透明的关键,其损伤程度是影响术后视觉效果的重要因素之一。研究表明,角膜内皮细胞数量随着年龄增长逐年减少,且白内障手术是造成角膜内皮细胞丢失不可忽略的因素之一[13-14]。超声乳化白内障摘出术对角膜内皮细胞的损伤机制包括热灼伤、震荡伤、术中超乳手柄反复操作导致角膜扭曲和眼内灌注液成分的刺激等一系列机械损伤及化学损伤[4,15]。角膜内皮损伤的程度与超声乳化时间和超声乳化期间高功率输出比例等术中因素密切相关[10],且相关术中因素损伤角膜内皮与术后角膜水肿存在相关性[16]。而本研究中角膜地形图结果显示白内障术后角膜后表面的各位点高度明显改变,2个组白内障术后角膜内皮细胞数量较术前明显减少,术后2个组间角膜内皮细胞数量、术中2个组超声乳化CDE和有效超声乳化时间差异均无统计学意义。
本研究中,术后1 d 2个组角膜厚度均较术前显著增加,2个组间CCT比较差异无统计学意义,1.8 mm切口组周边处角膜厚度较2.2 mm切口组明显增厚,考虑该差异是因切口处角膜水肿程度不同导致,进一步检测术后1 d 2个组角膜切口内口及外口处角膜厚度,发现2个组角膜切口外口处角膜厚度差异无统计学意义,而1.8 mm切口组角膜切口内口处角膜厚度较2.2 mm切口组厚,说明1.8 mm切口组切口处角膜水肿更重,分析其原因可能是术中超乳手柄的针头散发出的热能对切口组织的损伤所致。Mencucci等[17]研究也证实切口水肿程度受超声能量及使用时间的影响。本研究结果显示,术后第1天角膜切口内口角膜厚度与CDE呈正相关,因此减少术中超声乳化能量会降低术后角膜水肿程度。AS-OCT观察发现,超声乳化CDE与切口部位角膜厚度呈正相关[18],与本研究结果一致。白内障术后角膜基质水肿至少持续24 h[19],随时间推移角膜水肿逐渐消退,本研究结果显示术后1个月角膜厚度恢复到术前水平。
超声乳化白内障摘出术后角膜切口部位常发生角膜水肿、内皮错位、内皮后脱离、内口及外口哆开等。本研究结果显示,术后1 d 1.8 mm切口组角膜切口内口哆开和角膜内皮错位发生率较2.2 mm切口组高,而且1.8 mm切口组较2.2 mm切口组内口哆开和内皮错位恢复速度慢;同时,还发现角膜切口内口哆开和内皮错位的患者中切口处角膜水肿更加严重。分析其原因可能是由于术中反复多次的手术器械进出及术中撬动,使切口所在径线的组织松弛,导致切口轻度错位及内口闭合不良;另外,人工晶状体从切口植入对切口隧道的拉伸及挤压作用也是影响切口闭合的因素,较小的切口该损伤程度更大,因此1.8 mm切口组的角膜切口水肿程度较2.2 mm切口组重,1.8 mm切口组角膜切口内口哆开和内皮错位发生率较2.2 mm切口组高。有研究显示当手术器械进入前房,尤其是当切口隧道太紧时可能会拉伸切口,从而导致机械切割对角膜隧道中的胶原纤维施加压力并导致切口扭曲,此外手术前后眼压、切口角度等均会影响超声乳化术后角膜构型变化[20-21]。
综上所述,本研究结果表明与2.2 mm角膜切口比较,1.8 mm角膜切口超声乳化白内障摘出术后角膜切口内口哆开和内皮错位发生率较高,角膜切口恢复较慢。但本研究收集的病例数较少,术后随访时间较短,且未能探讨各个观察指标与视觉质量及波前像差之间的关联等因素,其具体影响还有待进一步研究。
利益冲突所有作者均声明不存在利益冲突
