青黛通过影响GPR41/43信号通路调控溃疡性结肠炎大鼠Treg/Th17免疫平衡的机制研究*
2021-05-12孙中美李军祥路琼琼丁庞华赵兴杰毛堂友
孙中美 李军祥 路琼琼 丁庞华 史 瑞 赵兴杰 谭 祥 姜 慧 毛堂友
(北京中医药大学东方医院,北京 100078)
溃疡性结肠炎是一种发生于结、直肠黏膜的反复发作的非特异炎症性疾病,主要表现为腹泻、黏液脓血便、腹痛、里急后重等,严重影响患者的生活质量[1]。前期研究发现,青黛可通过调节肠道菌群及短链脂肪酸丁酸水平,从而明显改善DSS诱导的结肠炎,但是下游具体调控机制尚未阐明[2]。最新研究表明,G蛋白偶联受体(GPRs)可作为丁酸的特异性受体,介导肠上皮细胞的屏障功能,维持机体的免疫稳态[3]。本实验在前期研究的基础上,从GPRs信号入手,重点研究其下游Th17/Treg细胞相关因子的表达,以进一步探究青黛治疗溃疡性结肠炎的具体作用机制。
1 材料与方法
1.1 实验动物 健康的SPF级雄性SD大鼠(180~220 g)购自斯贝福(北京)生物技术有限公司,许可证号SCXK-2016-0002,饲养于北京中医药大学东方医院实验动物中心,温度20~24℃;相对湿度50%~60%,12 h光照/黑暗循环,所有大鼠自由进食饮水。
1.2 药物 青黛配方颗粒购自北京康仁堂药业有限公司,药物的制备及质量检测均由北京康仁堂药业有限公司完成。每日灌胃前,将青黛充分溶解于烧开的去离子水中,获得青黛溶液;根据前期研究,本实验青黛剂量折合生药量为 600 mg/kg[2]。
1.3 试剂与仪器 葡聚糖硫酸钠(MW36-50KDa;MP Biomedical,Burlingame,CA,USA),便潜血试纸(珠海贝索生物技术有限公司,广东珠海),GPR41抗体(OmnimAbs,OM184469),GPR43抗体(OmnimAbs,OM173356),FOXP3抗体(OmnimAbs,OM279147),RORγ抗体(OmnimAbs,OM188985);反转录试剂盒:HiFiScript快速去基因组cDNA第一链合成试剂盒(康为世纪,CW2582);qPCR试剂盒:KAPA SYBR FAST qPCR Kit Master Mix(2×)(KAPA Biosystems,KK4601)。
1.4 分组及干预 本实验是前期研究的延伸,大鼠分组、造模以及各组干预方法均如前报道[2]。24只健康的SPF级雄性SD大鼠适应性喂养7 d后,随机分为空白组、模型组、青黛组。模型组、青黛组大鼠自由饮用4.5% DSS水溶液以制备结肠炎模型,空白组大鼠自由饮用去离子水作为对照;同时青黛组大鼠予青黛(600 mg/kg)灌胃处理,空白组、模型组予去离子水灌胃处理。干预7 d后麻醉处死大鼠,取血及结肠组织。
1.5 Western Blotting法检测结肠 GPR41、GPR43、RORγt、FOXP3蛋白表达 称取大鼠结肠组织,加入含有蛋白酶抑制剂的RIPA裂解液,充分匀浆后,4℃13 000 r/min离心20 min,提取上清液。按照BCA蛋白定量试剂盒使用说明操作,测定蛋白浓度;随后电泳,转膜,封闭;兔抗大鼠GPR41(1∶500)、GPR43(1∶500)、FOXP3(1∶500)、RORγ(1∶500)抗体,小鼠抗大鼠 β-Actin(1∶1 000)抗体,4℃孵育过夜。TBST洗膜3次,每次10 min;加入山羊抗兔辣根过氧化物酶标记IgG(1∶1 000),室温孵育 40min。TBST洗膜,ECL显影,Gel Image system ver.4.00分析蛋白条带灰度,计算目标蛋白含量。
1.6 RT-qPCR检测结肠孤核受体(RORγt)mRNA、叉头蛋白P3(FOXP3)mRNA的表达 Trizol法提取结肠组织总RNA,应用逆转录试剂盒反转录成cDNA后,加入相应引物按照试剂盒说明进行PCR扩增,计算各组2-ΔΔCt值,求得目的基因相对于GAPDH基因的mRNA表达量。RORγt、FOXP3、GAPDH的引物序列及长度如表1。
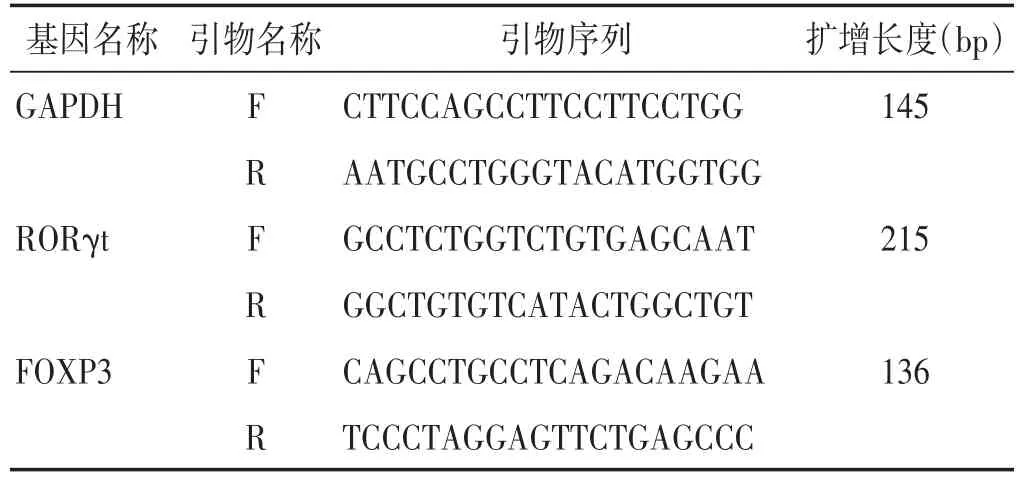
表1 PCR引物序列
1.7 ELISA法检测血清IL-10、IL-17含量 大鼠腹主动脉取血后,4℃4 000 r/min离心10 min分离血清,应用大鼠IL-10、IL-17酶联免疫试剂盒,按照说明书检测大鼠血清中IL-10、IL-17的浓度。
1.8 统计学处理 应用GraphPad Prism 8.01对实验数据进行统计处理,以()表示,数据符合正态分布且通过方差齐性检验,进行单因素方差分析,不符合正态分布或方差不齐者则进行非参数检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠结肠GPR41、GPR43蛋白表达比较 见图1,表2。与空白组比较,模型组GPR41、GPR43蛋白的表达均显著降低(P<0.05),经过青黛治疗后,GPR41、GPR43蛋白的表达较模型组明显增加(P<0.05)。

图1 各组大鼠结肠GPR41、GPR43蛋白的表达
表2 各组大鼠结肠GPR41、GPR43蛋白表达比较(±s)

表2 各组大鼠结肠GPR41、GPR43蛋白表达比较(±s)
注:与模型组比较,*P<0.05,**P<0.01;与空白组比较,△P<0.05,△△P<0.01。下同。
组别空白组模型组青黛组n 8 8 8 GPR41 0.4609±0.0465 0.2183±0.0335△0.4405±0.0644*GPR43 0.4736±0.0170 0.2100±0.0962△0.4555±0.0176*
2.2 各组大鼠结肠RORγt、FOXP3 mRNA表达比较 见表3。与空白组相比,DSS诱导的结肠炎模型大鼠结肠RORγt的基因表达增加,而FOXP3的基因表达下降;经青黛干预后,RORγt mRNA的表达较模型组明显降低(P<0.05),FOXP3 mRNA的表达则明显升高(P<0.05)。
表3 各组大鼠结肠RORγt、FOXP3 mRNA表达比较(±s)
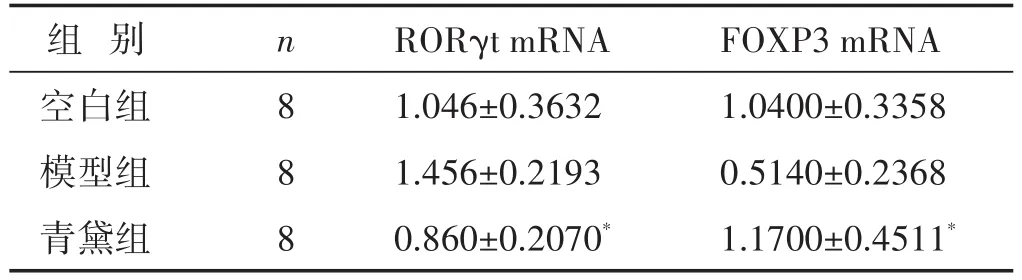
表3 各组大鼠结肠RORγt、FOXP3 mRNA表达比较(±s)
组别空白组模型组青黛组n 8 8 8 RORγt mRNA 1.046±0.3632 1.456±0.2193 0.860±0.2070*FOXP3 mRNA 1.0400±0.3358 0.5140±0.2368 1.1700±0.4511*
2.3 各组大鼠结肠RORγt、FOXP3蛋白表达的比较 见图2,表4。与空白组比较,模型组大鼠结肠RORγt蛋白的表达显著提高(P<0.01),FOXP3蛋白表达显著降低(P<0.01);青黛干预后,大鼠结肠RORγt蛋白的表达较模型组大鼠明显降低(P<0.05),FOXP3蛋白的表达显著提高(P<0.01)。
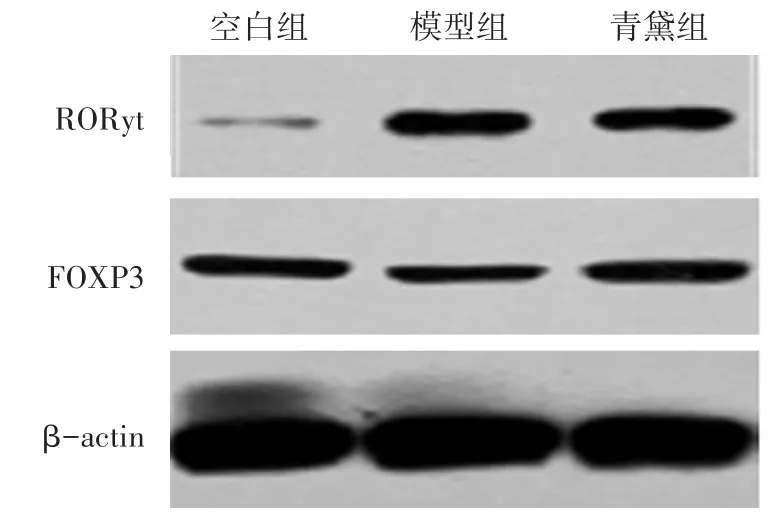
图2 各组大鼠结肠RORγt、FOXP3蛋白的表达
表4 各组大鼠结肠RORγt、FOXP3蛋白表达比较(±s)
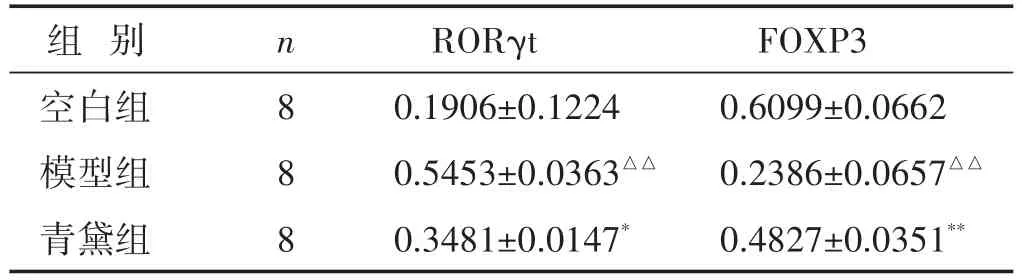
表4 各组大鼠结肠RORγt、FOXP3蛋白表达比较(±s)
组别空白组模型组青黛组n 8 8 8 RORγt 0.1906±0.1224 0.5453±0.0363△△0.3481±0.0147*FOXP3 0.6099±0.0662 0.2386±0.0657△△0.4827±0.0351**
2.4 各组大鼠血清IL-10、IL-17水平比较 见表5。与空白组相比,模型组大鼠血清IL-10含量明显降低(P<0.05),而血清IL-17含量明显升高(P<0.05),经青黛干预后,大鼠血清IL-10含量较模型组大鼠明显升高(P<0.05),血清IL-17含量明显降低(P<0.05)。
表5 各组大鼠血清IL-10、IL-17水平比较(pg/mL,±s)

表5 各组大鼠血清IL-10、IL-17水平比较(pg/mL,±s)
组别空白组模型组青黛组n 8 8 8 IL-10 43.60±9.015 30.28±4.962△43.37±2.244*IL-17 1.524±0.2742 2.034±0.1576△1.564±0.2319*
3 讨论
溃疡性结肠炎病变呈连续性分布,主要累及结肠、直肠的黏膜和黏膜下层;以腹泻、黏液脓血便、腹痛、里急后重为主要症状并常伴有皮肤、关节等肠外表现[4-5]。溃疡性结肠炎发病机制复杂,包括环境因素、生活方式、遗传因素、肠道菌群紊乱、免疫反应失调等[6]。目前针对本病,西医的主要治疗方法包括水杨酸制剂、糖皮质激素制剂、免疫抑制剂、生物制剂等,但存在不良反应明显、价格昂贵等问题。前期临床研究证明中医药治疗溃疡性结肠炎症状改善明显,安全性好[7]。
青黛具有清热解毒、凉血消斑的功效[8],临床广泛应用于皮肤黏膜疾病、溃疡性结肠炎等的治疗[9]。靛蓝和靛玉红为青黛的主要活性成分[10]。本项目组前期研究中利用高效液相法对青黛配方颗粒中靛蓝、靛玉红的含量进行测定,分别为300.7、1.45 μg/mg,并且发现青黛能够通过改善肠道菌群失调、提高短链脂肪酸,尤其是丁酸的含量,从而缓解DSS诱导的结肠炎[2]。本实验在前期研究的基础上,重点研究GPR41/43及下游Th17/Treg细胞相关因子的表达,探究中药青黛治疗溃疡性结肠炎的具体作用机制。
GPR41、GPR43属于G蛋白偶联受体家族成员,广泛表达于脂肪组织、肠道、肝脏、脾脏等,是短链脂肪酸的主要受体。炎症反应发生时,GPRs可以调节炎性因子产生,抑制炎性T细胞的增殖,起到缓解炎症的作用[11-12]。此外,有研究证明,GPR43在被短链脂肪酸激活后,能够诱导Treg细胞的分化[13],有效预防肠道炎症,且在修复肠黏膜损伤中也发挥了重要的作用[14]。目前认为Th17/Treg轴的平衡失调与溃疡性结肠炎的发生发展关系密切,是治疗溃疡性结肠炎的重要靶点之一[15]。临床研究证明,IBD患者外周血中Treg细胞显著降低,Th17细胞显著升高,两者比例严重失衡[16]。Th17是一类CD4+T细胞,IL-6与TGF-β共同诱导RORγt的表达,诱导Th17细胞的分化[17];Th17细胞由于具有分泌IL-17的能力而被命名,可以产生包括但不限于IL-17,IL-22和IL-23等细胞因子,具有募集中性粒细胞,并在感染部位促进炎症的作用,在众多炎症性疾病中扮演者重要的角色。Treg细胞产生抗炎细胞因子IL-10等,抑制各种免疫细胞的活性,从而抑制过度的免疫反应。Th17与Treg在炎症和免疫反应中起到了相反的作用[18],维持两者之间的动态平衡至关重要。
本研究发现,与空白组相比,DSS诱导的结肠炎大鼠肠道短链脂肪酸受体GPR41、GPR43表达明显降低,其下游Th17细胞转录因子RORγt的表达及细胞因子IL-17水平明显升高,而Treg细胞的转录因子FOXP3的表达及细胞因子IL-10水平明显降低;青黛的干预明显逆转了上述改变,与模型组大鼠相比,青黛组大鼠结肠GPR41、GPR43蛋白表达明显升高,RORγt、IL-17表达明显降低,FOXP3、IL-10表达量明显升高,结合前期研究结果,表明青黛通过影响GPR41/43信号通路调节下游Th17/Treg平衡治疗溃疡性结肠炎的机制。本项研究完善了青黛通过调节“菌群-代谢-免疫”信号轴治疗溃疡性结肠炎的作用机制,为青黛的临床应用提供了进一步的科学依据。
