RNA靶向的CRISPR/CasRx系统在小鼠精原细胞系GC1-spg中的应用
2021-05-12李梦真邹定峰缪时英王琳芳
李梦真,柳 俊,邹定峰,缪时英,王琳芳,宋 伟,李 凯
(中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室, 北京 100005)
成族规律间隔短回文重复序列(clustered regularly interspaced short palindromic repeats,CRISPR)/CRISPR关联因子(CRISPR associated,Cas)系统是细菌和古细菌物种抵御入侵的噬菌体和核酸中的外来遗传元件的一种免疫应答方式[1],其通过各种CRISPR/Cas系统的RNA引导的核酸内切酶结合和切割外来遗传元件而发挥作用[2]。尽管在先前的报道中,CRISPR/Cas9系统已经被广泛应用于在DNA层面进行基因编辑以剖析特定遗传元件的功能或纠正致病突变[3],但当不适合对基因组DNA进行永久修改(例如敲除致死) 以及涉及生物安全问题时,或者用于治疗RNA病毒感染疾病(例如SARS-CoV-2感染)[4]时,RNA靶向基因编辑技术就尤为重要。CasRx是CRISPR系统中鉴定出的一种新的、由RNA引导的、靶向RNA的Cas核酸酶,其能够实现对转录组高效和特异的敲降[5]。迄今为止,CRISPR/CasRx介导的基因沉默已经被广泛使用,例如抑制胰腺导管腺癌的发生发展[6]小鼠中用于神经细胞命运操纵[7]、肝脏代谢调节[4]、预防新血管形成以及植物[8]和胚胎[9]中特异基因敲降。尽管RNA靶向的CRISPR/CasRx系统具有广泛的应用前景,但是在雄性生殖领域中还未有相关应用的报道。本项研究验证了CRISPR/CasRx在HEK-293T细胞中可敲降egfp(enhanced green fluorescent protein)和mCherry外源基因,以及特异敲降HEK-293T细胞内源基因,包括mRNA和lncRNA(long non-coding RNA)。为了评估CRISPR/CasRx系统在雄性生殖领域中的应用潜力,选取了GC1-spg细胞并利用该系统靶向egfp和mCherry外源基因进行了验证。
1 材料与方法
1.1 材料
人胚肾细胞系293T(human embryonic kidney cell line,HEK-293T)、小鼠精原细胞系GC1-spg(本课题组保存);EF1a.CasRx.2A.EGFP、CasRx.pregRNA cloning backbone(武汉淼灵生物科技有限公司);lenti.Guide.mCherry、lenti.Guide. tdTomato(王晓月教授馈赠);DMEM高糖培养基(HyClone公司);Fatal bovine serum(Gibco公司);Opti-MEM培养基、penicillin-streptomycin(Life Technologies公司);Q5 Hot Start HiFi PCR Master Mix、T4 DNA Ligase(NEB公司);5×DNA loading dye(Generay公司);Revert Aid First Strand cDNA Synthesis Kit、SYBR Green Master Mix、Fast DigestPacⅠ(Thermo Fisher Scientifical公司);PEI(Polysciences公司);琼脂糖凝胶回收试剂盒、质粒中提试剂盒(北京康为世纪生物科技有限公司);SDS-PAGE快速凝胶试剂盒(上海雅酶生物科技有限公司);E.coliTrans5αChemically Compe-tent Cell(TransGene Biotech公司);EcoRⅠ(TaKaRa公司);GFP antibody(Cell Signaling公司);mCherry antibody(Proteintech公司);引物(北京擎科生物科技有限公司合成,见表1,2);gRNA序列(北京天一辉远生物科技有限公司合成,见表3)。

表1 PCR及测序引物序列Table 1 Primers for PCR and sequenc

表2 实时荧光定量PCR(q-PCR)引物序列Table 2 Real-time fluorescent quantitative PCR(q-PCR) primer sequence

表3 gRNA序列Table 3 gRNA sequence
1.2 方法
1.2.1 质粒的构建:利用SnapGene设计lenti. EF1a.EGFP、lenti.EF1a.mCherry、lenti.EF1a. tdTomato目的质粒,Q5高保真PCR Mix扩增目的片段,同时使用PacⅠ和EcoRⅠ内切酶酶切慢病毒表达载体,纯化回收目的片段。使用同源重组酶连接目的片段和载体,转化E.coliTrans5α感受态细菌内,12 h后挑取单克隆菌落,送擎科公司进行测序,比对测序结果后,质粒提取。同上方法,PCR获得EF1a core promoter、CasRx、SV40、U6-DRs和载体片段,连接到AAV表达载体,测序比对后质粒提取。
1.2.2 瞬时转染:在6孔板培养皿内铺约106个细胞,17 h后换液。配置转染试剂,按照1∶1的比例加入Max转染试剂,静置30 min后滴加入培养基内,24 h后换为正常的DMEM,48 h后收细胞进行检测。
1.2.3 细胞培养:HEK-293T细胞及GC1-Spg细胞均在DMEM高糖培养基(含10%胎牛血清、1%青/链霉素)、5% CO2、37 ℃恒温培养。
1.2.4 gRNA设计及连接:gRNA设计于https://cas13design.nygenome.org,将得分前3名的gRNA进行比对之后合成。通过BplⅠ内切酶酶切AAV.EF1a.CasRx.U6.DRs载体以及合成的gRNA片段,T4 DNA连接酶连接。
1.2.5 Western blot检测蛋白的表达:用1×SDS 80 μL裂解细胞样品,100 ℃变性,12 000 r/min离心5 min吸取上清,弃去细胞碎片,用BCA法进行蛋白定量。用10% SDS-PAGE快速凝胶试剂盒,加入蛋白样品,使用相应的抗体进行检测。
1.2.6 q-PCR检测mRNA水平:1 mL Trizol加入细胞沉淀内,加入异丙醇12 000 r/min 15 min离心获取沉淀,使用70%冰乙醇进行洗涤2遍,使用预热的DEPC水进行溶解。
1.2.7 流式细胞分选术分析阳性细胞:使用0.25%胰蛋白酶将细胞消化下来后,PBS洗涤细胞1遍,之后使用40 μm滤膜进行过滤,使用流式细胞仪进行EGFP和mCherry阳性细胞的分选,使用FlowJo软件分析。
1.3 统计学分析

2 结果
2.1 构建CasRx-gRNA 表达质粒和荧光表达质粒
通过PCR扩增获得对应长度的目的片段,测序结果连接成功且无突变,经质粒提取获得EF1a core promoter.CasRx.SV40.U6.DRs质粒(图1A,B)。通过PCR扩增获得对应长度的目的片段和酶切后的载体片段,质粒提取获得3种荧光表达质粒(图1C,D)。
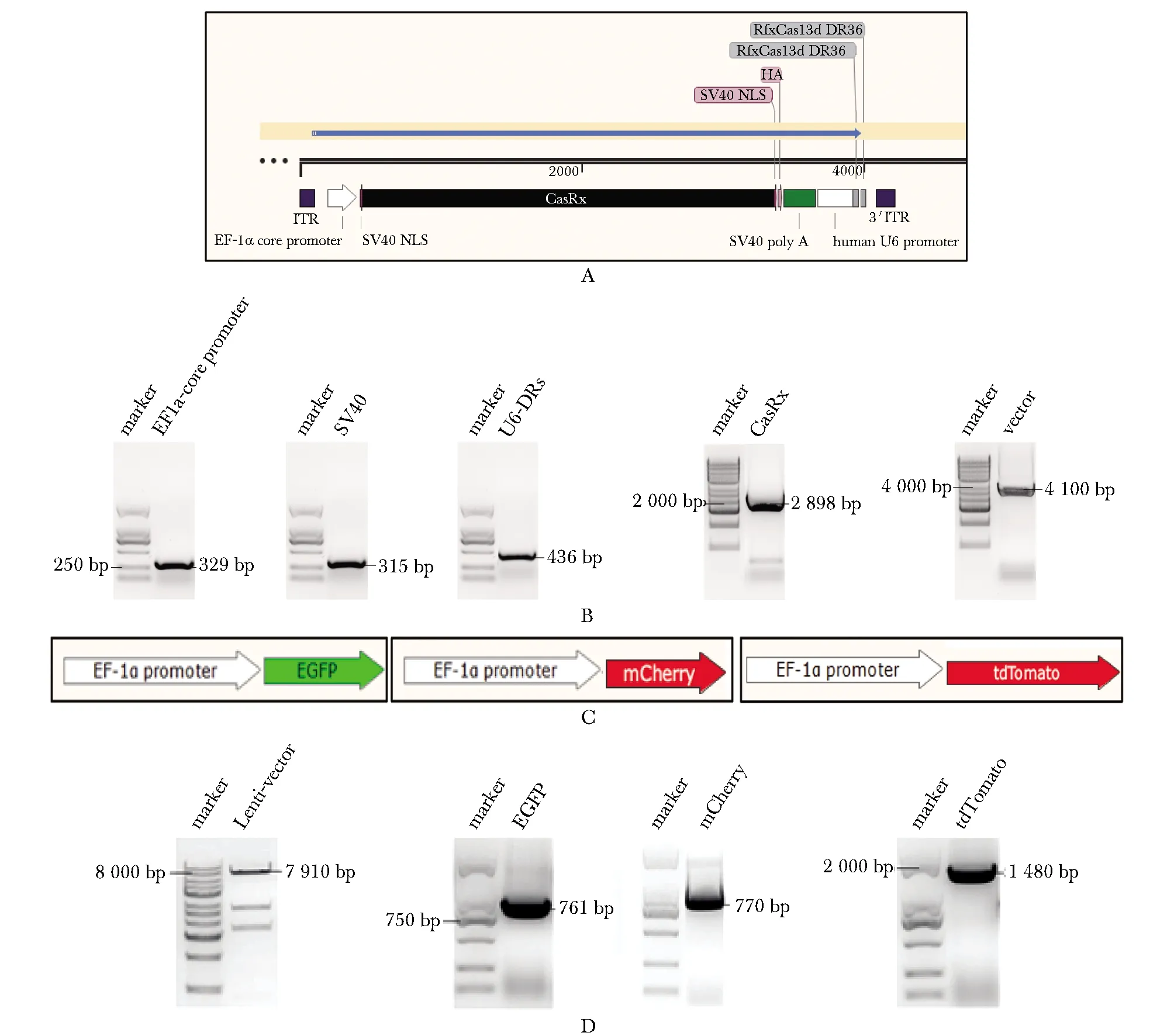
A.AAV-CasRx-gRNA plasmid map;B.PCR products of EF1a core promoter,SV40,U6-DRs,CasRx,AAV-vector;C.EGFP,mCherry,tdTomato fluorescent protein expression vectors;D.PCR products of EF1a promoter,EGFP,mCherry,tdTomato图1 CasRx-gRNA和EGFP、mCherry、tdTomato荧光蛋白表达载体的构建Fig 1 Construction of CasRx-gRNA and EGFP,mCherry,tdTomato fluorescent proteins expression vectors
2.2 HEK-293T细胞内验证CRISPR/CasRx系统的特异性和高效性
通过网站设计以及文献查阅获得EGFP和mCherry相应gRNA,将gRNAEGFP和gRNAmCherry序列插入EF1a core promoter.CasRx.SV40.U6.DRs质粒DR-DR之间,获得目的质粒(图2A)。在瞬时转染荧光蛋白表达质粒和CasRx+gRNA 48 h后,检测3种荧光的表达,其中EGFP和mCherry荧光为实验组,tdTomato为对照组,CasRx+gRNAEGFP、CasRx+gRNAmCherry组EGFP绿色荧光和mCherry红色荧光显著减弱,tdTomato荧光强度不变(图2B)。分别检测EGFP绿色荧光和mCherry红色荧光蛋白的表达水平显著降低(图2C)。
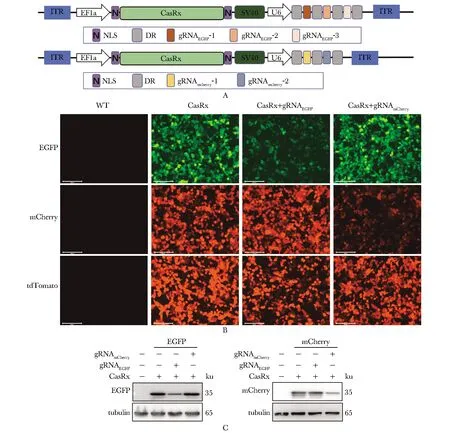
A.AAV-CasRx-gRNA plasmid design strategy;B.fluorescence expression after HEK-293T knockdown(×20);C.detection of the expression of EGFP and mCherry protein level by Western blot; WT.wild type图2 CRISPR/CasRx在HEK-293T细胞内靶向沉默外源基因的表达Fig 2 CRISPR/CasRx targetedly silenced the expression of exogenous genes in HEK-293T cells
2.3 CRISPR/CasRx系统在HEK-293T细胞系内有效敲降内源基因
选取一组EK-293T内源表达的蛋白质编码基因(mRNA)B4GALNT1、ANXA4,和一组长非编码RNA(lncRNA)MALAT1和H19,设计相对应的gRNA靶点(图3A),获得目的质粒。分别检测瞬时转染48 h后RNA水平,显示CasRx+gRNA能够有效敲降内源表达的mRNA和lncRNA(图3B)。

A.design for non-targeting(NT),B4GALNT1,ANXA4,MALAT1,H19 targeting;B.detection of the expression of B4GALNT1,ANXA4,MALAT1,H19 by q-PCR;*P<0.01 compared with NT guide图3 CRISPR/CasRx在HEK-293T细胞内靶向沉默内源基因的表达Fig 3 CRISPR/CasRx targetedly silenced the expression of endogenous genes in HEK-293T
2.4 CRISPR/CasRx系统在GC1-spg细胞内有效敲降外源基因
在瞬时转染荧光蛋白表达质粒和CasRx+gRNA于GC1细胞48 h后,检测显示绿色荧光和红色荧光强度都显著减弱(图4A)。流式细胞分选阳性细胞显示CasRx+gRNA组荧光的强度较高的细胞数量显著减少(图4B)。检测荧光蛋白的RNA和蛋白表达水平,显示CasRx+gRNA组能够有效敲降外源的两种不同的荧光蛋白(图4C,D)。

A,B.fluorescence intensity after knockdown EGFP and mCherry of GC1-spg(×20);C.detection for expression of EGFP and mCherry by q-PCR after egfp and mCherry knockdown of GC1-spg,*P<0.01 compared with CasRx group;D.detection for expression of EGFP and mCherry protein level by Western blot after egfp and mCherry knockdown of GC1-spg; WT.wild type图4 CRISPR/CasRx在GC1-spg细胞内靶向沉默外源基因的表达Fig 4 CRISPR/CasRx targeted the expression of exogenous genes in GC1-spg
3 讨论
CRISPR/CasRx系统最直接的应用是靶向沉默RNA。目前此系统被证实可以在哺乳动物细胞系中干扰RNA,从而实现基因沉默。本研究通过构建荧光表达质粒和针对目的egfp敲降的AAV-CasRx-gRNA质粒,从荧光表达差异直观的证明了CRISPR/CasRx发挥敲降功能的高效性, 在HEK-293T细胞系和小鼠精原细胞系GC1-spg通过对目的基因进行敲降,结果显示敲降效率均在50%以上,包括mRNA和lncRNA。据报道,小鼠睾丸组织存在大量特异表达的lncRNA,传统的RNA干扰技术靶向沉默lncRNA的效率不甚理想,特别是针对细胞核内的lncRNA,而CRISPR/CasRx系统介导的基因沉默不受此限制,可在体内体外水平高效沉默lncRNA。在CRISPR/CasRx设计gRNA方面,此系统不需要PAM(protospacer adjacent motif)序列,无核苷酸识别序列要求,在设计gRNA时操作简易。本研究连接了针对目的基因的3个gRNA,3个gRNA进行比对时均无脱靶,证明了现阶段在设计gRNA方面,https://cas13design.nygenome.org网站的实用性和高度可信性[10]。同时对于gRNA,已报道在circular RNA方面的筛选功能[11],表明此系统对于高通量筛选出功能性RNA的应用前景较好。另一方面,现阶段发现的Cas13d同源物中CasRx蛋白体积最小,仅930 aa(氨基酸),适用于包装入现阶段较安全的AAV病毒载体中,而且非常特异,在RNA水平上极少产生脱靶效应,让其在安全性以及潜在的疾病治疗上拥有了巨大的优势。CRISPR/CasRx结合AAV病毒运载系统已经在小鼠模型上被证明可用于基因治疗的多种疾病的发生发展。
体内水平注释基因功能是研究精子发生的理想模型。在研究某个基因在精子发生完整过程中的功能及机制时,较稳定的方式是制备基因敲除鼠,但敲除鼠只能展现该基因缺失的最终结果且存在潜在的致死效应[12],无法展现该基因被干扰的一个动态变化,而CRISPR/CasRx系统可以实现在小鼠体内进行RNA编辑进而检测其干扰后下游基因的表达情况。所以,结合CRISPR/CasRx系统的功能特征和雄性生殖发育研究现状,CRISPR/CasRx系统应用于雄性生殖发育研究具有较好前景。本研究中构建的AAV-CasRx-gRNA表达载体也是为应用于雄性生殖研究的小鼠模型上。同时CRISPR/CasRx系统在小鼠精原细胞的应用也为此系统应用于雄性生殖研究中奠定了基础。
