肺芽类器官中ID2的表达促进肺血管形成
2021-05-12刘洪宪
刘洪宪,杨 隽
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室,北京 100005;2.浙江大学 医学院 基础医学院 生理学系,浙江 杭州 310058)
肺部疾病相关的肺动脉高压(lung disease associated pulmonary hypertension)是一类肺动脉相关疾病,表现为肺实质与肺间质发生不可逆的病变,肺移植则是该类疾病晚期患者治疗的主要方案。但是由于供体缺少,大多数患者无法得到配型符合的健康肺[1-2]。人胚胎干细胞(human embryonic stem cells,hESCs)具有多能性,利用hESCs分化得到肺细胞一方面可以研究相关肺部疾病的发生机制;另一方面其有望成为可移植的种子细胞[3-4]。
研究表明,囊状期肺远端上皮细胞中存在一群DNA结合抑制因子-2(inhibitor of DNA binding-2, ID2)阳性的多能性细胞,这群细胞能够分化成肺泡和支气管[5-6]。同时,肺泡发生又能够促进肺微血管网的形成和进一步成熟[5]。而ID2在肺内的表达时间远早于囊状期,其在肺发育早期的作用机制尚未阐明。本研究通过将正常hESCs和构建的ID2敲除hESCs系分别向内皮细胞(endothelial cells, ECs)和肺芽类器官(lung bud organoids, LBOs)定向分化并共培养,旨在探讨肺芽发育早期尖端多能干细胞中ID2对肺血管分化的调控作用,为研究相关肺部疾病发病机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂:mTesR1培养基(Stemcell公司);0.25%胰蛋白酶、DMEM/F12、RMPI 1640、advanced DMEM/F12和EGM-2培养基、小鼠抗人CXCR4抗体、小鼠抗人CD31抗体、兔抗人VE-cadherin抗体(Thermo Fisher Scientific公司);小鼠抗人vWF抗体(BD公司);基质胶(Corning公司);CD31免疫磁珠(Miltenyi Biotec 公司);ID2抗体(Biocheck公司);兔抗人GAPDH抗体、兔抗人SOX17抗体、兔抗人PAX9抗体、HRP耦合的二抗(Abclonal公司)。
1.1.2 细胞来源:人胚胎干细胞(human embryonic stem cells,hESCs)(浙江大学陈伟实验室赠予);人肺动脉内皮细胞(human pulmonary artery endothelial cells,hPAECs)(北京泽平生物技术有限公司);大肠杆菌感受态细胞DH5α(翊圣生物科技有限公司)。
1.1.3 载体: episomal-CRISPR/Cas9载体(北京赛贝生物技术有限公司)。
1.2 方法
1.2.1 hESCs的培养:将hESCs培养于mTesR1培养基,置于37 ℃、5% CO2培养箱中培养。
1.2.2 ECs的分化及纯化培养:待hESCs增殖至约10%汇合度左右后开始ECs分化,见参考文献[7];分化第1天换上中胚层分化培养基(含有25 ng/mL activin A、30 ng/mL BMP4、1.5 mmol/L CHIR99021和50 ng/mL VEGF的BSA polyvinylalcohol essential lipids);第4天换为ECs分化培养基(含有10 mmol/L SB431542和 50 μg/mL VEGF的BSA polyvinyla-lcohol essential lipids),隔天换液,直至第10天。10 d 后使用CD31磁珠进行ECs分选,纯化的ECs在EGM-2培养基中传代培养。
1.2.3 LBOs的分化:待hESCs增殖至约90%汇合度以上进行LBOs分化,见参考文献[8];分化前3天使用内胚层分化培养基(含有100 ng/mL activin A 和1.5 mmol/L CHIR99021的RMPI 1640),每天换液;第4天开始换为前肠内胚层分化培养基(含有200 ng/mL Noggin、2 mmol/L CHIR99021、10 mmol/L SB431542和500 ng/mL FGF4的advanced DMEM/F12)。第8天将漂浮的细胞球转入肺芽类器官分化培养液(含有10 ng/mL FGF7、50 μg/mL ascorbic acid、3 mmol/L CHIR 99021和50 μmol/L retinoic acid的DMEM/F12)进行3D立体培养,每3~5 d换1次液,连续培养2周。
1.2.4 荧光定量PCR检测mRNA表达水平:分别收集ECs分化第0、1.5、3、7、10天和LBOs分化的第0、3、7、21天的细胞样品,使用Trizol法提取总RNA,测定浓度后将2 μg RNA反转录为cDNA。以GAPDH为内参基因,检测ID2、organic cation transporter4(OCT4)、brachyury(T)、kinase insert domain receptor(KDR)、platelet and endothelial cell adhesion molecule 1(CD31)、C-X-C motif chemokine receptor 4(CXCR4)、SRY-Box transcription factor 2(SOX2)、SOX9、NK2homeobox 1(NKX2.1)、cadherin 5(CD144)、von Willebrand factor(vWF)、SOX17和Paired Box 9(PAX9)的mRNA表达水平。
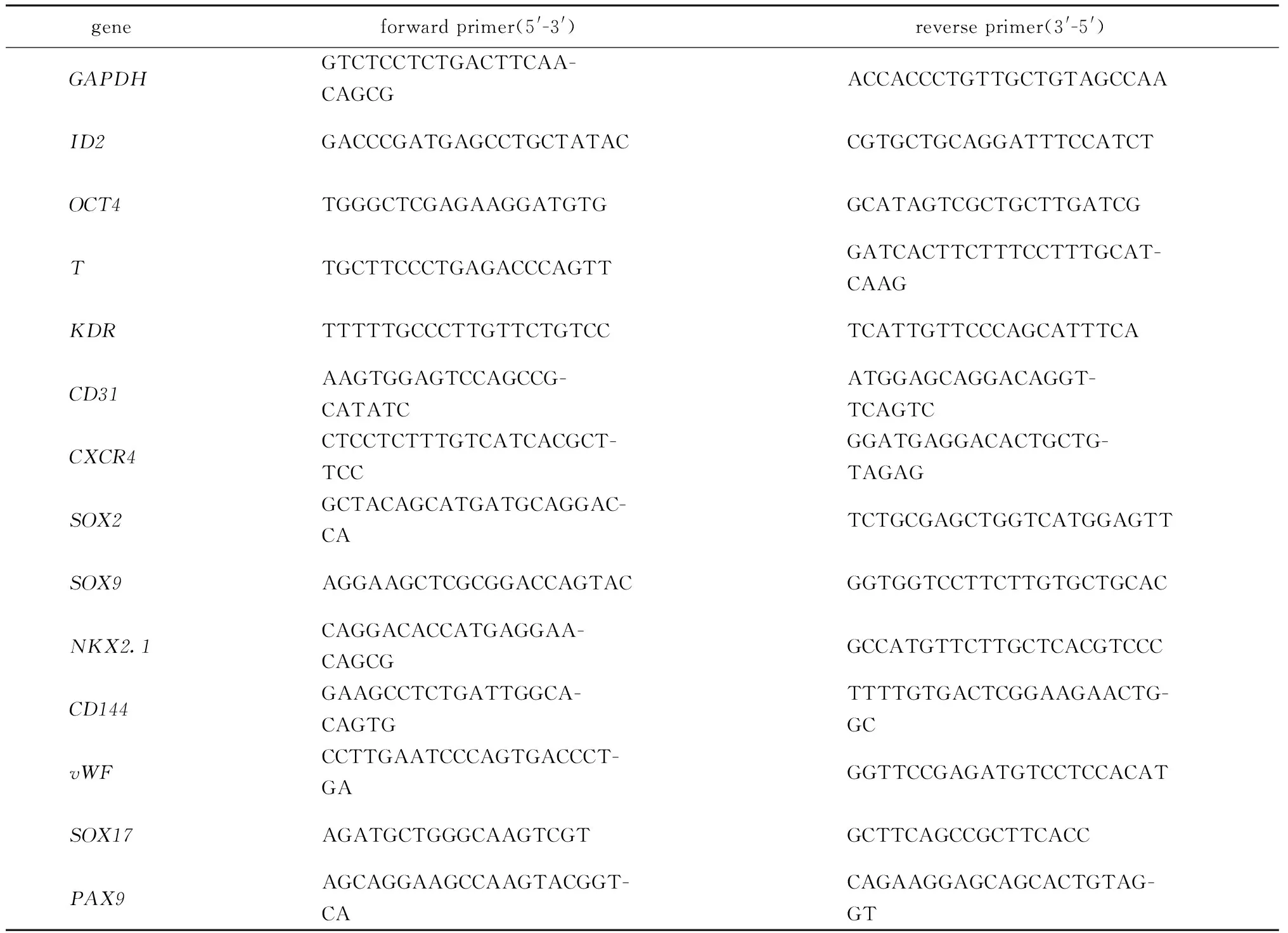
表1 荧光定量PCR引物序列Table 1 Sequences of primers for quantitative PCR
1.2.5ID2敲除株C6的建立:利用epiCRISPR载体和ID2特异gRNA(5′-GGCATCTCCCGGAGCAAA A-3′)构建敲除载体,将敲除质粒转染到hESCs中,puromycin筛选挑取单克隆培养。
1.2.6 蛋白质免疫印迹检测蛋白表达水平:分别收集ECs分化第0、1.5、10天和LBOs分化的第0、3、7天的细胞样品,使用RIPA裂解细胞收集总蛋白,将样品进行电泳、转膜、封闭、相应蛋白一抗孵育、二抗孵育和显影拍照,检测ID2、EOMES、CD31、CD144、SOX17和PAX9的蛋白表达水平。
1.2.7 流式细胞测量术检测CXCR4和CD31的阳性率:分别收集ECs分化第10天和LBOs分化第3天细胞,流式细胞测量术检测ECs表面分子CD31和内胚层细胞表面分子CXCR4阳性的细胞比例。
1.2.8 ECs和hPAEC成管实验检测成管能力:用胰蛋白酶消化细胞,在预先用基质胶包被的96孔板中种植细胞,每孔15 000个细胞。37 ℃、5% CO2培养箱放置培养,4 h后拍照观察并使用ImageJ进行统计分析。
1.2.9 LBOs和hPAECs的3D共培养检测LBOs对hPAECs成管功能的影响:将LBOs与hPAECs(每孔60 000个细胞)混合后,在细胞混合液中加入100 μL基质胶,随后将细胞混合液接种于预冷的96孔板中;待其凝固后添加EGM-2培养基,37 ℃、5% CO2培养箱放置培养,24 h后拍照观察。
1.3 统计学分析
2 结果
2.1 从hESCs分化得到ECs与LBOs及相关鉴定
ECs分化第1.5天细胞完全铺散开,直至第7天开始出现典型的铺路石状的ECs(图1A)。分化过程中,中胚层基因T在第1.5天高表达,ECs标志基因CD31和KDR在第7天表达最高,ID2的表达水平在ECs分化过程中逐渐升高,在第7天达到最高(图1B)。
hESCs分化第21天得到LBOs(图1C)。分化过程中,内胚层基因CXCR4在第3天达到峰值,前肠内胚层基因SOX2在第7天达到峰值,成熟的LBOs高表达SOX9和NKX2.1,ID2在LBOs分化过程中逐渐升高(图1D)。
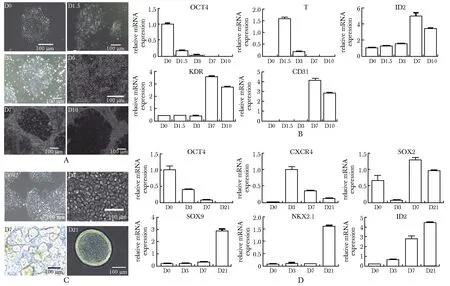
A.images of hESCs differentiated into ECs on different days (scale bar =100μm); B.mRNA expression of marker genes during ECs differentiation; C.images of hESCs differentiated into LBOs on different days (scale bar=100 μm); D.mRNA expression in marker genes during LBOs differentiation图1 从hESCs分化得到ECs与LBOs及相关鉴定Fig 1 Differentiation and identification of ECs and LBOs from n=3)
2.2 敲除ID2能够延缓hESCs进入中胚层而促进终末ECs分化
ECs分化第1.5天C6细胞未正常散开呈克隆样(图2A)。与正常hESCs(H9)相比,C6中中胚层基因T、KDR的mRNA表达和EOMES蛋白表达相对较低(图2B,C)。与正常hESCs(H9)相比,ECs分化第10天C6的分化所得CD31+细胞数量显著增多,约为31%(图2D)。ECs中的基因CD31、CD144和vWFmRNA和蛋白表达水平均在C6中表达较高(图2E,F)。

A.images of different cell strains differentiated into ECs on day1.5 (D1.5,scale bar=100 μm); B.relative mRNA expression of mesoderm gene in A; C.protein expression of mesoderm gene EOMES and ID2 in A; D.CD31 expression level of different cell strains on ECs differentiation D10; E.relative mRNA expression of ECs gene on ECs differentiation D10 in different cell strains; F.protein expression of ECs genes on ECs differentiation D10 in different cell strains; *P<0.05, **P<0.01, ***P<0.001 compared with H9.H9,normal hESCs;C6, ID2 knockout strain图2 敲除ID2能够延缓hESCs进入中胚层而促进终末ECs分化Fig 2 ID2 knockout delayed hESCs entry into the mesoderm, but promoted differentiation into n=3)
2.3 敲除ID2减弱ECs成管功能
2种细胞株来源的ECs呈现典型的铺路石形状(图3A)。尽管它们均能形成管状结构,但敲除ID2的C6细胞株分化得到的ECs成管的各项参数均显著低于对照组(H9)(图3B,C)。
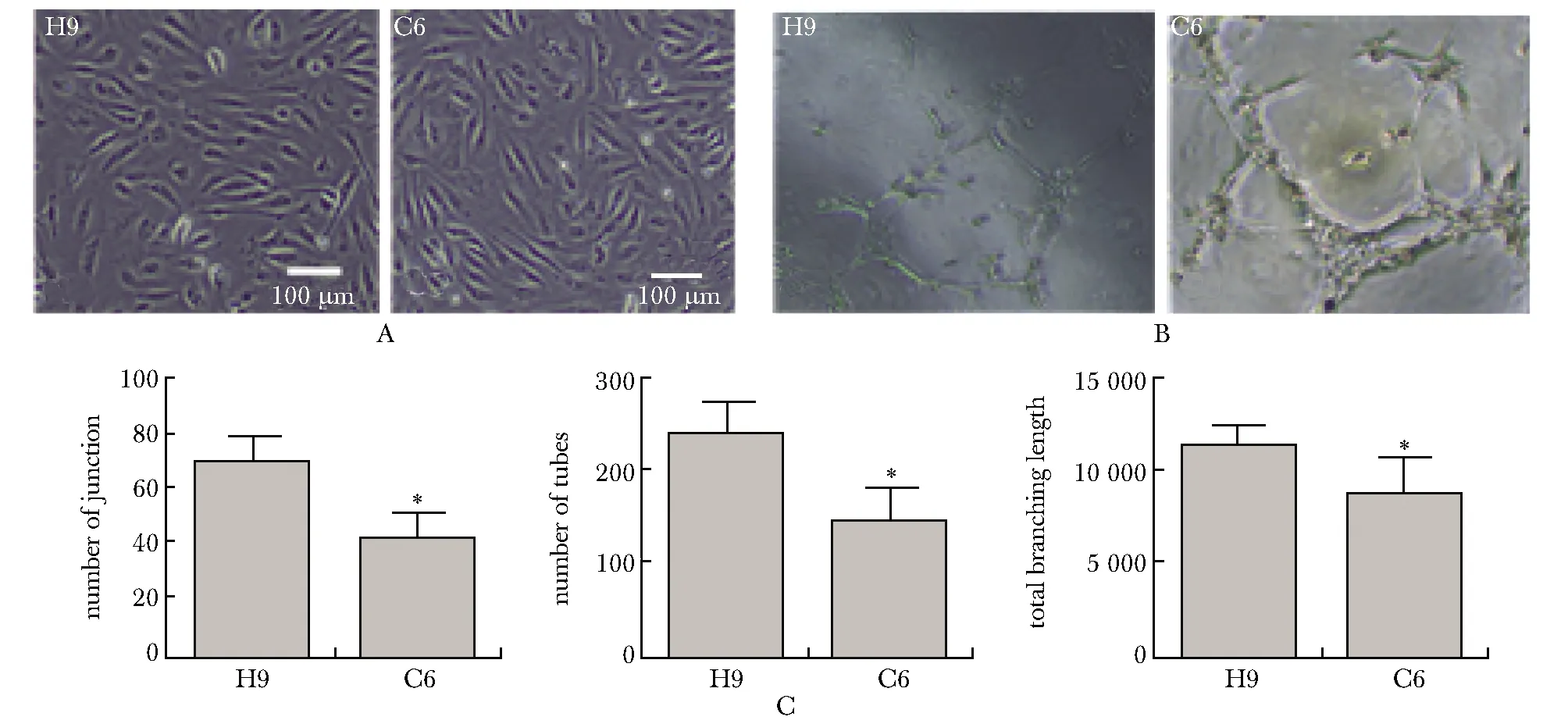
A.images of ECs obtained from different cell strains (scale bar=100 μm); B.comparison of tube-forming ability of ECs obtained from different cell strains (×4); C.quantification of Fig 2B; *P<0.05 compared with H9 group图3 不同细胞株来源的内皮细胞成管功能比较Fig 3 Comparison of ECs tubes-forming ability of different cell n=3)
2.4 敲除ID2抑制LBOs的生成
LBOs分化第3天,与对照组H9相比,ID2敲除后分化效率降低(CXCR4+约60%)(图4A);内胚层基因CXCR4和SOX17的mRNA和蛋白表达水平均降低(图4B,C)。在LBOs分化第7天,与H9组相比C6生成的悬浮球明显减少(图4D),C6的前肠内胚层基因PAX9的mRNA和蛋白表达水平降低(图4E,F)。
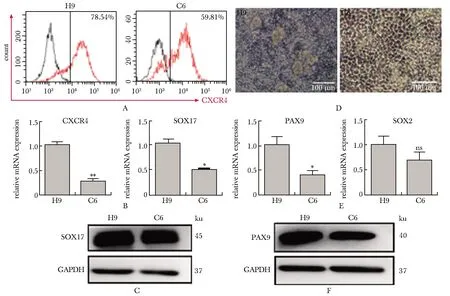
A.CXCR4 expression level of different cell strains during LBOs differentiation D3; B.relative mRNA expression of CXCR4 and SOX17 on LBOs differentiation D3 in different cell strains; C.protein expression of SOX17 on LBOs differentiation D3 in different cell strains; D.images of different cell strains differentiated into LBOs in D7 (scale bar=100 μm); E.relative mRNA expression of PAX9 and SOX2 on LBOs differentiation D7 in different cell strains; F.protein expression of PAX9 on LBOs differentiation D7 in different cell strains; *P<0.05, **P<0.001 compared with H9 group图4 敲除ID2抑制LBOs的生成Fig 4 ID2 knockout inhibited the formation of n=3)
2.5 ID2正向调控LBOs诱导ECs成管功能
LBOs培养上清能够促进hPAEC成管,与H9组相比C6的促进作用相对减弱(图5A,B)。正常的LBOs能够促进ECs成管,出现LBOs与ECs相互接触的结构;而C6来源的LBOs促成管作用降低(图5C,D)。
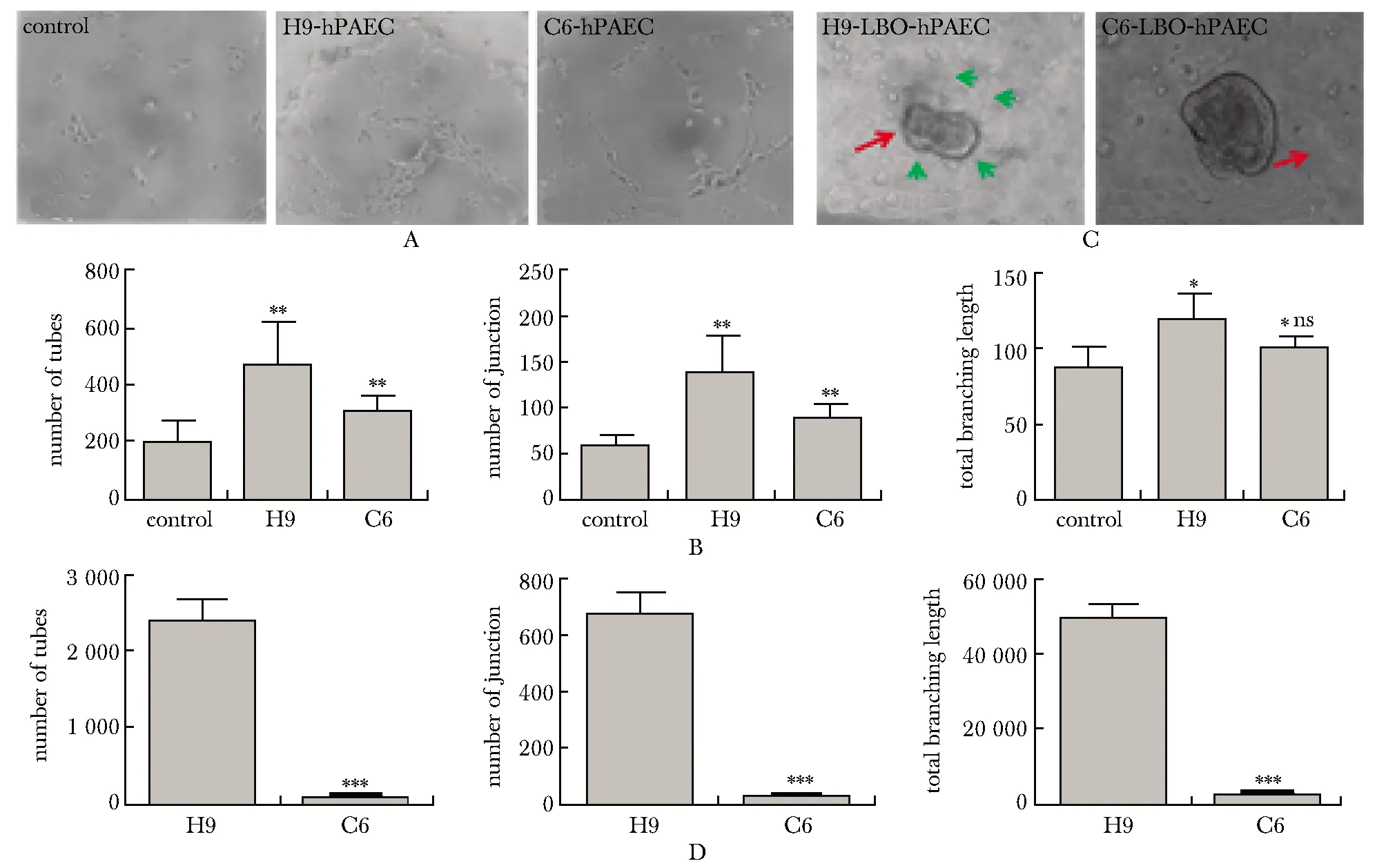
A.comparison of tube-forming ability of hPAECs cultured in different LBOs culture medium (×4); B.quantification of Fig 5A; *P<0.05, **P<0.01 compared with control group; #P<0.05 compared with H9 group; C.comparison of morphological differences and tube-forming ability by LBOs derived from different cell strains and hPAECs 3D co-culture (×10); the red arrow was the LBOs, the green arrow was the tubular structure formed by ECs; D.quantification of Fig 5C; ***P<0.01 compared with H9 group图5 ID2正向调控LBOs诱导ECs成管功能Fig 5 ID2 positively regulated the LBOs induction of ECs tube n=3)
3 讨论
本研究显示ID2参与肺的早期发育,主要表现在促进LBOs和ECs的早期分化及参与LBOs对肺血管形成的调控作用。ID2敲除后一方面不利于hESCs分化进入中胚层阶段, 形成大量成管能力缺陷的ECs;另一方面导致LBOs的形成减少和功能降低。
hESCs向ECs定向分化主要形成两种不同的中胚层来源的细胞,ECs和周细胞。尽管ID2能够促进hESCs更早进入中胚层,但却更有利于向周细胞分化。因此ID2敲除形成大量的功能缺陷的ECs,这种现象可能会引起肺动脉高压等血管疾病。
研究进一步显示,ID2能够正向调控LBOs诱导ECs成管功能。LBOs的这种诱导作用可能是以通过分泌VEGF等信号分子的旁分泌方式来实现的,ID2的敲除可能阻断了这一信号分子的表达和分泌。作为BMP信号通路(bone morphogenetic protein signaling pathway)的下游基因,ID2相关信号传导通路的问题需要进一步探索。
综上所述,本研究探讨了ID2在肺早期发育中的调控作用,为进一步研究相关肺血管疾病提供了理论依据。
