不同植被类型对黔中山地丘陵区土壤细菌群落特征的影响研究
2021-05-12杨云礼
杨云礼,徐 明,邹 晓,陈 进,张 姣,张 健
(贵州大学生命科学学院真菌资源研究所,贵州 贵阳 550025)
土壤微生物作为陆地生态系统的重要组分,与植物及土壤养分形成植物—土壤微生物—土壤养分模式驱动生态系统能量流动与物质循环[1],维持生态系统结构和功能稳定性。细菌是土壤微生物中含量最多、丰富度最高、分布最广的类群[2-3],在促进植物生长、影响群落演替等方面发挥着重要作用,如假单胞菌 (Pseudomonas)、芽孢杆菌(Bacillus)和农杆菌(Agrobacterium)可产生植物激素或分子信号、竞争生长位点、载体蛋白等促生长机制促进植物生长,增强对病原菌的抗性[4-5]。由于土壤细菌生命活动所需碳源主要依赖于地上植被的凋落物及根系分泌物[6-7],因此植被可直接影响土壤微生物活性和多样性特征[8],与土壤细菌群落形成相互作用的反馈体系[9]。大量研究表明,植被类型是影响土壤微生物群落代谢活性、碳源利用率、微生物生物量的驱动因子,随着群落演替的进程土壤微生物种群数量逐渐增加,碳源利用率也不断增加[10];与荒地对比,不同植被类型土壤微生物代谢速率可增加6.45%~93.33%[11]。同时,土壤细菌群落作为土地利用变化的敏感性指标,地上植被的变化必然影响土壤细菌群落结构及其多样性分布格局[12]。
贵州省森林资源丰富,植被类型多样[13]。但由于贵州高原地处我国西南云贵高原东部,受季风影响显著,旱涝灾害频发,森林植被常受到不同程度的干扰[14]。同时,随着农业生产及自然资源开发的大力推进,植被类型转变显著。地上植被类型改变对土壤养分以及细菌群落产生深刻影响[15]。研究表明,黔中地区植被类型的改变对气候、生态环境及社会经济等方面具有显著影响。在不同植被类型下植被对空气颗粒物具有不同程度的消减作用[16];马尾松林可降低光照强度、光通量密度、气温等小气候特征指标[17];此外,在我国南方的经济欠发达地区,大量不科学不合理的农耕活动导致森林资源严重破坏,进一步影响社会经济发展[18]。在地下土壤微环境中,不同植被演替阶段土壤真核微生物群落结构也存在差异[19-20],而植被对土壤细菌群落结构及多样性特征等方面的影响尚不清楚。
贵州省是我国典型喀斯特山地高原区,广泛分布的石灰岩及熔岩土壤影响植被发育,使得植被分布错综复杂,通常呈垂直地带性分布,主要包括常绿阔叶林、针叶林、针阔混交林及灌草丛等。该研究选取黔中山地丘陵区森林群落演替中3种典型植被类型为研究对象,通过高通量测序平台分析不同植被类型土壤细菌群落结构和多样性特征,探究土壤细菌群落对森林演替过程的影响,同时探索影响土壤细菌群落多样性的环境因子,以期进一步阐明不同植被类型土壤细菌的分布特征,为黔中地区森林的提质增效、科学管理提供科学依据。
1 材料与方法
1.1 研究区概况
研究区位于贵州省黔南布依族苗族自治州长顺县广顺农场,地势呈北高南低,属黔中腹地典型山地丘陵地貌区,地理坐标为25°38′~26°17′ N,106°12′~106°38′ E,属中亚热带季风湿润气候区,雨热同期,年平均气温为13.5~18.5 ℃,年平均降水量为670 mm,相对湿度为81%,年无霜期200 d以上,土壤类型以黄壤为主。
1.2 样地设置及样品采集
通过野外实地踏查及调研,选取处于早期草本与灌木的过度阶段的灌草丛、演替中期阶段的马尾松针叶林及演替顶级阶段的阔叶林3种植被类型样地(表1)。设置20 m×20 m调查样方,记录调查样方内的植物群落的物种名、株数、高度和盖度及海拔、坡度、坡向、坡位等信息。利用土钻按6点取样法随机采集0~20 cm土层的混合土壤样品,去除石块和植物根系等杂物后,充分混合均匀后过2 mm孔径土筛,重新分成2份,一份装入无菌密封袋中,保存于-80 ℃冰箱,用于高通量测序;另一份通风处阴干后,分别过1和0.25 mm孔径筛,常温环境保存,用于土壤化学性质测定。
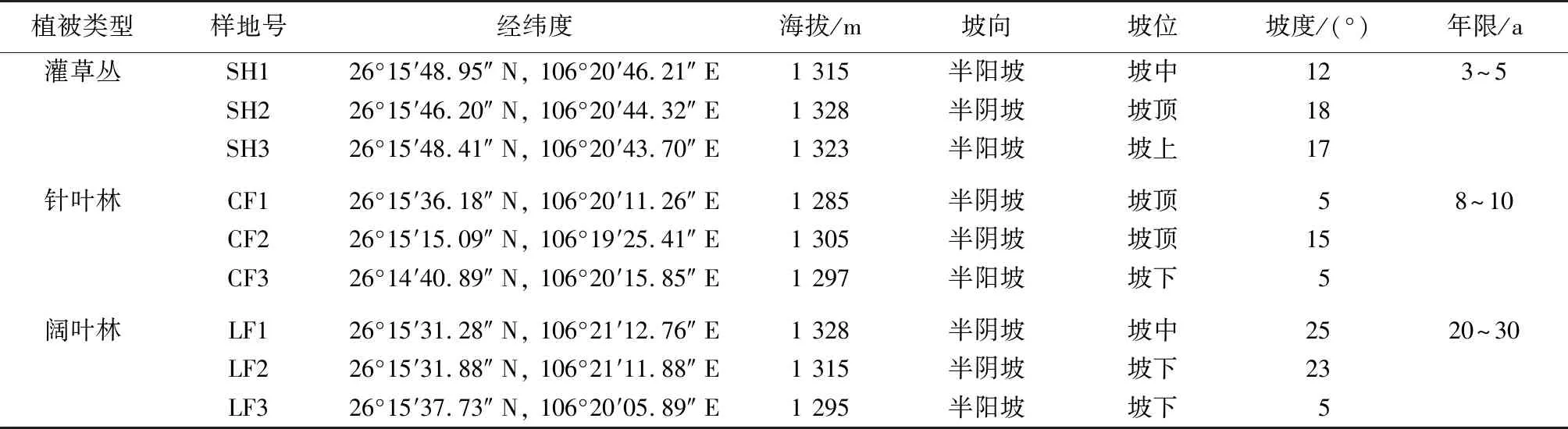
表1 不同植被类型样地基本信息Table 1 Basic information of different vegetation types
1.3 土壤细菌总DNA提取及PCR扩增
土壤细菌测序过程主要由总DNA提取、16S rDNA基因的PCR扩增、纯化、文库构建和上机测序组成。土壤总DNA提取采用omega M5635-02 DNA抽剂盒,从0.5 g土壤样本中提取得到总DNA,用核酸纯化仪进行纯化并检测其浓度;采用PCR通用引物338F(5′-A ̄C ̄T ̄C ̄C ̄T ̄A ̄C ̄G ̄G ̄G ̄A ̄G ̄G ̄C ̄A ̄G ̄C ̄A ̄C-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rDNA V3-V4区进行扩增。PCR反应体系为:5×FastPfu buffer 4.0 μL,dNTPs (2.5 mmol·L-1)2.0 μL,正、反向引物(5 μmol·L-1)各0.8 μL,FastPfu polymerase (2.5 U·μL-1) 0.4 μL,BSA 0.2 μL,模板DNA 10 ng,补充ddH2O至20 μL。PCR 反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,25个循环;72 ℃ 10 min;10 ℃ 保存。随后进行MiSeq文库构建及Illumina上机测序。测序由武汉菲沙基因信息有限公司完成。
1.4 土壤理化指标的测定
依据LY/T 1228—2015《中华人民共和国林业行业标准》,土壤容重(BD)采用环刀法测定,土壤有机质(SOM)含量测定采用重铬酸钾氧化-分光光度法;土壤全氮(TN)含量测定采用半微量凯氏定氮法;土壤全磷(TP)含量测定采用钼锑抗比色法;土壤有效磷(AP)含量测定采用双酸浸提-钼锑抗比色法;土壤pH值采用浸提电位法(土水质量比1∶2.5)测定。
1.5 数据分析及方法描述
基于QIIME分析平台对于测序原始数据进行拼接、过滤,以97%的一致性(identity)进行OTUs(operational taxonomic units)聚类,使用RDP数据库对OTUs的有效序列(clean reads)进行物种注释。利用Mothur软件计算样品的α多样性指数,通过UniFrac算法利用系统进化的信息来比较样品间的物种群落差异,进行β多样性分析。采用Excel 2019及SPSS 22.0软件进行土壤理化性质及细菌群落多样性分析,采用Duncan法进行差异显著性检验。利用美吉生物云平台进行土壤细菌群落主坐标分析(principal coordinate analysis,PCoA)及细菌群落与土壤环境因子的冗余分析(redundancy analysis,RDA)。
2 结果与分析
2.1 土壤理化性质
对不同植被类型土壤理化性质(图1)进行分析,结果表明3种植被类型土壤容重,pH值,有机质、全磷、有效磷、全氮含量均存在差异。其中,土壤容重介于1.01~1.60 g·cm-3之间,阔叶林较灌草丛及针叶林更低,但无显著差异(P>0.05)。3种植被类型土壤pH值差异显著(P<0.05),其中针叶林最低,属强酸性土壤,其次是灌草丛,属极强酸性土壤,阔叶林属酸性土壤。说明不同的植被根系向土壤分泌的有机物化合物含量不同,从而影响土壤的酸碱度。阔叶林全氮含量最高,为0.61 mg·kg-1,显著高于灌草丛和针叶林(P<0.05)。不同植被类型土壤有机质含量变化范围为14.73~18.25 g·kg-1,灌草丛最高,针叶林次之,阔叶林最低;针叶林土壤全磷和有效磷含量均低于灌草丛及阔叶林。但不同植被类型之间土壤有机质及全磷含量差异均不显著(P>0.05)。
2.2 土壤细菌群落的α多样性
由表2可知,文库平均覆盖度均在0.98以上,表明该试验测序深度能较全面地反映测序样品中的微生物信息。经数据优化后,此次测序共得到土壤细菌群落42门125纲297目509科1 021属2 092 种,包含13 971个OTUs。不同植被类型土壤细菌群落α多样性指数如表2所示。土壤细菌群落的Shannon指数和Simpson指数分别为5.380~6.185和0.013~0.051。假定研究中灌草丛—针叶林—阔叶林代表着该地区植被正向演替序列[19],可见随着演替的进行土壤细菌群落多样性不断发生变化,但不显著(P>0.05)。ACE指数和Chao指数分别为2 020.116~2 811.629和2 065.801~2 869.422,不同植被类型下土壤细菌丰富度差异未达显著水平(P>0.05)。
在OTU水平上绘制韦恩图,结果如图2所示。
灌草丛、针叶林、阔叶林共有1 768个OTUs(31.70%),特有OTUs分别有739、490和857个,占比分别为13.25%、8.78%和15.36%。共有OTUs所表示的这些细菌类群的作用在植被恢复过程中贯穿始终,是该区域自然植被土壤的重要细菌类群,而特有OTUs可能与特定植被类型生境下的植被组成和物质转化过程紧密相关[20]。
2.3 土壤细菌群落组成分析
不同植被类型土壤细菌在门、属水平上的相对丰度如图3所示。在门水平上,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)、厚壁菌门(Firmicutes)、黏菌门(Myxococcota)、绿弯菌门(Chloroflexi)、疣微菌门(Verrucomicrobiota)、蓝细菌门(Cyanobacteria)、芽单胞菌门(Gemmatimonadota)为土壤中的主要群落。其中变形菌门相对丰度占比最高(31.79%~52.96%),其次为酸杆菌门(10.95%~23.85%)和放线菌门(70%~17.68%),是土壤细菌群落中的优势菌群。整体上,变形菌门随植被演替进程呈现出丰度增加趋势,而酸杆菌门反之。组间差异检验结果(图5)显示,绿弯菌门及芽单胞菌门的相对丰度在3种植被土壤中差异显著(P<0.05)。
属水平上统计结果表明,不同植被类型土壤细菌群落以鞘脂杆菌属(Sphingomonas)、链霉菌科(Streptomycetaceae)未定义属、黄色杆菌科(Xanthobacteraceae)未定义属、大豆根瘤菌属(Bradyrhizobium)、酸杆菌目(Acidobacteriales)未定义属、苔藓杆菌属(Bryobacter)、Elsterales未定义属、Chloroplast未定义属为主。其中灌木丛、针叶林及阔叶林土壤鞘脂杆菌属的相对丰度分别为1.99%、10.97%及22.27%。总体上,不同植被类型土壤中细菌群落相对丰度存在明显差异,鞘脂杆菌属丰度随着演替的进程呈现逐渐增加的趋势。群落间物种组成同样具有显著差异(图4),绿湾菌门及芽单胞菌门在不同植被类型土壤细菌群落中的比例具有显著差异。酸杆菌目未定义属及Elsterales未定义属在3种植被土壤中具有显著差异(P<0.05)。
2.4 土壤细菌群落的相似性分析
采用主坐标分析法对不同植被类型土壤细菌群落组成进行排序(图5)。结果显示,轴1的贡献率为30.59%,轴2的贡献率为24.98%,累计贡献率为55.57%。3种植被类型样点间存在明显分离。ANOSIM相似性分析结果显示,3种植被类型土壤细菌群落组成存在显著差异(P=0.016)。不同植被类型土壤细菌群落组间具有明显的分离效应。
2.5 土壤细菌群落的影响因子分析
土壤是细菌群落生长及繁殖的微环境,微环境的改变能在很大程度上影响细菌群落结构及多样性。为了分析环境因子对细菌群落结构的潜在影响,选取土壤环境因子如容重(BD)、pH值、有机质、全氮、全磷、有效磷及多样性指数,与细菌属水平下的优势群落进行冗余分析(图6)。
图6显示,第1序轴和第2序轴的解释变量分别为64.66%和13.66%,累积解释变量达78.32%,表明前2个轴的贡献值能很好地解释各因子对细菌群落的影响。灌草丛土壤细菌群落结构与土壤容重,有机质、全磷、有效磷含量呈正相关,与土壤pH值、全氮含量呈负相关。针叶林土壤细菌群落结构与土壤容重呈正相关,与土壤pH值,有机质、全氮、全磷、有效磷含量呈负相关。阔叶林土壤细菌群落结构与土壤容重呈负相关,与土壤pH值,有机质、全氮、全磷、有效磷含量呈正相关。环境因子中土壤有效磷(R2=0.582 5,P=0.003)、全磷(R2=0.971 0,P=0.001)含量对土壤细菌群落结构有极显著影响,土壤容重(R2=0.727 3,P=0.027)对不同植被类型的土壤细菌群落结构有显著影响;且经Mantel Test检验达显著水平(R2=0.857 0,P=0.002)。说明土壤全磷、有效磷含量及容重是影响不同植被类型土壤细菌群落结构的主要环境因子。
3 讨论
3.1 不同植被类型对土壤细菌群落组成结构的影响
笔者研究发现,黔中地区3种植被类型土壤理化性质、细菌群落多样性、群落组成及结构均存在差异,这可能是由于不同植被类型下植物物种组成、凋落物分解速率及根系分泌物存在差异所致[21-22]。不同植被类型土壤细菌群落多样性具有显著差异,其中灌草丛显著高于针叶林和阔叶林,这可能是由于灌草阶段尚处于植被演替的过渡阶段,该生境下土壤酶活性高、土壤物质转化快以及微生物量周转率高,有利于维持较高的土壤微生物多样性[23]。该区土壤细菌优势菌群为变形杆菌门、酸杆菌门、放线菌门,与前人研究结果一致[24]。研究发现这3种细菌类群在分解有机质,促进土壤碳、氮和硫循环中起着重要作用[25],这决定了其在土壤微生物群落中的优势地位。整体上,变形菌门随植被演替进程呈现出丰度增加趋势,酸杆菌门也逐渐增加。张晓等[26]研究发现,在辽东栎林自然恢复过程中,随演替阶段进行,变形菌门和绿弯菌门的相对丰度逐渐增加,而放线菌门和酸杆菌门的相对丰度逐渐降低,笔者研究结果与其相似。已有研究认为,这种变化趋势还可能会导致其调控的生态学功能发生改变[27]。PCoA分析结果表明,灌木丛、针叶林、阔叶林土壤细菌群落结构具有显著差异(P<0.05),进一步说明植被类型在一定程度上可影响土壤微生物群落结构和功能多样性。
3.2 土壤细菌群落的影响因子分析
植被通过影响土壤理化性质间接影响微生物的组成和结构。探讨不同植被类型下环境因子如何影响土壤微生物群落的结构组成和分布格局,是探究土壤细菌群落多样性变化机制的关键[28]。研究结果表明,随着植被类型的改变,不同土壤理化指标间差异明显,土壤理化性质是影响土壤微生物群落组成结构的重要环境因子。冗余分析结果表明,土壤容重,pH值,有机质、全氮、全磷、有效磷含量均对黔中地区土壤微生物群落有影响,其中土壤全磷、有效磷含量及容重是不同植被类型土壤细菌群落结构的主要影响因子,这些因子对驱动细菌群落组成和结构变化起着重要的作用。研究表明,磷是植物生长必需的营养元素,能参与物质、能量合成及细胞分裂,在植物生长发育过程中发挥着重要作用[29],不同植被类型下土壤磷的转化速率与迁移程度具有明显差异,由此土壤磷含量常成为土壤微生物生态系统结构与功能多样性的决定性条件[30]。研究区地处典型喀斯特区,地势复杂、水热条件差、物质循环速率慢是该区域的特点,由此磷元素含量成为限制土壤微生物的主要因素之一。蔡进军等[31]研究表明,土壤速效磷、速效氮、全氮、有机质含量对黄土丘陵区土壤微生物功能多样性有显著影响。丁新景等[32]在研究人工林根际土壤微生物时,同样发现土壤有效磷、速效钾、碱解氮含量及电导率是细菌结构和多样性的主要影响因素,笔者研究也得到类似结果。刘红岩[33]研究发现,植被群落多样性与土壤容重呈负相关。笔者研究中阔叶林土壤容重低于灌草丛及针叶林,其原因可能是阔叶林土壤表层积累了更多的凋落物,使土壤容重降低,可见表层土壤容重作为土壤生境的重要物理指标,能对土壤细菌群落的多样性产生重要影响。
4 结论
黔中山地丘陵区不同植被类型间土壤养分含量存在显著差异(P<0.05);不同植被类型土壤细菌群落组成结构差异明显(P<0.05),土壤全磷、有效磷含量及容重是影响土壤细菌群落的重要环境因子;黔中山地丘陵区不同植被类型对土壤微生物群落结构和多样性分异作用显著。
