假单胞菌代谢产物藤黄绿菌素化学结构、生物合成途径、调控机制及应用研究进展
2021-05-11何亚文
崔 莹,宋 凯,何亚文
(上海交通大学生命科学技术学院/微生物代谢国家重点实验室/教育部代谢与发育科学国际合作联合实验室,上海200240)
假单胞菌Pseudomonas广泛分布于土壤、水、动植物体等生物和环境生态位,主要包括荧光假单胞菌P. fluorescens、铜绿假单胞菌P. aeruginosa、防御假单胞菌P. protegens、绿针假单胞菌P. chlororaphis、恶臭假单胞菌P. putida、丁香假单胞菌 P. syringae、施氏假单胞菌P. stutzeri和门多萨假单胞菌P. mendocina等[1,2]。按照功能分,假单胞菌又可分为植物促生和生物防治菌、植物病原菌、人类条件致病菌、生物修复菌[3]。许多植物根际促生假单胞菌通过分泌一种或几种代谢产物来抑制植物根际病原菌的繁殖,达到促进植物生长的效果,这些代谢产物包括2,4-二乙酰藤黄酚(2,4-diacetylphloroglucinol,DAPG)、吩嗪-1-羧酸(phenazine-1-carboxylic acid,PCA)、藤黄绿菌素(pyoluteorin,Plt)、硝吡咯菌素(pyrrolnitrin,Prn)和氰化物等[4,5]。
Plt是一种芳香族聚酮类假单胞菌代谢产物,其生物合成途径及调控网络已有多篇文献报道。本文系统综述了 Plt的化学结构和产生菌、合成基因簇、生物合成途径以及近年来调控机制方面的研究进展,为进一步推动Plt相关的基础与应用研究提供参考。
1 Plt的化学结构和产生菌
Plt最早由Takeda等[6]从铜绿假单胞菌T359和IFO3455产生的代谢产物中分离和鉴定,化学名称为2,3-二氯-5-(2′,6′-二羟基苯甲酰基)吡咯,分子式为 C11H7O3NCl2。Plt常温下为黄色晶体,溶于乙酸乙酯、甲醇、环季胺等有机溶剂,微溶于水,紫外最高吸收峰在310 nm左右[7]。芳香环作为吸电子基团对于Plt的抗菌活性是必须的;吡咯基团上的氯被溴或碘取代会显著降低对金黄色葡萄球菌Staphylococcus aureus和大肠杆菌Escherichia coli的抑菌活性,但被硝基取代可以增加Plt的抑菌活性[8]。目前已报道的Plt产生菌大都从植物根际分离得到,多数为防御假单胞菌和铜绿假单胞菌,少数恶臭假单胞菌也产生Plt(表1)。最近,Lacerna等[9]从一株海洋铜绿假单胞菌中分离到了3个新的Plt结构类似物mindapyrroles A-C。
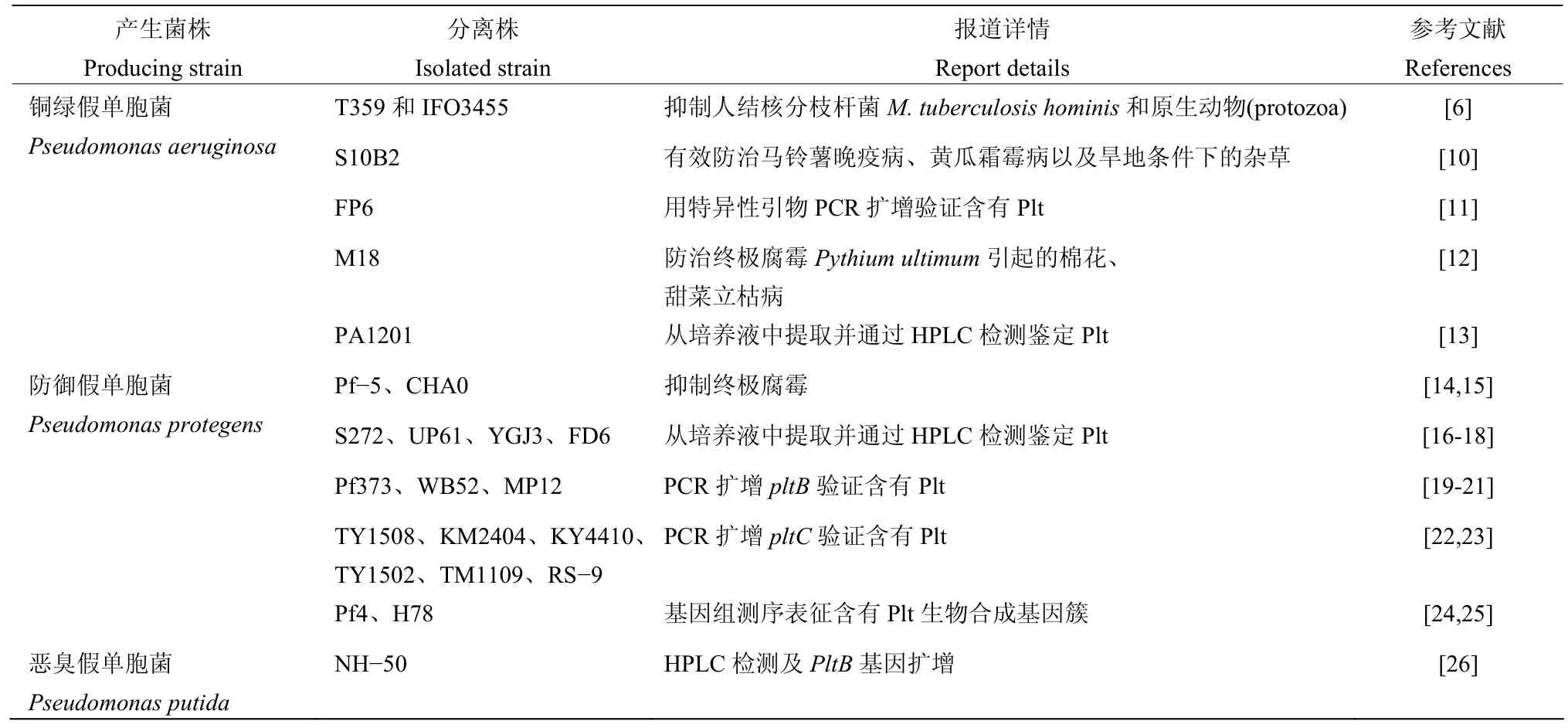
表1 已报道的藤黄绿菌素产生菌株Table 1 Reported pyoluteorin producing strains
2 Plt生物合成途径
Plt生物合成基因簇包括:Plt合成基因操纵子pltLABCDEFG、Plt转运操纵子pltIJKNOP、调控基因pltR、pltZ和pltM[28]。Plt由间苯二酚环和二氯吡咯基团组成,它们分别通过聚酮化合物生物合成途径(PKS)和非核糖体多肽生物合成途径(NRPS)合成[29]。脯氨酸是Plt二氯吡咯部分的合成前体,首先通过氨基酸激活酶PltF将脯氨酸激活为L-脯氨酰-AMP,然后将其连接到载体蛋白PltL的磷酸泛酰臂上;再通过FAD依赖脱氢酶PltE识别脯氨酰部分,该酶将脯氨酸氧化为相应的吡咯基[30]。PltA是黄素依赖性卤化酶,在N末端有保守的FAD依赖性卤化酶的结构域,C末端则有一个独特的螺旋区域与吡咯基-S-PltL底物结合,在4号位和5号位将吡咯基氯化得到二氯吡咯部分[31,32];随后,I-型聚酮合酶PltB和PltC利用丙二酰辅酶A单体使其碳链延长;PltG通过硫脂酶活性将延伸完全的聚乙酰底物和PltC的ACP结合域之间形成的硫酯水解,经由脱水反应形成间苯二酚部分,最终产生Plt(图1)。pltIJKNOP编码ABC-型转运复合体,负责将Plt转运至胞外[4,30]。
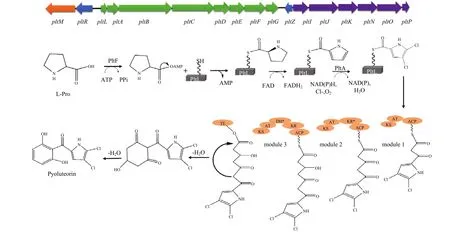
图1 Plt生物合成基因簇及推测的生物合成途径模式图[4,30]Fig. 1 Plt biosynthetic gene cluster and proposed biosynthetic pathway[4,30]
3 Plt生物合成调控网络
3.1 PltR和PltZ调控Plt生物合成
Plt生物合成基因簇包含两个转录调控因子基因pltR和pltZ。PltR是LysR家族转录因子,包含一个N-端螺旋-转角-螺旋的DNA结合基序和一个C-端LysR底物结合结构域。Li等[33]发现菌株M18中PltR蛋白结合在pltL启动子保守的DNA结合位点(GCCTTTGCG-N4-CGCAAAGGC),激活pltL的表达,敲除pltR后Plt的产量显著降低。PltZ属于TetR家族细菌调控蛋白,Huang等[34]发现PltZ抑制了pltH的转录进而负调控Plt的转运和外排,同时抑制Plt生物合成基因的表达[35]。pltZ基因的突变可引起Plt产量比野生型提高4.4倍。
3.2 间苯三酚类化合物作为信号分子调控Plt生物合成
在假单胞菌Pf-5中PhlD负责合成间苯三酚(phloroglucinol,PG),敲除phlD基因后,Pf-5不能产生Plt;外源添加低浓度PG能够诱导phlD突变体产生Plt,外源添加高浓度PG则抑制Plt的产生[36]。Yan等[37]发现外源添加10 nmol/L PG诱导ΔphlD中pltL的表达,但不能诱导ΔphlDΔphlR中pltL的表达,由此确定PG通过PltR诱导pltL的表达。
pltM编码一个FADH2依赖的卤化酶,敲除pltM不能产生Plt;外源添加PG同样不能诱导ΔphlDΔpltM中pltL的表达,由此推测Pf-5通过将PG转化为另外一种小分子化合物诱导pltL的表达。通过比较野生型与ΔpltM的代谢产物,ΔpltM不能产生PG结构类似的2-氯苯-1,3,5-三醇(PG-Cl)和2,4-二氯苯-1,3,5-三醇(PG-Cl2);体外酶活试验证明PltM能够将PG转化为PG-Cl和PG-Cl2;外源添加PG-Cl和PG-Cl2能够诱导pltL的表达和Plt的产生[37]。Mori等[38]结合PltM的晶体结构和体外酶活试验发现,PltM具有底物多样性和卤化多样性,可以将多种酚类化合物氯化、溴化和碘化。基于上述结果,Yan等[37]推测假单胞菌Pf-5中PhlD合成的PG经由PltM转化成PG-Cl和PG-Cl2,再与PltR结合诱导pltL的表达和Plt的产生。在假单胞菌PA1201基因组中phlD基因位于pltM的上游,与pltM相邻。我们未发表的结果表明Δ phlD和ΔpltM都不能合成Plt,在野生型菌株培养液中检测到PG-Cl和PG-Cl2,ΔpltM培养液中则没有检测到PG-Cl和 PG-Cl2。
3.3 群体感应机制调控Plt生物合成
群体感应是细菌利用小分子化合物进行细胞通讯的一种保守机制。目前只有在铜绿假单胞菌中有群体感应调控Plt生物合成的报道。铜绿假单胞菌中至少存在3种群体感应系统,包括以高丝氨酸内酯为信号分子的LasI/R和RhlI/R信号系统以及以喹诺酮为信号分子的PQS信号系统[39]。铜绿假单胞菌M18中LasI和RhlI产生的群体感应信号分子分别与其相应的受体LasR和RhlR结合,负调控pltR的转录水平,抑制Plt的生物合成[40]。PQS信号受体PqsR负调控Plt生物合成;PQS信号分子对Plt生物合成及基因表达无显著调控作用[41]。Huang等[42]在M18中发现LuxR型群体感应调节基因vqsR不影响高丝氨酸内酯信号分子合成,但可以正调控Plt生物合成。
3.4 双组分系统GacS/GacA正调控Plt生物合成
GacS/GacA 双组分信号转导系统在感应到外界信号时激活3个sRNA(RsmXYZ)的转录,从而竞争性和阻遏蛋白RsmA、RsmE结合,释放靶基因mRNA的核糖体结合位点[43,44]。Huang等[40]发现在铜绿假单胞菌M18中GacA正调控pltR的翻译水平,RsmA负调控pltR的翻译水平。Wang等[45]发现在假单胞菌H78中RsmE直接与pltR和pltAB的mRNA结合负调控Plt生物合成;RsmA通过未知机制正调控pltR和pltLABCDEFG操纵子的转录。其次,RsmA/RsmE与GacS/GacA-RsmXYZ之间存在一个正反馈调控机制,对于激活Plt生物合成至关重要(图2)。关业俊等[46]发现在假单胞菌H78中双突变rsmA/E后,hmgA基因对Plt的合成发挥强烈抑制作用,是潜在的RsmA/E下游调控基因。
3.5 转录因子调控Plt生物合成
Plt的生物合成受到多个全局性转录因子调控(图2)。σ因子RpoS负调控Plt生物合成,管家σ因子RpoD正调控Plt生物合成[47,48]。氮代谢相关的σ因子RpoN正调控Plt的生物合成[49];在假单胞菌Pf-5中突变rpoB基因能提高Plt的产量[50];TetR家族转录调控子PsrA、小RNA伴侣蛋白Hfq、传感器组氨酸激酶RetS以及全局性转录因子Vfr负调控Plt生物合成[51-53]。Lon蛋白酶与假单胞菌毒力因子产生相关,负调控Plt生物合成[54]。在磷饥饿条件下,PhoR/B促进磷元素的吸收和利用,正调控Plt生物合成[55]。细菌在受到压力胁迫时会产生(p)ppGpp信号分子,敲除(p)ppGpp的合成基因RelA和SpoT显著降低Plt生物合成[56]。
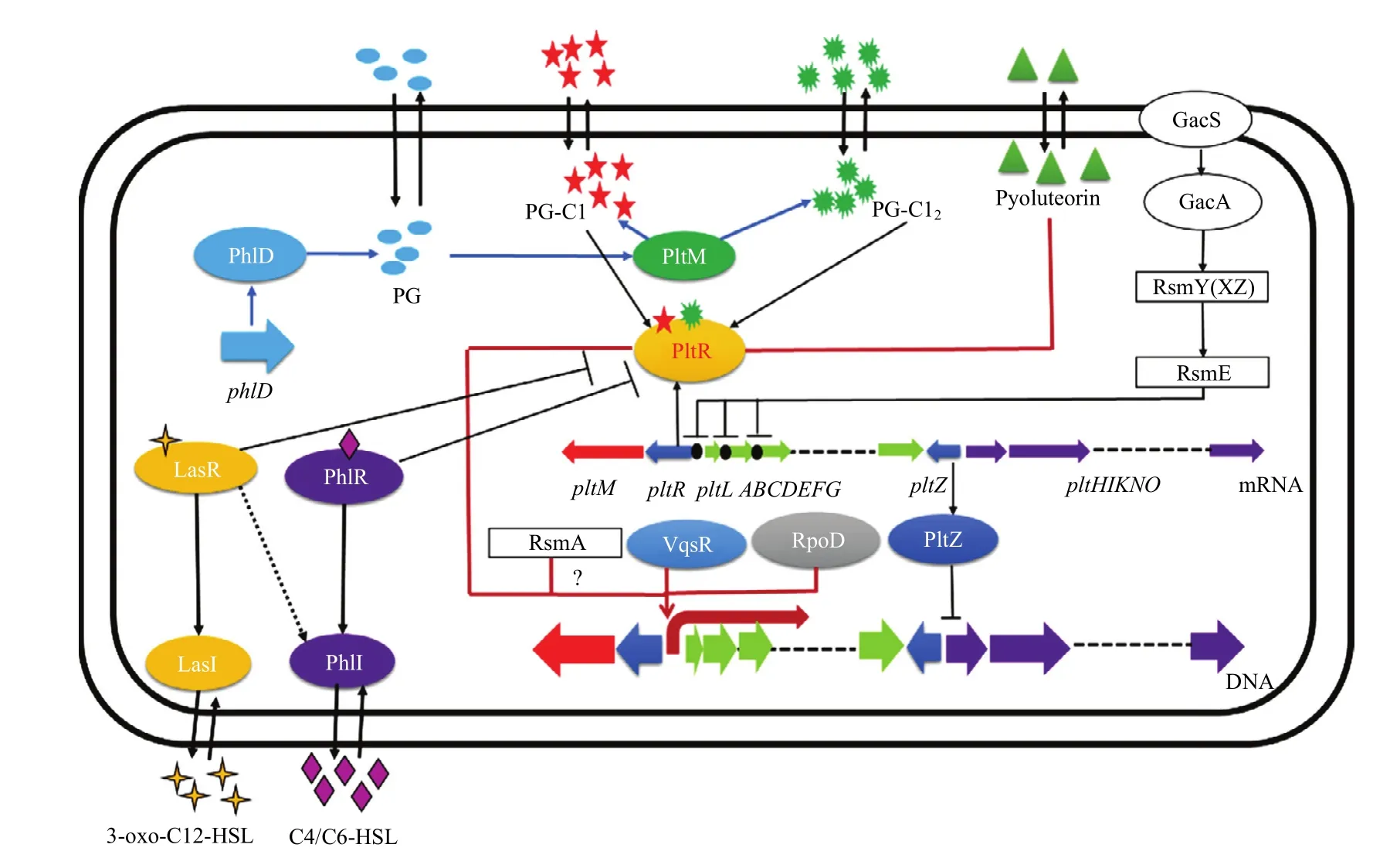
图2 Plt生物合成调控机制模式图Fig. 2 Proposed regulatory network for Plt biosynthesis
3.6 环境因素影响Plt的产生
Wu等[57]发现Plt生物合成基因簇在28 ℃比在37 ℃表达量高。除此之外,培养环境中的营养成分对Plt的合成至关重要,Duffy等[58]发现在假单胞菌CHA0中Zn2+、Co2+和甘油促进Plt的合成;葡萄糖抑制Plt的合成;100 mmol/L 磷酸盐会降低 Plt 产量。次生代谢物质如 DAPG、Prn在转录水平上抑制Plt生物合成[59],Plt自身作为信号分子在转录水平上提高Plt生物合成基因簇的表达[60]。Matano等[18]发现环境中氯离子促进假单胞菌YGJ3产生Plt。Yuan等[16]发现用2%乙醇作为唯一碳源显著提高Plt产量,发酵体系Plt浓度可达150 mg/L。此外,在以果糖或甘露醇作为唯一碳源的培养基中假单胞菌PA1201的Plt产量显著提高;葡萄糖和琥珀酸显著抑制Plt生物合成[13]。
4 高产Plt工程菌株构建及其应用潜力研究
2011年许煜泉等[61]将M18中pqsR基因敲除后得到基因工程菌株,Plt产量约为150 mg/L,比野生型发酵效价提高了3~4倍。Yan等[62]将pltR中23种稀有密码子用同义的优选密码子取代,所得的突变体产生的Plt产量比野生型Pf-5高15倍。Shi等[63]将假单胞菌H78中负调控Plt的rsmE、lon、pltZ基因以及在pltR转录起始位点后12~42个碱基敲除,并且过表达Plt转运系统操纵子pltIJKNOP后,Plt产量提高14.3倍,达到214 mg/L。
Plt对马铃薯晚疫病、黄瓜霜霉病、水稻胡麻斑病、柑桔溃疡病有防治效果,能抑制终极腐霉等植物病原菌[10,14]。Hu等[12]发现Plt对终极腐霉引起的棉花和甜菜立枯病具有很强的防治效果。最近的研究表明Plt可能是人类三阴性乳腺癌药物发现的潜在先导化合物[64]。
Zhang等[65]发现可见光辐射对Plt稳定性没有明显影响,紫外线辐射大大缩短Plt半衰期至3~4 d,在黑暗中Plt半衰期为25 d。Plt在纯水溶液中和室温下相对稳定,半衰期超过20 d,酸性或碱性溶液会加剧其降解。董卉等[66]建立了Plt土壤残留检测方法,发现Plt在地表土壤和根际土壤中的半衰期分别为42.26和32.84 h,表明Plt具有很好的生物安全性和环境兼容性,但也是Plt无法在土壤中维持长期有效生物防治效果的原因。Chen等[67]利用负载二氧化硅药物的纳米材料制备了生物农药Plt的缓释配方, 纳米结构的二氧化硅与Plt分子状态的结合对于大田应用具有很好的效果,克服了Plt在使用过程中生防功能迅速丧失的难题。
5 结论与展望
Plt作为一种重要的假单胞菌代谢产物,其结构、生物合成机制和调控网络基本明确,在植物病害生物防治中的作用也得到广泛认可,但Plt相关的基础与应用研究需要在如下几方面进一步探究:(1)生物合成机理还需要进一步完善,大部分合成酶的生化功能还有待验证。(2)合成调控机制,尤其是PG-Cl2与PltR的结合如何激活pltL的表达,尚需进一步深入研究。是否还有更多的调控因子参与Plt基因簇的表达调控?(3)Plt的产量偏低,目前的“高产”工程菌株Plt发酵效价无法满足产业化要求,导致生产成本高,影响其推广应用。(4)Plt在土壤环境中稳定性不够好。可以通过合成生物学手段,引入修饰基因修饰Plt,合成更稳定和更高效的新产物。(5)Plt抑制植物病原菌生长的作用机理和作用靶标有待进一步研究。
