肺血栓栓塞症影响肺动脉肉瘤早期诊断二例
2021-05-11李世泽罗益锋
李世泽,罗益锋
1 病例介绍
病例1 患者,男,41岁,因“反复胸闷、气促半年,加重1月”入院。患者半年前活动或登楼后反复出现胸闷、气促,安静休息后可缓解,无胸痛、咯血、心悸、呼吸困难及肢体浮肿,起初症状不明显,未予重视和就诊,但病情反复。1个月前上述症状加重,伴咳嗽,以干咳为主,安静休息后未见缓解,遂至当地医院就诊,予以抗炎、平喘治疗未见好转(具体不详),遂行胸部CT肺动脉造影(computed tomography pulmonary angiography,CTPA)。结果发现:肺动脉分叉、右肺动脉及其分支、左肺动脉舌段、左下叶肺动脉开口动脉血栓形成。遂转入我院。既往有继发性肺结核,外院规律抗结核治疗1年,未见复发。近期体重减轻3 kg。入院体查:血压114/73 mmHg,呼吸频率20次/min,双肺呼吸音粗,未闻及干湿啰音。心率95次/min,胸骨左缘第二肋间可闻及收缩期3/6级杂音。实验室检查,血常规:白细胞(white blood cell,WBC)1.1×109/L,血气分析:动脉血氧分压(arterial partial pressure of oxygen,PaO2)65 mmHg,动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2)35 mmHg,血氧饱和度(blood oxygen saturation,SaO2)93%,D-二聚体0.84 mg/L,脑尿钠肽前体(pro-brain natriuretic peptide,proBNP)512 pg/ml,肿瘤标志物未见异常。心电图:Ⅰ导联深S波,Ⅲ导联小Q波,T波倒置,前壁导联T波低平、倒置,QRS波群递增不良、电轴右偏。彩色多普勒超声心动图:主肺动脉增宽,右房右室增大,肺动脉高压(重度),未除外肺栓塞,三尖瓣关闭不全(轻度),心包少量积液,左室收缩功能正常。考虑诊断为肺血栓栓塞症(pulmonary thromboembolism,PTE),遂予爱通立50 mg静脉注射溶栓治疗及序贯抗凝治疗。溶栓后患者自诉上述症状好转,复查胸部CTPA提示:肺动脉主干、左右肺动脉干及其分支软组织密度影,增强后轻度强化,右肺动脉瓣闭塞,不排除为肿瘤并血栓形成,心包少量积液(见图1)。遂转入心脏外科,于全麻下建立体外循环术(cardio-pulmonary bypass,CPB)行肺动脉肿瘤切除术,因肿瘤浸润或发生远端转移广泛无法完全切除,术中冰冻切片提示肺动脉肉瘤(pulmonary artery sarcoma,PAS)。术后病理结果分析发现该病例为肺动脉内膜肉瘤(见图2)。免疫组化结果:Actin部分(+),结蛋白(Desmin)(-),钙调素结合蛋白(H-caldesmon)(+),MDM2部分(+)(见图3)。术后转入ICU,病情逐渐恶化于2015-02-17死亡。

肺动脉主干及左右肺动脉干及其分支大面积密度影,增强后轻度强化,右肺动脉瓣闭塞,心包少量积液
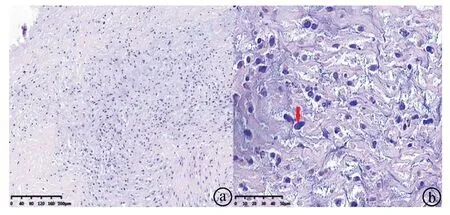
显微镜观察发现,肿瘤细胞大部分呈凝固性坏死,仅见少许变异的梭形瘤细胞,病理性核分裂,间质胶原化明显(HE×100,HE×400)

ⓐActin部分(+);ⓑDesmin(-);ⓒH-caldesmon(+);ⓓMDM2部分(+)(SP×400)
病例2 患者,男,30岁,因“晕厥1月,胸闷、胸痛伴气促2周”入院。患者1个月前坐长途汽车后突然出现晕厥,意识丧失,呼之不应,持续30 min后自行苏醒,遂至当地医院就诊,行头颅CT检查未见异常,未做进一步诊治。2周前无明显诱因下出现胸闷、胸痛,伴活动后气促,无咳嗽、咯血,无发热,再次在当地医院就诊,行胸部X线检查未见异常,胸部CT(平扫+增强)考虑诊断为PTE,予以克赛0.4Axa IU,每12 h一次,皮下注射3 d后配合华法林3 mg口服抗凝治疗,症状未见好转,遂于2016-10-25转入我院。既往病史无特殊,近期体重减轻3.5 kg。查体:血压98/60 mmHg,呼吸频率16次/min,双肺呼吸音粗,未闻及干湿啰音。心率81次/min,律齐,胸骨左缘第二肋间可闻及收缩期3/6级杂音。实验室检查:血尿常规未见异常,血气分析结果显示其pH值7.46,PaO2125 mmHg,PaCO237 mmHg,D-二聚体0.29 mg/L,proBNP 1 834 pg/ml。肿瘤标志物未见异常。心电图、胸片结果未见异常。腹部肝、胆、脾、肾及双下肢深静脉彩色多普勒超声检查正常。彩色多普勒超声心动图检查:肺动脉栓塞(主干狭窄率90.7%),二尖瓣前叶脱垂并关闭不全(轻微),三尖瓣关闭不全(中度)。胸部CTPA提示主肺动脉和左、右主肺动脉主干管腔内见大块的腔内充盈缺损,存在“蚀壁征”现象,考虑为主肺动脉及左、右肺动脉主干血栓栓塞(见图4)。考虑诊断为急性PTE,遂予爱通立50 mg静脉注射溶栓治疗,溶栓后患者自诉上述症状稍有好转,于2016-10-27复查胸部CTPA提示:与2016-10-25对比,主动脉及左右肺动脉主干充盈缺损影相仿,经查阅文献后,考虑肉瘤可能性大。遂转心脏外科进一步手术治疗,在全麻下建立CPB行PAS切除术,术程顺利,分析术后病理结果发现该病例为肺动脉内膜肉瘤(见图5)。免疫组化结果:钙结合蛋白S100(-)、CD34(-),Actin/SMA(部分+)、波形蛋白(Vimentin,Vim)(+)、CD31(-)、BCL-2(+)、Desmin(-)、CD57(-)、Ki67(40%+)、EGR(-)、Fli-1部分(弱+)、血小板衍生生长因子受体α(platelet-derived growth factor receptor-α,PDGFR-α)(+)、CD117(-)、F8(-)。术后予以表柔吡星(30 mg)联合异环磷酰胺(3 g)化疗,3周1疗程,共化疗6疗程,术后随访1年复查胸部CT血管造影(computed tomography angiography,CTA)发现肿瘤复发,随访至今患者仍存活。

主肺动脉和左、右主肺动脉主干管腔内见大块的腔内充盈缺损,存在“蚀壁征”现象
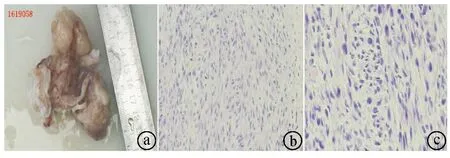
建立CPB行PAS切除术得到的肿瘤样本ⓐ;显微镜观察发现肿瘤组织中存在大量的梭形细胞,核短梭形,胞浆丰富,核分裂象易见,肺部分瘤细胞呈星芒状,间质黏液变性,可见大片坏死(免疫组织化学染色×100,免疫组织化学染色×400)
2 讨论
2.1PAS是一种肺血管系统的恶性肿瘤,极为罕见。自1923年报道首例以来,多以个案或少数病例报道。临床上,由于病例少见,医师经验不足以及PAS自身具有的特征没有被充分认识,极易被误诊为PTE[1,2],使患者错失早期诊治的良好时机,给患者的后续治疗带来更多的困难。原发性PAS在临床上极为罕见。自Mandelstamm首次报道以来,国内外文献报道逐年增加,但仅300例左右[3]。PAS发病年龄为13~81岁,中位年龄为49岁,男女发病比例大致相同[4],而本研究2例均是男性,其病因目前尚不明确。有研究认为,PAS可能源于动脉内膜干细胞的肿瘤性诱变,从而转变为肌纤维母细胞[5]。由于PAS的临床表现、实验室检查以及影像学表现均缺乏特异性,最终依赖于尸检或者手术术后病理结果来确诊[1,4]。
2.2PAS主要表现为肺动脉高压和右心功能衰竭,常见的临床症状包括呼吸困难、气促、胸痛、咳嗽、体重减轻、晕厥等[6,7]。高元明和刘双[8]总结11例PAS患者的临床表现,主要为活动性呼吸困难、气促、晕厥、咳嗽、胸痛等症状。PAS起病隐匿,其临床表现、影像学检查等与PTE极其相似,缺乏特异性诊断特征,难以实现PAS早期诊断及其与PTE鉴别诊断的目标,易造成漏诊和误诊。临床上出现多例的PAS患者被误诊为PTE,由于PAS发病率低,其发病的分子机制尚不清楚,并且有关PTE与PAS病理关系的研究鲜有报道。有研究[9]表明,PAS由多能间充质干细胞发育而来,具有多向分化的潜力,它可能与高度分化的骨肉瘤、梭形细胞肉瘤等肉瘤的局灶性病变混合,增加疾病的复杂性。PAS可通过诱导产生肿瘤性栓塞来阻塞血管腔,导致出现严重的临床症状及周围器官栓塞[10]。在极少数情况下,PAS引起的栓塞可能具有类似于慢性血栓栓塞性肺动脉高压的特征,而部分PTE患者经治疗后会发展成慢性血栓栓塞性肺动脉高压[11]。此外,炎症和缺氧微环境是肿瘤恶化的重要特征之一。有研究[12]发现,炎症是PTE发生后右心室损伤的重要病理过程,可间接引起患者不良的临床预后。低氧诱导因子(hypoxia-inducible factor,HIF)参与调节肿瘤的血管新生、增殖及转移等过程。PTE的急性缺氧会导致血管收缩,肺泡缺氧和增加凝血活动,依赖于活性氧自由基(reactive oxygen species,ROS)或HIF的氧气传感途径在肺血管收缩中起重要调节作用[13,14]。这些研究表明,PAS和PTE除了具有相似的临床症状外,在疾病发生过程中可能存在密切的联系。基于静脉血栓的形成,凝血功能异常与血管壁病理变化之间的关系是PTE的最初事件。抗凝或溶栓治疗对PTE患者的临床疗效较为理想,但最近报道有1例PAS患者经抗凝治疗后,胸膜疼痛不仅得不到缓解,而且逐渐出现右心室功能障碍的症状[15]。这表明PAS与PTE的发病机理可能不同,对PAS患者行抗凝治疗不仅错过最佳的治疗时机,还可能使病情恶化。PTE是否是PAS的早期表现,PAS是否会诱导PTE的发生或PTE与PAS是否同时存在,这些问题非常值得我们进一步深入探讨。利用分子生物学和第三代测序的技术,筛查PAS与PTE患者的差异基因,揭示疾病的分子机理,可能对后续的诊断和治疗具有重要的指导意义和临床价值。
2.3为了提高PAS患者的早期诊断率和治愈率,鉴别PAS与PTE的差异性显得尤为重要。有学者认为,PAS与PTE主要区别在于右心功能衰竭的进度和程度,PAS患者多为慢性心功能不全表现,而PTE患者因急性肺动脉主干的大块血栓形成,则可表现为突发急性右心功能衰竭。此外,PAS患者多无明确下肢深静脉血栓形成病史(如长期卧床及手术史等)。本研究2例PAS患者出现气促、胸闷、胸痛、体重下降等症状,慢性病程,与上述研究结果基本一致。
2.4超声心动图(ultrasonic cardiogram,UCG)作为无创、简便、快速的成像方法,为PAS的诊断和手术提供了重要、准确的信息,具有重要的临床价值。UCG作为一项临床常规检查,可及时判断肺动脉瓣与肿物的关系,了解心、主肺动脉腔内情况,检测右心室内径、肺动脉收缩压、右室流出道及主肺动脉内占位性病变,同时,可比较准确地判断下肢、下腔、盆腔静脉等部位有无血栓形成,从而在鉴别诊断上具有重要价值。研究发现,在患者突然出现血流动力学不稳定,未能及时行CTPA检查时,UCG可作为一项关键性的检查。另有文献[16]报道,UCG对PAS诊断具有重要的价值,可实时显示PAS与主肺动脉及左右肺动脉的关系。由于PAS临床病例极少,临床医师对该疾病的认识、检查操作和诊断经验不足,仅通过UCG结果分析,容易将PAS误诊为PTE。甘辉立等[17]总结19例PAS患者早期行UCG检查后全部误诊为PTE。Yamasaki等[18]研究发现,如果肿瘤累及肺动脉瓣进入右心室,结果会导致一定程度的肺动脉高压,肉瘤的逆行发展常误诊为PTE。不恰当的抗凝或溶栓治疗,引起癌栓脱落,可能导致肿瘤扩散。本研究2例患者行UCG提示肺动脉高压,二尖瓣、三尖瓣关闭不全,早期均误诊为PTE。这提示UCG检查需结合相关临床病史,同时注意鉴别PAS和PTE,避免误诊和后续错误的治疗。
2.5CTPA可能是目前鉴别PAS和PTE最有价值的检查,表现为肺动脉扩张、管腔狭窄、管腔内占位病变及充盈缺损等,具有重大临床意义。有文献[3]报道,CTPA检查发现约90%的PAS患者有2个以上的部位受累,累及主肺动脉(占85%),累及右肺动脉(占71%),累及左肺动脉(占65%),累及右室流出道(占10%)。Gan等[19]研究总结12例PAS患者发现,“蚀壁征”是PAS最具特征性的CTPA表现。“蚀壁征”指面向血流面的边缘出现隆起、饱满,甚至呈分叶状的表现,体现了肿瘤组织局部生长、堆积、膨胀及浸润的生物学行为,而PTE的栓子面向血流面的形态多为“杯口状”。此外,PAS肿瘤内部因出现坏死和出血常表现为密度明显不均匀强化的充盈缺损,而PTE的血栓栓子多呈密度较为均匀的充盈缺损[1,2]。这不仅有助于PAS与PTE的鉴别诊断,也有助于PAS的早期诊断和治疗。本研究2例患者行胸部CTPA检查发现,肿瘤累及2个以上部位,累及主肺动脉和双侧肺动脉,且有1例患者存在“蚀壁征”现象,与上述文献表现类似,认为当UCG检查发现主肺动脉内占位性病变、肺动脉高压及右心流出道梗阻等征象,应及时行CTPA检查,可大大减少误诊和避免延迟治疗。
2.6此外,PET-CT作为新开展的一种影像技术,获得患者病灶CT解剖图像,同时提供PET功能代谢图像,优势互补,从而可对PAS作出较为全面、准确的判断。Ito等[20]比较了3例PAS和10例PTE的PET-CT,发现PAS组的最大标准摄取值明显高于PTE组,差异有统计学意义(P<0.05)。Guo等[21]报道1例PAS患者,行PET-CT显示双侧主肺动脉发生明显高代谢,以近端为主,提示恶性病变的存在。因此,PET-CT有助于PAS和PTE的鉴别诊断,为临床医师提供更多的选择和帮助。当然,PAS和PTE的最准确鉴别诊断仍靠手术及术后病理学检查。
综上所述,结合临床表现,UCG、CTPA、PET-CT有助于对PAS的诊断和鉴别诊断,但临床医师需高度警惕UCG的诊断,尽可能避免早期误诊和误治的发生。此外,及时行CTPA检查和抗凝治疗之后再次复查CTPA,对PAS和PTE的早期鉴别诊断有极大的帮助。临床医师须提高对PAS的认识,早期确诊和治疗。
