非洲猪瘟病毒抗体间接ELISA 检测方法的建立与应用
2021-05-11荣明轩徐保娟南文龙范根成李国攀陈清清胡基雄张志翔
荣明轩,徐保娟,南文龙,范根成,李国攀,王 席,陈清清,胡基雄,李 欢,谢 明,张志翔,荣 俊,
(1.长江大学生命科学学院,湖北荆州 434000;2.青岛易邦生物工程有限公司,山东青岛 266114;3.中国动物卫生与流行病学中心,山东青岛 266032;4.长江大学动物科学学院,湖北荆州 434000)
非洲猪瘟(African swine fever,ASF)是一种对家猪和欧亚野猪具有极高致死性和传染性的病毒性疫病,给世界生猪养殖业造成了巨大经济损失,被世界动物卫生组织(OIE)列入须通报动物疫病名录[1]。1909 年,ASF 在肯尼亚定居者饲养的猪中被首次发现,1921 年Montgomery 将其作为一种有别于传统猪瘟的疫病进行了报道[2-3];1957—1960 年,ASF 先后两次从西非传播到葡萄牙,继而传播到加勒比地区以及巴西和欧洲的其他国家[4]。2018 年8 月,我国报告了首起ASF 疫情,随后疫情迅速在全国传播,给我国生猪养殖业造成了巨大经济损失[5]。
非洲猪瘟病毒(African swine fever virus,ASFV)是引起ASF 的病原体[6]。ASFV 是一种二十面体的大型包膜病毒,双链DNA 基因组长度为170~190 kb,基因组含有160~175 个开放阅读框(ORF),编码150~200 种蛋白质[7-8]。这些编码蛋白中的主要结构蛋白包括:A238L 蛋白、CD2v 蛋白、多基因家族蛋白、P54 蛋白、P72 蛋白和P32 蛋白。其中,P32 蛋白由CP204L基因编码,相对分子质量约为30 ku,也被称为P30 蛋白。该蛋白在病毒进入宿主细胞过程中起重要作用,有良好的抗原性,可在感染早期表达和分泌,常被用于感染后免疫反应的早期检测,是一种理想的血清学诊断和免疫学检测抗原[9-10]。
近年来,各种基因工程亚单位疫苗在我国动物疫苗生产企业中被广泛研制。这些疫苗蛋白中许多含有多聚组氨酸标签。猪群使用带组氨酸标签的疫苗后,会产生相应的抗多聚组氨酸抗体。在兽医临床检验过程中,如果包被抗原中也含有多聚组氨酸标签,就会出现抗体假阳性的检测结果。为了消除抗多聚组氨酸抗体的影响,本研究利用大肠杆菌表达并纯化了不含多聚组氨酸标签的重组ASFV P30 蛋白,并以它作为间接ELISA(iELISA)的包被抗原,建立了一种ASFV 抗体iELISA 检测试剂盒,同时与带组氨酸标签的ASFV P30-2His6 蛋白iELISA 检测方法比较,发现使用不含多聚组氨酸标签的重组ASFV P30 抗原作为包被抗原,能消除多聚组氨酸抗体造成的假阳性反应。本方法的建立为ASFV 早期感染检测及其疫苗免疫效果评价提供了一种可靠的方法。
1 材料与方法
1.1 血清样品
猪 圆 环 病 毒2 型(porcine circovirus 2,PCV2)阳性血清,由长江大学生物医药研究所保存并提供;猪塞内卡病毒(senecavirus A,SVA)阳性血清,由哈尔滨兽医研究所翁长江研究员惠赠;猪细小病毒(porcine parvovirus,PPV)阳性血清、猪口蹄疫病毒(foot and mouth disease virus,FMDV)阳性血清、猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)阳性血清、猪圆环病毒3 型(porcine circovirus 3,PCV3)阳性血清,由青岛易邦生物工程有限公司提供;ASFV 阳性血清(15 份,由中国动物卫生与流行病学中心国家非洲猪瘟参考实验室提供),ASFV 临床阴性血清(40 份,由青岛易邦生物工程有限公司提供),均通过法国爱迪威ASFV iELISA 抗体检测试剂盒(ID.vet 试剂盒)和Western blot 方法检测确认。
1.2 主要试剂
PageRuler 预染蛋白质,相对分子质量标准(10~180 ku),购自Thermo 公司;非预染蛋白质,相对分子质量标准(14.4~116.0 ku),购自碧云天生物技术有限公司;JY98-III 超声波破碎仪,购自宁波新芝生物科技股份有限公司;Ni-NTA His Bind Resin,购自上海七海复泰生物科技有限公司;HRP 标记的羊抗猪IgG(H+L),购自KPL 公司;TMB 单组分显色剂,购自北京索莱宝科技有限公司;NC 膜,购 自Pall Gelman Laboratory 公 司;ECL 化学发光超敏显色试剂盒,购自上海翊圣生物科技有限公司;Sepharose 300 分子筛及DEAE(Sepharose Fast Flow)阴离子交换柱,购自GE公司。其他试剂均为进口分装或国产分析纯。
1.3 重组蛋白构建和诱导表达
根 据Miao 等 于2018 年10 月 在GenBank上发布的ASFV 全基因序列(ACCESSION:MH766894),设计ASFV P30 蛋白全基因编码序列,并在序列的5'末端加上BamH I 限制性核酸内切位点序列,同时去掉原序列3'末端的终止密码子并加上XhoI 酶切位点。设计序列送交北京美吉桑格生物医药科技有限公司进行全基因合成,并插入在表达质粒载体pET28a 相应的酶切位点上。用带有ASFV P30 蛋白编码序列的pET-28a 质粒(pET-28a-ASFV P30-2His6)转化至E.coli.BL21 的感受态细胞,即得到E.coli.BL21/pET-28a-ASFV P30-2His6。用该工程菌诱导表达的ASFV P30 蛋白上、下游各有1 组His6 标签。该菌种由本实验室前期构建并保藏。
根据ASFV P30 蛋白编码序列合成1 对PCR引物。上游引物起始密码前加上NcoI 酶切位点,下游引物添上终止密码子并在3'末端加上XhoI 酶切位点。用pET-28a-ASFV P30-2His6 为模板进行PCR 扩增。扩增产物用NcoI/XhoI 进行双酶切,与同样酶切线性化的pET28a 质粒连接,获得表达工程菌E.coli.BL21/pET-28a-ASFV P30。
将重组E.coli.BL21/pET-28a-ASFV P30-2His6和E.coli.BL21/pET-28a-ASFV P30 进行诱导表达。诱导剂为α-乳糖,工作浓度为0.03 mol/L。离心收集表达菌。
1.4 重组蛋白纯化
将收集的经过诱导后的E.coli.BL21/pET-28a-ASFV P30-2His6 湿菌体,按照质量体积比1:10,用PBS(0.05 mol/L磷酸盐缓冲液,pH7.4)充分重悬,超声破碎处理后离心收集上清,用0.45 μm 滤器过滤上清,获得预处理蛋白液。采用Ni-NTA 树脂亲和层析纯化ASFV P30-2His6 重组蛋白。
将收集的经过诱导后的E.coli.BL21/pET-28a-ASFV P30 湿菌体,按照质量体积比1:10,用0.1 mol/L pH10.53 的碳酸缓冲液充分重悬,超声破碎处理后离心收集上清,用0.45 μm 滤器过滤上清,获得预处理蛋白液。用Sepharose 300 凝胶过滤层析柱和DEAE Sepharose Fast Flow 阴离子交换柱进行分离纯化。
1.5 重组蛋白检测
对纯化后的重组蛋白进行SDS-PAGE 电泳以及蛋白浓度测定。使用Western-blot 对纯化后的两种重组蛋白进行分析。用12%的分离胶进行SDS-PAGE 凝胶电泳,然后转印至NC 膜上;使用AS FV 阳性猪血清作为一抗(稀释倍数为1:5 000),37 ℃孵育1 h,用1×PBST(含有0.05% Tween-20 的PBS 缓冲液)洗3 次,10 min/次;加入HRP 标记的山羊抗猪IgG 抗体(1:20 000 稀释)作为二抗,37 ℃孵育1 h,用1×PBST 洗3 次,10 min/次;使用ECL 化学发光试剂盒,按照操作方法曝光显色并拍照分析结果。
1.6 iELISA 检测方法建立
采用棋盘滴定法,将纯化后的重组ASFV P30 蛋白用包被液(0.05 mol/L 碳酸缓冲液,pH9.5),按照标准稀释法稀释至质量浓度分别为2.5、5.0、10.0、20.0 μg/mL,包 被ELISA 板,每孔加样100 μL,25 ℃孵育4 h 后空干包被蛋白液;用包被液(0.01 mol/L 磷酸钾缓冲液,pH7.2)每孔200 μL 清洗3 遍后空干;再加封闭液(5%脱脂奶粉溶液)200 μL,25 ℃封闭2 h,封闭完成后倒尽封闭液,空干待用。用封闭液对ASFV 阳性和阴性血清分别进行倍比稀释(稀释比例分别为1:500、1:1 000、1:2 000、1:4 000),同时将HRP标记的羊抗猪酶标记抗体用1×PBST缓冲液稀释,稀释比例分别为1:10 000、1:20 000、1:40 000;按照常规iELISA 方法操作,保证洗涤完全,用终止液(2 mol/L 硫酸溶液)终止反应后读数OD450。选择标准:OD450≈1.0,阴性血清OD450≤0.1,阳性血清和阴性血清的OD450比值(P/N)最高。
分别选择1%明胶溶液、2%牛血清白蛋白溶液、5%脱脂奶粉溶液、10%胎牛血清作为封闭液,封闭2 h,分别用ASFV 阴、阳性血清进行ELISA试验,选择最佳封闭液。
1.7 ASFV 抗体阳性临界值确定
取70 份ASFV 临床阴性猪血清,采用优化的ELISA 方法进行检测。计算OD450平均值和标准偏差,按照阳性临界值=平均值+5×标准差,确定该ELISA 方法的OD450临界值;设临床样品OD值/阴性样品OD 值(S/N)大于2.5 为阳性临界值,大于该数值判定为ASFV 抗体阳性,反之则为抗体阴性。
1.8 特异性试验
以上述建立的iELISA 检测方法,对PPV、PRRSV、FMDV、SVA、PCV2 和PCV3 的阳性血清以及ASFV 阳性、阴性血清进行检测,根据几种血清检测的OD450值,判定该ELISA 检测方法的特异性。
1.9 灵敏性试验
将ASFV 阳性猪血清分别按1:800、1:1 600、1:3 200、1:6 400比例稀释,采用优化的iELISA方法,检测不同稀释比例的阳性血清,根据检测结果判定阳性血清的最大稀释倍数,评价该方法的灵敏性。
1.10 重复性试验
用同一批次纯化的重组ASFV P30 蛋白包被酶标板,对4 份猪血清样品进行ELISA 检测,每份样品重复4 孔,考察该方法的批内重复性;另以5个批次纯化的重组ASFV P30 蛋白包被酶标板,分别对ASFV 强阳性、阳性、阴性血清进行ELISA检测,考察该方法的批间重复性。
1.11 已知样本检测比较
分别用重组ASFV P30 蛋白iELISA 与重组ASFV P30-2His6 蛋白iELISA 两种检测方法,对已经检测确认的阳性和阴性血清进行检测,评估这两种方法与临床样本的吻合度。试验数据用Excel 自带程序统计。
2 结果
2.1 ASFV P30 蛋白编码基因扩增
以pET-28a-ASFV P30-2His6 为模板,用前述引物进行PCR 扩增,结果如图1 所示。平行的2个阳性扩增产物(a、b)大小均为500~750 bp,与设计的扩增基因大小吻合。

图1 ASFV P30 蛋白编码基因扩增结果
2.2 重组ASFV P30 蛋白表达
将诱导表达后的重组ASFV P30 蛋白进行SDS-PAGE 检测。由电泳结果(图2)可见,去掉组氨酸标签的重组ASFV P30 蛋白相对分子质量略小于35 ku,而表达蛋白的全菌液和全菌液离心后的上清液蛋白量相当,表明该蛋白的原核表达为可溶性表达。
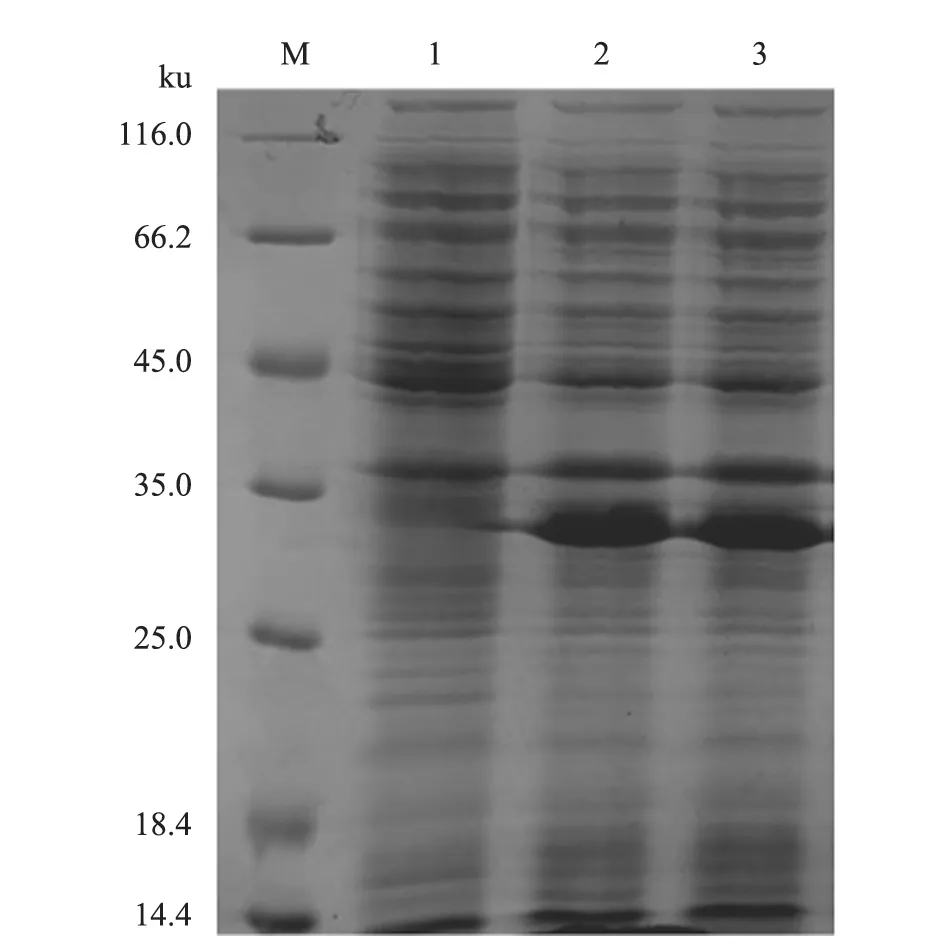
图2 E.coli BL21(DE3)/pET-28a-ASFV P30 表达结果
2.3 重组蛋白纯化
将纯化后的重组ASFV P30 蛋白和重组ASFV P30-2His6 蛋白进行SDS-PAGE 电泳。伯乐凝胶成像仪灰度扫描结果(图3)显示,纯化后的重组ASFV P30 蛋白纯度约为95%,纯化后的重组ASFV P30-2His6 蛋白纯度约为98%。可见,经过Sepharose 300 凝胶过滤层析和DEAE Sepharose Fast Flow 阴离子交换层析后的重组ASFV P30 蛋白纯度仍稍低于采用Ni-NTA 亲和层析纯化的重组ASFV P30-2His6 蛋白,重组ASFV P30-2His6 蛋白相对分子质量稍大于35 ku。
2.4 重组蛋白Western-blot 分析
Western-blot 分析结果(图4)显示,重组ASFV P30 蛋白的杂交带小于35 ku,而重组ASFV P30-2His6 蛋白的杂交带大于35 ku,与预期相符,且杂交条带均清晰,表明两种重组蛋白都具有较好的免疫反应性。
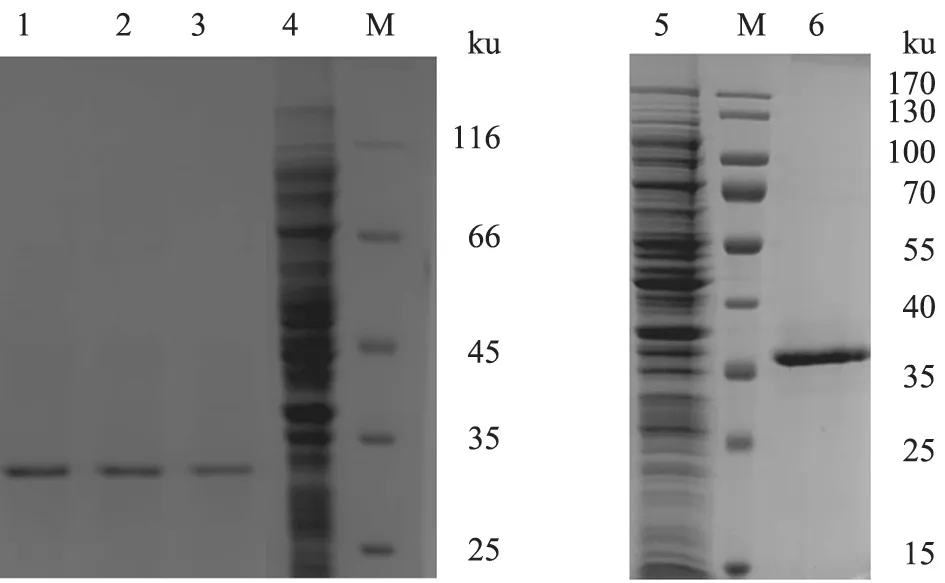
图3 纯化重组蛋白SDS-PAGE 分析结果

图4 重组蛋白Western-blot 分析结果
2.5 最佳反应条件设定
按照1.6 棋盘滴定法的检测结果(表1),结合设定的优选原则,即阳性血清OD450≈1.0,阴性血清OD450≤0.1,阳性血清和阴性血清的ELISA检测OD450比值(P/N)最高;选定抗原包被浓度20 μg/mL,血清稀释比例1:1 000,酶标第二抗体工作浓度1:40 000。此时临床阳性血清的P/N值最大(19.58),阳性血清的OD450值在1.0 附近。
iELISA 的封闭液优选结果(图5)显示,当封闭液选择5%脱脂奶粉时,P/N值(13.06)最大且阳性血清OD450在1.0 附近。
表1 4 组抗原不同血清稀释度的光密度值(OD450)

图5 最佳封闭液确定结果
2.6 阳性临界值确定
阳性临界值确定结果(图6)显示,70 份ASFV 临床阴性样品的平均OD450值为0.104,标准差为0.024,阳性临界值=平均值+5×标准差,为0.22。因此,当待检血清样品的OD450>0.22 时,判定为ASFV 抗体阳性,OD450≤0.22 时,判定为抗体阴性。
2.7 特异性试验

图6 iELISA 临界值确定结果
试验结果(图7)显示,仅ASFV 阳性血清的检测结果OD450值高于0.22,为阳性,而PPV、PRRSV、FMDV、SVA、PCV2 和PCV3 的阳性血清检测的OD450值均低于0.22,即为阴性,表明该检测方法具有良好的特异性。
2.8 灵敏性试验
试验结果(图8)显示,对ASFV 临床阳性血清作1:800、1:1 600、1:3 200、1:6 400 稀释,当稀释至1:3 200 时,OD450=0.352(>0.22),表明该方法对1:3 200 稀释的ASFV 阳性血清仍可检测出阳性。
2.9 重复性试验
试验结果(表2)显示,4 份猪血清样品批内4 次重复检测和3 份血清5 批次间重复检测的OD450值变异系数均低于10%,表明该ELISA 方法具有良好的重复性。
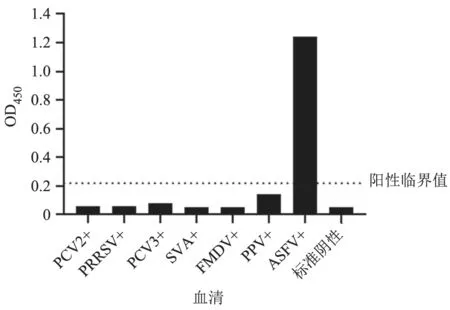
图7 特异性试验结果
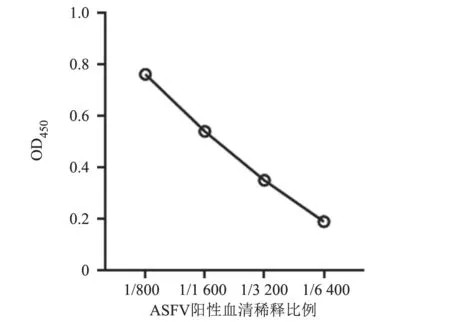
图8 灵敏性试验检测结果

表2 重复性试验检测结果
2.10 临床样品检测比较
用ASFV P30 和ASFV P30-2His6 分别作为抗原构建的iELISA 检测方法,检测已确认的15 份ASFV 临床阳性血清(表3)和40 份ASFV 阴性血清(表4)。结果显示,这2 种检测方法对阳性血清的判断完全相同。而在对阴性血清,用ASFV P30-2His6 为包被抗原的iELISA 检测,有27 份出现了弱阳性或可疑的检测结果,只有13 份为阴性,符合率为32.5%(13/40);ASFV P30 为包被抗原的iELISA 检测,结果全为阴性,符合率为100%(40/40)。

表3 两种重组蛋白构建的iELISA 检测方法临床阳性样本检测结果比较
3 讨论
在ELISA 检测中,使用重组蛋白作为抗原与从感染细胞提取物中提取抗原相比具有许多优点。这些重组抗原的来源简单,消除了细胞化合物污染抗原所产生的假阳性反应,避免了在抗原生产中使用活病毒,并允许在抗原生产中实现更好的标准化[11]。基因工程生产重组蛋白,根据表达载体不同主要分为原核表达系统和真核表达系统,其中原核表达系统因其具有背景清楚、操作简单、成本低等优点而被广泛运用于实际生产中[12]。
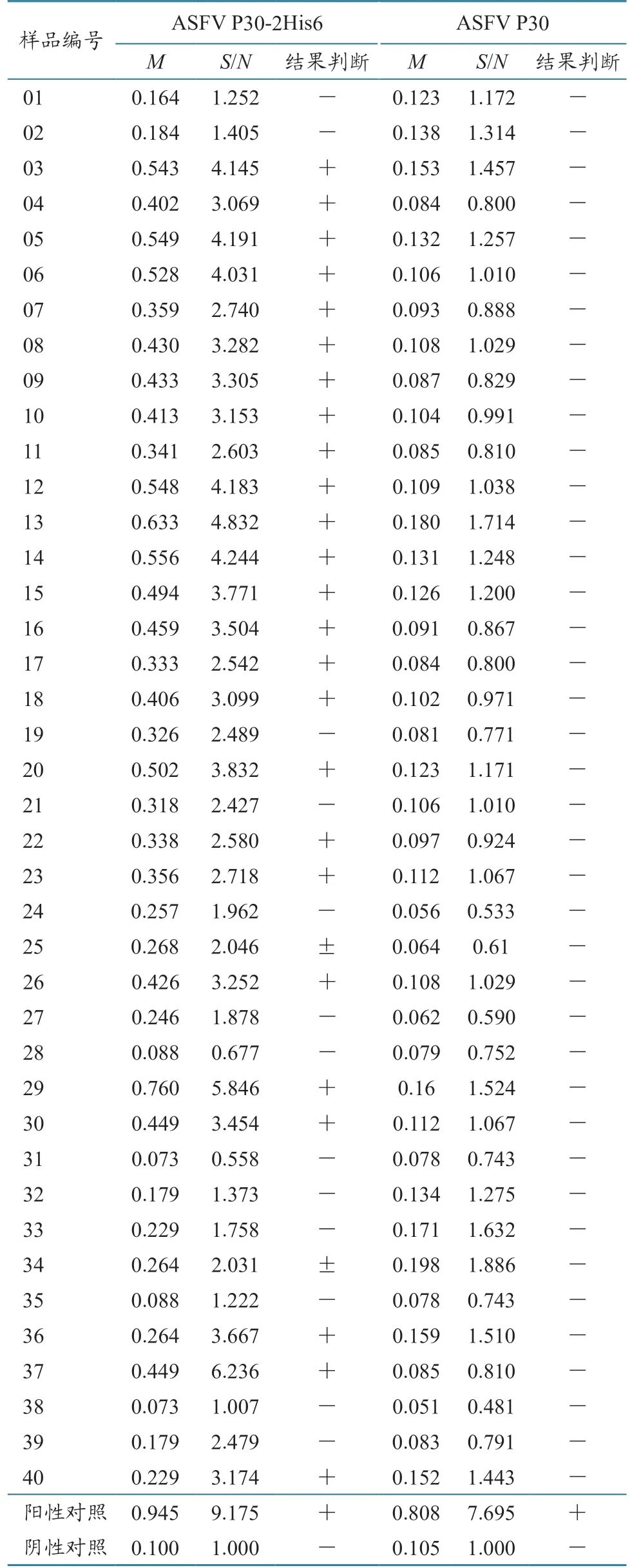
表4 两种重组蛋白构建的iELISA 检测方法临床阴性样本检测结果比较
ASFV 能够持续存在于自然宿主和感染后康复的家猪体内,呈现较低毒力,表明该病毒具有有效机制来逃避宿主防御系统[13-14]。因此,在缺少有效疫苗的条件下,只能通过扑杀的方式来控制ASF的蔓延[15],因此早发现早处理显得尤为重要。能用于ASFV 抗体检测的抗原蛋白可有多种,其中P30、P72 和P54 结构蛋白具有较好的诊断意义。ASFV P72 结构蛋白是病毒衣壳的主要成分,也是目前研究最多的诊断靶标。Tabares 等[16]就以P72蛋白作为包被抗原成功建立了抗体检测试剂盒。该蛋白在病毒感染晚期表达,免疫原性好、保守性强[17]。ASFV P54 蛋白具有很强的免疫原性,是Western-blot 诊断疫病时最令人关注的病毒蛋白之一[18-19]。ASFV P54 主要含有线性表位,而P30 主要含有构象表位。因此,这些蛋白表位结构的差异可以解释ELISA 和Western-blot 中发现的P30 和P54 反应性的不同[20]。相比于P72 和P54 蛋白,建立ASFV P30 iELISA 检测方法可以早期检测和处理感染[21]。
本研究在ASFV P30-2His6 的基础上,利用基因工程原理设计引物去除His 标签,构建了以pET-28a(+)为表达载体的ASFV P30 蛋白表达工程菌。相比较于用酶切蛋白去除His 标签[22],本研究建立的方法在去除His 标签的同时不影响蛋白的其他性状,使ASFV P30 蛋白的表达量高,水溶性好,因而有利于规模化生产。与吴竞等[23]利用pET-32a(+)载体成功表达带有His 标签的包涵体ASFV P30 蛋白建立的iELISA 检测方法相比,本研究表达的P30 蛋白是水溶性的无标签蛋白,在临床应用上更有优势,可以消除带组氨酸标签的基因工程疫苗免疫猪造成的假阳性。去掉His 标签后不能用亲和层析的方法来纯化,只能选择凝胶过滤层析和阴离子交换柱等方法进行纯化,因此纯化难度相对较高[24]。本研究将纯化后的蛋白经过SDSPAGE 分析和灰度扫描,发现纯化后的重组ASFV P30 蛋白纯度为95%,而用镍柱纯化的重组ASFV P30-2His6 纯度为98%,可见镍柱的纯化效率更高。但是iELISA 检测结果明确表明,尽管ASFV P30纯度稍低,然而不仅没有影响检测的准确率,而且由于去除了His 标签,消除了假阳性检测结果,极大提高了检测的准确性和可靠性。在对40 份背景清晰的阴性血清检测过程中,用ASFV P30-2His6为包被抗原的iELISA 检测时,有27 份血清检测结果为弱阳性或可疑,只有13 份为阴性,而用ASFV P30 为包被抗原的iELISA 检测时,40 份血清均为阴性。进一步比对分析这40 份阴性血清来源,发现这27 份检测结果为弱阳性或可疑的血清,均来自至少免疫过带His 标签亚单位疫苗2 次的猪场,13 份检测结果为阴性的血清,均来自没有免疫过带His 标签亚单位疫苗的猪场。
对于该检测方法的阳性临界值确定,单纯以OD450值作为判断依据无法完全避免批次间或批次内不同时间段检测对试验结果的影响。阴性血清用不同批次的试剂盒或用同一批次试剂盒在不同时间段检测的数据都有小幅波动,其变异系数(CV)为5%~10%。引入一个标准阳性(S/P,样本OD450/标准阳性OD450)或标准阴性(S/N,样品OD450/阴性OD450),可以最大限度消除这种差异对结果判断的影响。而S/N值的可靠性和稳定性更好。
国际上公认ELISAS/N≥2.1 为抗体阳性判断标准。而P30 蛋白检测ASFV 抗体的灵敏性非常高,为了降低假阳性出现的概率而将S/N的阈值定为2.5,当待检血清样品的S/N≥2.5 时判定为ASFV抗体阳性(+),2.5 >S/N≥2.0 判断为可疑(±),S/N<2.0 判断为阴性(-)。因此,本研究仅在特异性、灵敏性、重复性试验中单独使用OD450值作为判断标准,而临床样品检测均同时列出OD450值和S/N值。
综上所述,本研究建立了一种针对ASFV P30 蛋白的iELISA 检测方法。该方法可用于检测ASFV 的早期感染,具有较好的特异性、灵敏性和可重复性,同时还可以消除带有His 标签的基因工程疫苗免疫后所造成的假阳性反应,是一种有效的ASFV 检测方法。
