五种重要犬病毒微流控芯片检测方法的建立及应用
2021-05-11
(上海海关动植物与食品检验检疫技术中心,上海 200135)
狂犬病毒(rabies virus,RV)、伪狂犬病毒(pseudorabies virus,PRV)、犬 瘟 热 病 毒(canine distemper virus,CDV)、犬 细 小 病 毒(canine parvovirus,CPV)和犬冠状病毒(canine coronavirus,CCV)是5 种重要的犬科动物传染病病原,严重影响犬科动物的健康[1~6]。微流控芯片技术(microfluidic chip assay)是一种基于环等温扩增技术(loop mediated isothermal amplification,LAMP)的高通量快速核酸检测技术。它将不同病原特异性引物固化在同一块塑料芯片不同的微孔反应槽内;这些微孔反应槽与加样孔相连,通过离心把待检核酸样本均匀地甩入各微孔反应槽内;每块塑料芯片有8 个加样孔,每个加样孔与4 个微孔反应槽相连,故理论上在1 块芯片的8 个加样孔加入同一份待检核酸,可以实现32 种不同病原的同步检测[7]。与传统PCR 或者荧光PCR 的单病原检测相比,微流控检测技术使高通量同时筛查多重犬科动物疫病成为可能,但微流控检测的技术原理为LAMP,其检测的敏感性与LAMP 检测方法一致,介于PCR 和荧光PCR。
本研究在建立针对RV、PRV、CDV、CPV和CCV LAMP 检测方法的基础上,将这些单病原LAMP 检测体系固化于芯片微孔反应槽内,制备了5 种犬科动物病毒微流控检测芯片,并用不同的病毒样本及临床样本进行测试,确认了建立的微流控芯片检测方法的有效性和稳定性。
1 材料与方法
1.1 主要试剂和材料
TRIzol,购自Invitrogen 公司;Taq酶、AMV逆转录酶、RNA 酶抑制剂、dNTP、随机引物,购自Takara 公司;Bst DNA 聚合酶,购自美国NEB公 司;DNA 抽 提 试 剂 盒(QIAamp DNA Blood Mini Kits),购自QIAGEN 公司;微流控芯片及微流控检测仪,购自上海速芯生物科技有限公司。其他试剂,均购自国药集团上海化学试剂有限公司。
1.2 病毒样品来源及处理
RV、PRV、CDV、CPV 和CCV 等毒株和相关临床样本,由本单位保存备用;仙台病毒(Sendai virus,SV)和鼠肝炎病毒(murine hepatitis virus,MHV),由上海实验动物中心提供;淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus,LCMV)阳性质粒,由生工生物工程(上海)股份有限公司合成。
将待检组织或粪便等临床样品加等体积PBS研磨匀浆,3 000 r/min离心15 min,收集上清液待检。
1.3 核酸抽提及cDNA 模板制备
对于RV、CDV、CCV 待检样品,取100 μL上清液或血清,加入1 mL TRIzol 试剂提取RNA,并将提取的RNA 溶解于30 μL DEPC 水中;取11 μL RNA 溶液,加入5 倍逆转录酶浓缩缓冲液4 μL、dNTP 1 μL、随机引物1 μL、RNA 酶抑制剂1 μL、AMV 逆转录酶2 μL,置于PCR 仪42 ℃反应30 min,即得cDNA 模板。
对于PRV、CPV 待检样品,取200 μL 上清液或体液样本,按照DNA 抽提试剂盒说明书提取病毒DNA,最后将提取的DNA 用100 μL DEPC 水溶解。
1.4 LAMP 引物设计与合成
使用Vector NTI Suite 软件分析不同国家和地区分离的RV(Genbank 登录号:CQ918139)、PRV(Genbank 登 录 号:KT329439)、CDV(Genbank 登录号:KF914669)、CPV(Genbank登 录 号:MF805795)、CCV(Genbank 登 录号:KT852997)基因保守序列。将序列在线导入Primer Explorer V5 软 件(primerexplorer.jp/e/),设计上述5 种病毒的LAMP 引物(表1)。所有引物均由生工生物工程(上海)股份有限公司合成。

表1 5 种犬病毒LAMP 引物序列
1.5 微流控芯片制作及检测
微流控芯片外形如CD 盘,直径约80 mm,由聚甲基丙烯酸甲酯(PMMA)制成。芯片由4个独立单元构成,每个单元有2 个加样孔和8 个反应槽,每个加样孔与4 个反应槽相连,但加样孔之间以及反应槽之间不连通。将Bst 大片段DNA聚合酶(1 μL)、聚合酶缓冲液(10 μL)、dNTP(2 μL)、荧光染料和不同引物组混合液(2 μL),混合后加至不同的反应槽,用透明封膜将加样槽上样孔封闭。在同1 个独立单元的两个加样孔中分别加入5 μL 待检样本的核酸,用透明膜密封加样孔。将加样孔固定于微流控检测仪转盘柱上,盖好机器盖。机器运行条件:63.5 ℃孵育45 min。反应结束后,查看荧光扩增曲线,进行结果判定。
1.6 微流控芯片检测CPV 敏感性试验
为测试微流控芯片检测方法的敏感性,将提取的CPV 感染犬的总DNA 样本进行定量并梯度稀释,制备浓度分别为100、101、102、103、104和105copies/mL 的DNA 模板,再使用微流控芯片方法检测。
1.7 临床样本检测
为进一步验证建立的微流控芯片检测方法的可靠性,将不同时期收集的6 份CDV 感染样品(犬肺、肝、脾、肾、血液临床样本以及口鼻液拭子)、10 份CPV 感染样品(犬粪便、肝、脾、肺、肾和血液临床样品)以及6 份CCV 感染样品(犬粪便、肝、脾、肺、肾和血液临床样本),共计22 份阳性样本和24 份健康犬粪拭子,使用微流控芯片进行检测。
2 结果与分析
2.1 微流控芯片检测5 种病毒特异性试验
设置MHV、SV 和LCMV 反应槽为阴性对照,使用5 种犬病毒的核酸样本测试微流控芯片检测特异性。结果(图1~5)显示,经微流控芯片检测,在 反 应10~25 min 后,RV、PRV、CDV、CPV 和CCV 核酸样本均出现了相应荧光扩增曲线,各病毒与其他病毒之间未出现交叉反应,同时所有阴性对照病毒(MHV、SV、LCMV)的反应槽均未出现荧光扩增信号。

图1 微流控芯片检测RV 特异性试验结果

图2 微流控芯片检测PRV 特异性试验结果
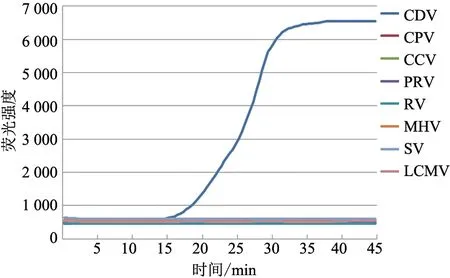
图3 微流控芯片检测CDV 特异性试验结果

图4 微流控芯片检测CPV 特异性试验结果
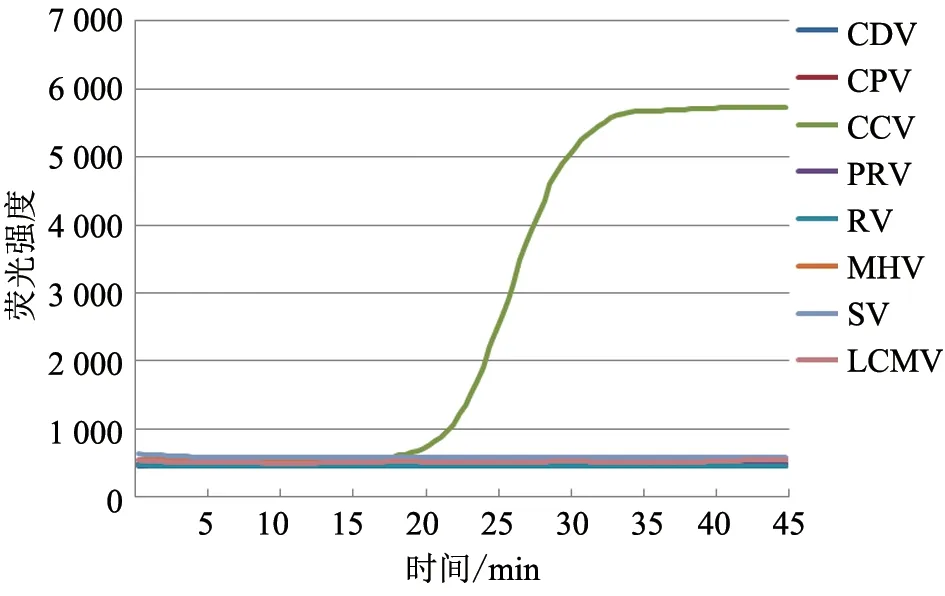
图5 微流控芯片检测犬CCV 特异性试验结果
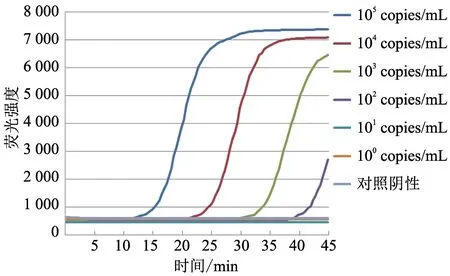
图6 微流控芯片检测犬CPV 敏感性试验结果
2.2 CPV 敏感性试验
使用微流控芯片方法检测不同浓度梯度的CPV DNA 模板。结果(图6)显示,微流控芯片检测CPV DNA 模板下限量为102copies/mL。
2.3 临床样本检测
使用微流控芯片对22 份临床阳性样本和24份健康犬粪拭子进行检测。结果显示,经微流控芯片检测,所有CDV、CPV、CCV 感染犬的临床样本在反应10~30 min 后,均出现相应病毒荧光扩增信号,其中组织样本的扩增信号较强,而24 份健康犬粪拭子样本经检测未出现荧光扩增信号。该结果与PCR 检测结果一致。
3 讨论
微流控芯片检测技术是近年来兴起的高通量核酸检测技术。它基于LAMP 检测技术,将不同病原LAMP 检测体系点制于圆盘形塑料基片上,通过离心将加样孔内的待检核酸样本分散到圆盘基片不同LAMP 检测体系反应槽中,然后通过微流控设备的光敏部件检测反应槽中荧光染料信号变化,以判定是否有目的基因特异性扩增[8-9]。理论上,该技术可以实现30 多种病原的同步检测。由于微流控芯片检测原理仍然是LAMP 技术,其检测的特异性、敏感性和可靠性与LAMP 技术相近。本研究尝试将RV、PRV、CDV、CPV 和CCV 等5 种犬病毒LAMP 反应体系点制于微流控芯片上,研究将微流控技术应用于多种犬病毒快速检测的可行性。通过特异性试验,证实微流控芯片检测具有良好的特异性,其仅能检出待检核酸中特定病毒,其他无关病毒均未出现交叉反应。通过敏感性试验,证实微流控芯片检测CPV 的下限为102copies/mL,其与LAMP 和普通PCR 方法的检测下限相近。通过对CDV、CPV 和CCV 感染犬采集的46 份临床样本检测,证实微流控芯片检测方法具有较好的稳定性和可靠性,受试样本未出现阳性漏检和阴性误检出。由于LAMP 引物设计由网络软件自动生成,有些保守区域软件无法找到合适引物,而搜索出的引物其覆盖序列不一定保守。特别是,针对变异度较大的RNA 病毒,LAMP 检测引物的兼容性存在一定问题,只能通过多设计几对不同引物进行覆盖。此外,LAMP 引物偏长,对于一些易变病毒,设计出理想的、保守度高的引物十分困难。当然,作为一种技术和设计理念的创新,微流控技术有其可取的一面,它使得同步高通量筛查多种病原成为可能[10]。
本研究建立了5 种重要犬病毒的微流控芯片检测方法,与传统PCR 方法相比,微流控芯片检测周期较短,仅需40 min 就可完成多种病毒的同时检测,操作简单、检测设备便携(笔记本类似大小,1 次充电可运行12 h)、结果判定简便直观,特别适于现场及野外检测。本研究建立的微流控芯片检测新方法,不仅可应用于出入境口岸宠物及野生动物检疫,同时也适合野外监测点、犬猫科动物繁育场和一线兽医检测实验室使用,这对控制犬科动物重大传染病传播,减少特种动物养殖业经济损失,保护公众健康都具有十分重要的意义。
