NF-κB和iNOS在ALT≥400U/L慢性乙型肝炎患者的表达及临床意义*
2021-05-11陈邦银
陈邦银 黄 津
福建医科大学附属南平第一医院感染科,福建省南平市 353000
慢性乙型肝炎(Chronic hepatitis B,CHB)仍是一类危害人类健康的慢性传染病,据统计可达上百万人次死于因HBV感染相关性疾病,尤其在我国发病率和住院率均较高,目前尚无可以彻底治愈CHB的药物[1]。肝病研究学者们对乙型肝炎(乙肝)的发病机制仍在不断的探索,至今仍有许多疑问亟待解决,认为HBV感染的发病机制与CHB患者的年龄、病毒载量、机体免疫以及传播途径等因素有关[2]。
NF-κB属于重要的转录因子,尤其是在细胞内发挥着关键作用,介导多种炎症传导途径的特异性反应,可调控机体中性粒细胞、肝细胞、内皮细胞、胆管细胞、淋巴细胞等免疫反应,发挥着较强的桥接和承上启下的功能[3]。诱导型一氧化氮合成酶(inducible nitric oxide synthase,iNOS)作为NF-κB下游的关键信号结合因子,参与各种炎症因子的致病过程,可介导各种免疫细胞反应,比如氧化应激、抗原抗体反应、细胞凋亡等,在病毒性肝炎中可分泌大量致炎因子一氧化氮[4]。因此,本文通过研究CHB患者外周血中NF-κB、iNOS的表达水平,了解其致炎过程,进一步发掘潜在的免疫治疗靶点。
1 资料与方法
1.1 一般资料 纳入南平市第一医院感染性疾病科在2017年4月10日—2020年4月10日收治的80例CHB患者作为肝炎组,所研究对象肝功能要求谷丙转氨酶(ALT)≥400U/L,男44例,女36例,年龄19~66岁,平均年龄(47.5±11.2)岁;从我院体检中心选取60例健康人群作为对照组,男33例,女27例,年龄18~59岁,平均年龄(47.3±9.3)岁。两组年龄、性别比较差异无统计学意义(P>0.05),均签署知情同意。入选标准:HBsAg阳性>6个月,且HBV DNA持续阳性,ALT≥400U/L[5]。排除标准:排除其他类型的病毒性肝炎、药物性肝炎、重型肝炎、中晚期肝硬化、肝细胞癌、自身免疫性肝病等;同时排除合并妊娠、心血管系统疾病、血液病、重症感染性疾病、内分泌系统疾病、风湿免疫性疾病、呼吸系统疾病以及恶性肿瘤等。
1.2 方法
1.2.1 主要仪器和试剂:冷冻离心机(Eppendor公司,德国);凝胶成像系统(Eppendor公司,德国);Bandscan5.0图像分析软件(Bio-Rad公司,美国);酶标仪(Labststems公司,芬兰);超低温冰箱(三洋公司,日本);Trizol裂解液(Invitrogen公司,美国);一氧化氮ELISA试剂盒(BD公司,美国);人NF-κB p65抗体和人iNOS抗体(Bio-Rad公司,美国)。
1.2.2 RT-PCR检测NF-κB mRNA和iNOS mRNA表达:两组标本均取外周血液6ml,分离出血浆(离心半径10cm,1 500r/min,离心5min),将血清吸出制成细胞悬液,往细胞悬液中加Trizol裂解液200μl进行裂解,严格根据说明书步骤提取总RNA,并反转录cDNA。根据GenBank给出的序列设计引物,详见表1。
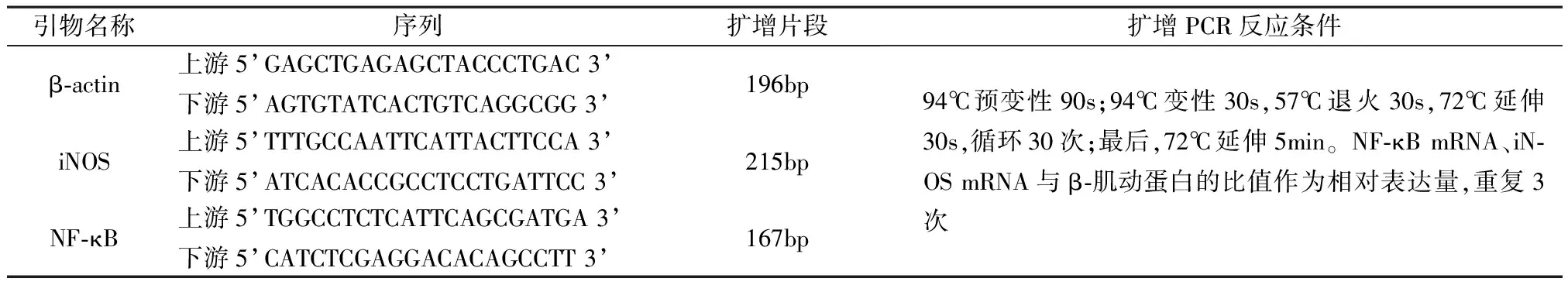
表1 NF-κB、iNOS和β-actin引物序列
1.2.3 Western Blot方法检测NF-κB和iNOS蛋白的表达:采集清晨空腹静脉血5ml,将外周血配成细胞混悬液,加入裂解液,通过高速离心获得蛋白、检测蛋白浓度,取20μg蛋白进行凝胶电泳,湿法转膜。在室温下用50g/L牛血清白蛋白封闭液进行封闭2h,洗膜后加NF-κB、iNOS、GAPDH一抗孵育,4℃封闭过夜,加入二抗孵育2h,最后曝光、显影、定影,结果用NF-κB/GAPDH、iNOS/GAPDH比值表示(Bandscan5.0软件分析)。
1.2.4 ELISA检测NO水平:严格依据NO检测试剂盒操作,绘制标准曲线,结果以各组OD值表示。

2 结果
2.1 两组NF-κB mRNA和iNOS mRNA表达水平 所有实验数据均重复3次,并计算两组相对表达量,肝炎组NF-κB mRNA和iNOS mRNA的表达水平均高于对照组,二者具有显著性差异(均P<0.01),详见表2。
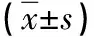
表2 两组NF-κB mRNA和iNOS mRNA表达情况
2.2 两组NF-κB和iNOS蛋白表达水平 肝炎组NF-κB和iNOS蛋白表达水平均高于对照组,二者差异有统计学意义(均P<0.05),详见表3、图1。
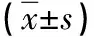
表3 两组NF-κB和iNOS蛋白的表达情况
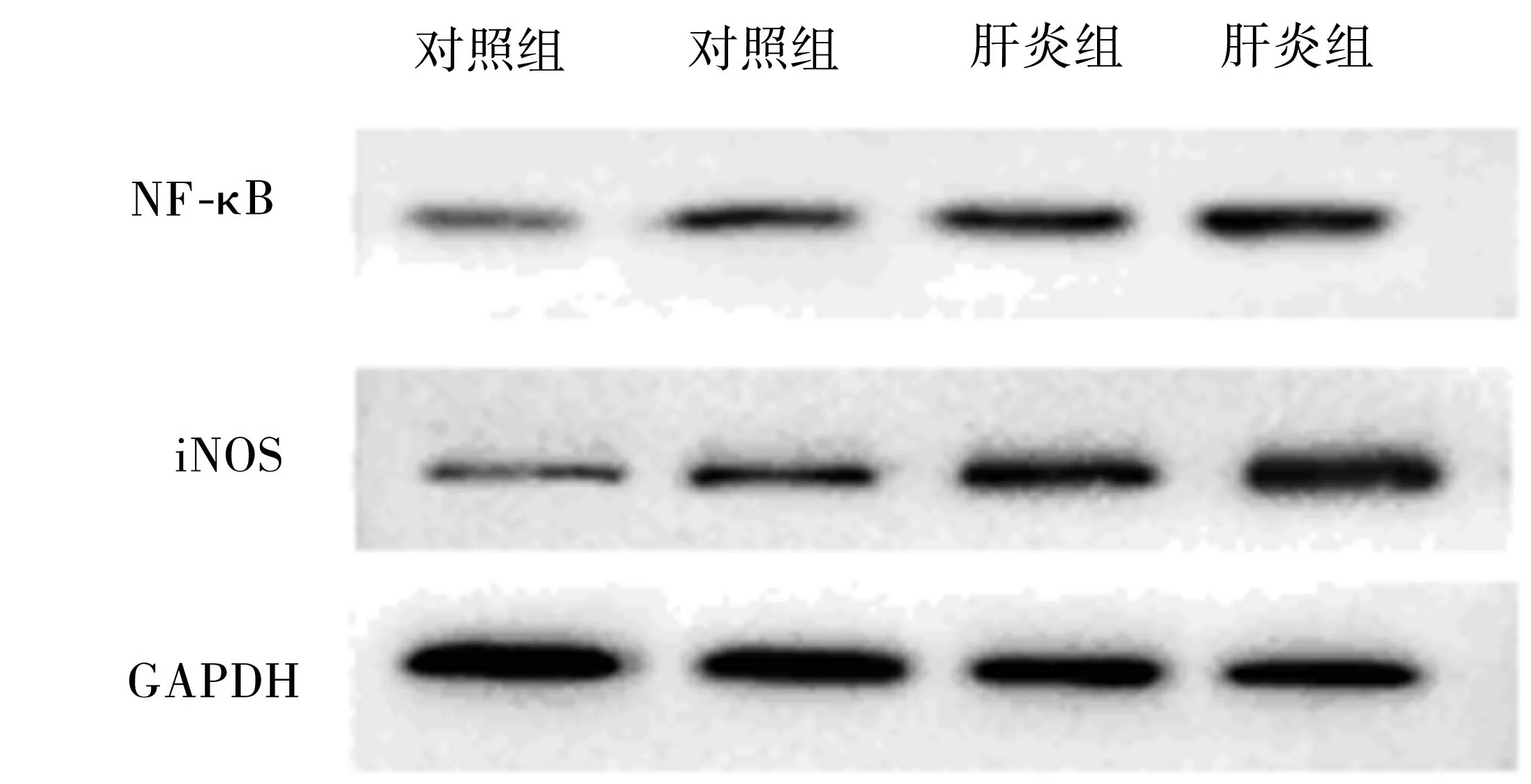
图1 NF-κB、iNOS和GAPDH蛋白表达情况
2.3 两组NO水平的比较 肝炎组的NO水平为(112.51±20.73)μmol/L,明显高于对照组的(65.18±14.54)μmol/L,差异均有统计学意义(t=18.34,P=0.001<0.05)。
3 讨论
大多数HBV感染者可以通过机体较强的免疫反应将病毒完全清除,仍有部分HBV感染者因免疫功能紊乱,最终演变成慢性HBV病毒感染,如果不注意诱因的控制,随时有可能激发乙肝病毒复制[5]。研究表明[6],慢性乙型肝炎具有一定个体差异,每个感染者的免疫状态、病毒活跃指数、肝细胞的炎症程度都不完全一致,在机体免疫应答具有一定调控作用。本研究通过以慢性乙型肝炎患者作为研究对象,通过基因检测和蛋白检测手段分析NF-κB、iNOS、NO在乙肝患者中的表达,发现肝炎患者的上述指标明显高于健康对照组人群,提示NF-κB、iNOS、NO等炎症因子可能参与慢性乙型肝炎的发生发展过程,有望通过干预NF-κB、iNOS、NO等细胞因子控制炎症反应。
NF-κB经过很多学者证实,属于一种重要细胞核内的转录因子,参与多种细胞的炎症信号传导通路,由于其具有多向性调节功能,起着关键的桥接作用[7]。NF-κB对体液免疫和细胞免疫亦具有显著作用,可以通过调节B细胞Ig基因的表达,同时T细胞的增殖活化也很关键,可促使下游iNOS增多,分泌大量的一氧化氮,可造成细胞和组织损伤[8]。王翔鹏等[9]学者通过建立小鼠肝损伤模型,采用刀豆蛋白A干预肝损伤模型,发现随着刺激诱导时间的延长,NF-κB转入核内水平持续上升,小鼠肝组织内生成超过生理剂量并具有细胞毒性的NO,加重肝组织免疫损伤。还有研究报道[10],通过建立免疫性损伤小鼠模型,使用NF-κB抑制剂后可下调iNOS的表达,减少NO的分泌,最终减轻小鼠免疫性肝损伤,由此认为NF-κB调控iNOS、NO可能是出现肝脏免疫性损伤的关键环节之一。本研究发现二者在肝炎组表达水平增高,与对照组相比差异尤为明显(P值<0.05),随之分泌的NO水平亦明显升高,由此推想NF-κB、iNOS、NO可能在肝脏疾病的炎症中起重要作用。
综上所述,慢性乙型肝炎实质上亦属于一种免疫性疾病,认为导致肝细胞损伤的主要原因是HBV感染后激发机体的细胞免疫反应,我们通过临床与基础的研究,发现可能存在NF-κB-iNOS-NO这样一条信号通路,可能参与慢性乙肝的炎症反应过程,期望未来通过该通路挖掘出新的治疗靶点。
